【论著】| 派安普利单抗联合安罗替尼和化疗围手术期治疗局部进展期胃癌的探索性研究
2024-08-24 中国癌症杂志 中国癌症杂志 发表于上海
本研究选用ICI联合抗血管生成药物联合化疗的治疗方案。
[摘要] 背景与目的:局部进展期胃癌(locally advanced gastric cancer,LAGC)的围手术期治疗已达成共识,但如何选择一种高效、安全的治疗方案仍有很多争议,既往已有相关研究证实了化疗联合免疫检查点抑制剂(immune checkpoint inhibitor,ICI)、化疗联合抗血管生成药物在LAGC围手术期治疗中的有效性,因此,本研究旨在探讨ICI联合抗血管生成药物和化疗的围手术期治疗方案,以期为LAGC患者的围手术期治疗方案的选择提供更多参考。方法:本研究为前瞻性、单臂探索性研究,旨在评估派安普利单抗联合安罗替尼和化疗围手术期治疗潜在可切除的T3~4N+M0期LAGC的有效性和安全性,选择2022年1月—2023年12月就诊于内蒙古自治区人民医院的LAGC患者作为研究对象,设置主要研究终点为病理学完全缓解(pathological complete response,pCR)率和主要病理学缓解(main pathological remission,MPR)率,次要研究终点为手术转化率、客观缓解率(objective response rate,ORR)、无病生存期(disease-free survival,DFS)、无进展生存期(progression-free survival,PFS)和不良反应等,根据欧洲癌症治疗研究组织(European Organization for Research on Treatment of Cancer,EORTC)QLQ-STO22中文版量表评估患者接受治疗前后的生活质量。本研究经内蒙古自治区人民医院伦理委员会审查批准(编号:202404604L)。结果:共有32例患者参与本研究,ORR为78.1%(25/32),其中18例患者接受了手术治疗,pCR率为22.2%(4/18),MPR率为38.9%(7/18),未行手术的患者的中位PFS为9.8个月(95% CI:7.6~13.1),中位随访时间为16.4个月(95% CI:11.7~22.5)。对于行根治性手术切除的患者,中位DFS未达到,1年DFS率为88.8%(16/18)。治疗后常见的不良反应包括骨髓抑制、肝功能异常、腹泻及神经毒性,大多数不良反应为1~2级,少数为3级,未发生4~5级不良反应。根据EORTC QLQ-STO22中文版量表评估发现,在吞咽困难、疼痛及进食受限领域有明显改善,同时,在焦虑、反流症状领域也所好转,在躯体形象领域改善不明显。结论:在LAGC围手术期治疗中,奥沙利铂+替吉奥+安罗替尼+派安普利单抗的联合治疗方案,在保证安全性的同时,能够提高疗效,有望成为LAGC新的治疗方式。
[关键词] 局部进展期胃癌;围手术期治疗;免疫治疗;抗血管生成治疗;疗效评价;生活质量评估
[Abstract] Background and purpose: There is a consensus within the medical community regarding the perioperative treatment of locally advanced gastric cancer (LAGC), yet the selection of an efficient and safe treatment strategy remains a contentious issue. Previous studies have validated the effectiveness of chemotherapy in conjunction with immune checkpoint inhibitor (ICI) and anti-angiogenic agents in the perioperative treatment of LAGC. This study aimed to investigate the perioperative treatment regimen combining ICI, anti-angiogenic drugs and chemotherapy, in order to provide additional references for the selection of perioperative treatment strategies for patients with LAGC. Methods: This was a prospective, single-arm exploratory study designed to assess the efficacy and safety of perioperative treatment with penpulimab combined with anlotinib and chemotherapy for potentially resectable stage T3-4N+M0 LAGC. Patients diagnosed with LAGC at the Inner Mongolia Autonomous Region People’s Hospital from January 2022 to December 2023 were enrolled in the study. The primary endpoints were pathological complete response (pCR) rate and major pathological remission (MPR) rate, while secondary endpoints included surgical conversion rate, objective response rate (ORR), disease-free survival (DFS), progression-free survival (PFS) and adverse reactions. Quality of life before and after treatment was evaluated using the European Organization for Research on Treatment of Cancer (EORTC) QLQ-STO22 Chinese version questionnaire. This study was reviewed and approved by the Ethics Committee of Inner Mongolia Autonomous Region People’s Hospital (number: 202404604L). Results: A total of 32 patients participated in the study, with an ORR of 78.1% (25/32). Of these, 18 patients underwent surgical treatment, achieving a pCR rate of 22.2% (4/18) and a MPR rate of 38.9% (7/18). The median PFS for patients who did not undergo surgery was 9.8 months (95% CI: 7.6-13.1), and the median follow-up duration was 16.4 months (95% CI: 11.7-22.5). For patients who received radical surgical rep, the median DFS was not reached, and the 1-year DFS rate was 88.8% (16/18). Common adverse reactions following the treatment included myelosuppression, liver function abnormalities, diarrhea and neurotoxicity, with most adverse events being grade 1-2, a few grade 3 adverse events, and no grade 4 or 5 adverse events. According to the EORTC QLQ-STO22 Chinese version questionnaire, significant improvements were observed in the domains of difficulty swallowing, pain and eating restrictions. Additionally, improvements were noted in anxiety and reflux symptoms, while changes in body image were less pronounced. Conclusion: In the perioperative treatment of LAGC, the combination therapy of oxaliplatin, tegafur, anlotinib and penpulimab can improve the efficacy while ensuring safety, and is expected to become a new treatment for LAGC.
[Key words] Locally advanced gastric cancer; Perioperative treatment; Immunotherapy; Anti-angiogenic therapy; Efficacy evaluation; Quality of life assessment
2021年癌症统计数据[1]显示,中国胃癌发病率仅次于肺癌,居第2位,死亡率居第3位,是严重危害中国居民健康的重大疾病之一。中国的早期胃癌比例低,进展期胃癌比例高,5年生存率低,与韩国、日本等国家的生存差距较大[2]。
以手术为主的综合治疗是胃癌治疗的主要模式,中国的RESOLVE研究[3]结果在2019年欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会上发布,为胃癌围手术期治疗方案的选择提供了“中国证据”,围手术期新辅助化疗优于单纯术后辅助化疗,就中国人群术后辅助化疗而言,奥沙利铂+替吉奥(SOX)方案不劣于奥沙利铂+卡培他滨(CAPOX)方案。新辅助治疗的优势在于:① 降期并治疗寡转移,从而提高R0切除率,降低复发可能;② 耐受性较好,可有效地提高患者依从性;③ 为后续治疗提供方案及依据[4]。
程序性死亡蛋白-1(programmed death-1,PD-1)是一种主要在活化T淋巴细胞中表达的负性共刺激受体,在终止免疫反应和预防自身免疫中起着关键作用[5]。免疫治疗(PD-1抑制剂)在转移性胃癌一线治疗中的成功应用,为胃癌患者围手术期治疗带来希望[6]。2023年ESCO年会上公布的KEYNOTE-585 Ⅲ期和MATTERHORN Ⅲ期临床研究[7-8]结果显示,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)联合化疗较安慰剂联合化疗的病理学完全缓解(pathological complete response,pCR)率显著提高,差异有统计学意义,且不良反应可控。同时,抗血管生成治疗联合化疗在局部进展期胃癌(locally advanced gastric cancer,LAGC)围手术期治疗中也有相关研究,一项阿帕替尼联合FLOT方案的研究[9]结果显示,联合治疗组较单纯化疗组有更高的客观缓解率(objective response rate,ORR)、R0切除率、肿瘤退缩分级(tumor regression grade,TRG)及ypTNM分期,表明阿帕替尼联合化疗较单纯化疗在LAGC患者新辅助治疗中的有效性更高。
基于ICI、抗血管生成治疗在LAGC围手术治疗中的有效性及安全性,有基础研究[10]表明,肿瘤血管生成在肿瘤进展中发挥关键作用,与ICI类似,抗血管生成药物靶向肿瘤细胞以外的肿瘤微环境(tumor microenvironment,TME)成分,并通过促进CD8+ T淋巴细胞浸润和活化发挥与ICI的协同作用。有研究[11]表明,抗血管生成药物可以重编程TME,并将内在免疫抑制TME转化为免疫支持TME,来增强ICI的疗效。因此,本研究选用ICI联合抗血管生成药物联合化疗的治疗方案。
1 资料和方法
1.1 患者入组标准
本研究为前瞻性、单臂探索性研究,旨在评估派安普利单抗联合安罗替尼和化疗围手术期治疗对潜在可切除的T3~4N+M0期LAGC的有效性和安全性。入组标准:① 年龄为18~80岁,性别不限;② 经病理学(组织学或细胞学)检查确诊的LAGC患者;③ 根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版临床肿瘤TNM分期标准[12],经内镜超声和增强计算机体层成像(computed tomography,CT)检查确认为潜在可切除的T3~4N+M0期的胃癌患者;④ 具有可测量病灶[根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版标准[13],肿瘤病灶CT扫描长径≥10 mm,淋巴结病灶CT扫描短径 ≥15 mm],肿瘤直径>2 cm;⑤ 入组前初次诊断为胃癌,未接受过放疗、化疗、手术及靶向治疗;⑥ 主要器官功能正常,能接受规律治疗;⑦ 受试者自愿加入本研究,并签署知情同意书,依从性好,配合随访。本研究经内蒙古自治区人民医院伦理委员会审查批准(编号:202404604L)。
1.2 治疗方法
每例患者将接受3个周期新辅助治疗:安罗替尼8 mg,每个周期第1~14天给药,每天1次口服,早餐前约30 min服用(每天服药的时间应尽可能相同),以温开水送服,每3周重复1次;替吉奥,需按照患者体表面积给药(<1.25 m2时,40 mg/次;1.25~1.50 m2时,50 mg/次;>1.50 m2时,60 mg/次),每天2次口服,早晚餐后服用,连续给药14 d,休息7 d,为1个周期,每3周重复1次;奥沙利铂130 mg/m2,每个周期第1天给药,每3周重复1次;派安普利单抗固定剂量 200 mg,每个周期第2天给药,每3周重复1次。
1.3 评价方法及标准
1.3.1 疗效观察评价
记录每个治疗周期前后血常规、肝功能、肾功能、离子、肌钙蛋白、心肌酶及甲状腺功能等检查结果,每2个周期行胸腹部增强CT或磁共振成像(magnetic resonance imaging,MRI)检查,3~4个周期后通过多学科会诊评估是否能行手术治疗,治疗有效并行胃癌根治术+D2淋巴结清扫术的患者,术后继续给予原方案治疗满8个周期,派安普利单抗联合安罗替尼序贯治疗1年。治疗后疾病进展、不可手术切除或手术难以根治的患者,给予更换方案或姑息性综合治疗。pCR定义为新辅助治疗后手术切除的肿瘤组织标本,无肿瘤细胞残留;主要病理学缓解(main pathological remission rate,MPR)定义为新辅助治疗后手术切除的肿瘤组织标本,残留的肿瘤细胞≤10%;无病生存期(disease-free survival,DFS)定义为根据RECIST 1.1版标准受试者从随机化入组开始至疾病复发或(因任何原因)死亡的时间;ORR定义为所有随机分组且按照RECIST 1.1版标准评定为完全缓解(complete remission,CR)或部分缓解(partial remission,PR)的受试者所占的比例;R0切除率定义为切除后通过肉眼或显微镜观察切缘无肿瘤残留(切缘阴性)的受试者所占的比例。
1.3.2 不良反应评价
根据常见不良反应评价标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版[14]评价实验组和对照组患者治疗期间观察到的不良反应,根据不良反应的严重程度,分为5个等级:
1级:轻度,无症状或轻微,仅在临床或诊断时可以发现,无需治疗干预;2级:中度,需要最小的、局部的或非侵入性的干预,与年龄相关的工具性日常生活活动受到限制;3级:重度,对日常生活产生明显的影响;4级:危及生命,存在对生命的直接威胁;5级:死亡,由于不良反应导致的死亡。
1.3.3 生活质量评价
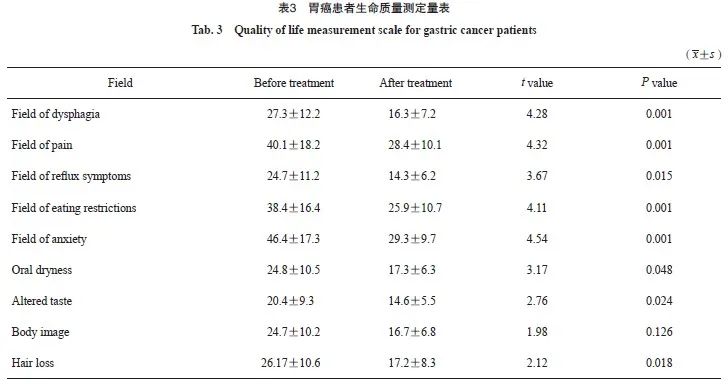
根据欧洲癌症治疗研究组织(European Organization for Research on Treatment of Cancer,EORTC)QLQ-STO22中文版量表对接受此治疗方案的患者治疗前后生活质量进行多维度评估,此量表的制定是将22个条目合并为9个症状领域,并将其分为从没有、有一点、较多和很多4个等级,对条目计分时,直接评1~4分,将各个领域所包括的条目得分相加并除以所包括的条目数即可得到该领域的得分,为了使得各领域得分能相互比较,采用极差化方法进行线性变换,将粗分转化为在0~100内取值的标准化得分,对于症状领域得分越高表明症状或问题越多(生命质量越差)[15]。治疗前通过调查问卷的形式记录其中包含的22个条目,并计算分数,治疗3~4个周期后再次对22个条目进行记录,再次计算分数,对治疗前后的分数进行统计学分析。
1.4 随访
所有接受治疗的患者,前2年内每3个月复查1次,主要的复查内容为腹盆腔增强CT、胸部CT、肿瘤标志物、生化、血常规及胃肠镜,通过电话、门诊就诊及住院观察等方式对患者进行随访,随访截至2023年12月。
1.5 统计学处理
采用SPSS 26.0软件对数据进行统计学分析。组间比较采用两独立样本t检验;计数资料以n(%)表示,组间比较采用χ2检验;生存分析采用Kaplan-Meier法,组间生存期的比较采用Log-rank检验。统计学检验均采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 基线数据
本研究共入组32例患者,男性19例,女性13例。20例患者年龄≥65岁,12例患者年龄<65岁,中位年龄为68岁。体重指数(body mass index,BMI)以23.9 kg/m2为截断值,14例患者BMI≥23.9 kg/m2,18例患者BMI<23.9 kg/m2。8例(25.0%)患者美国东部肿瘤协助组(Eastern Cooperative Oncology Group,ECOG)评分为2分。cT3和cT4的患者数分别为14例和18例,cN0-1和cN2-3的患者数分别为15例和17例。肿瘤位置:9例(28.1%)患者为食管胃,16例(50.0%)患者肿瘤位于胃体,其他部位占21.9%。25例患者合并基础疾病。3例患者为微卫星稳定(microsatellite stability,MSS),占9.4%,低度微卫星不稳定(microsatellite instability-low,MSI-L)的患者占84.4%,高度MSI(MSI-high,MSI-H)的患者占6.2%。程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)≥1%的患者占15.6%,POLE基因突变的患者仅占6.25%,其中1例患者为MSI-H、POLE共突变。
2.2 手术患者的病理学分析
在14例T3N+的患者中,10例实现了放射学降级,1例拒绝手术,1例因新冠肺炎疫情未能手术,其余8例均实现R0切除,其中2例达到pCR,3例达到MPR,中位随访时间为14.5个月,未见复发患者。在18例T4N+的患者中,13例实现了放射学降级,2例拒绝手术,1例因感染新冠肺炎疫情突发变化死亡,10例实现了R0切除,1例因考虑到有腹膜转移,未能行根治性切除,其中2例达到pCR,4例达到MPR,中位随访时间为12.6个月,有2例患者局部复发,1例患者出现肝转移病灶,这3例患者都是病理学反应较差的患者。在18例接受手术的患者中,2例出现胸腔积液、1例出现腹腔积液,未见出血及吻合口瘘等并发症。18例接受手术且实现R0切除的患者的疗效分析见表1。
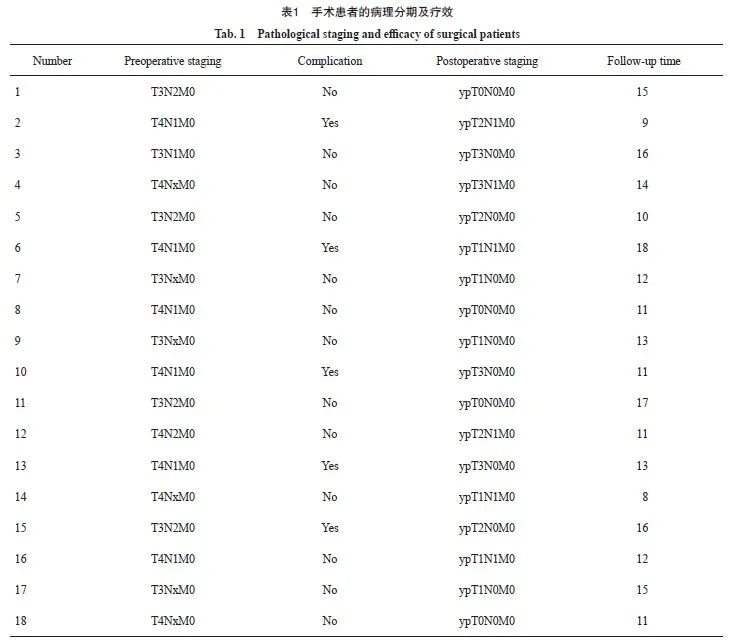
2.3 疗效评价
在32例接受此治疗的患者中,4例(12.5%)达到CR,21例(65.6%)达到PR,5例(15.6%)疾病稳定(stable disease,SD),整体的ORR为78.1%。截至2023年12月,中位随访时间为16.4个月(95% CI:11.7~22.5),对于行根治性手术切除的患者,DFS为其主要衡量指标,截至2023年12月,中位DFS未达到,1年DFS率为88.8%(16/18)。对于未能行手术切除的患者,中位无进展生存期(progression-free survival,PFS)为其主要衡量指标,截至2023年12月,中位PFS为9.8个月(95% CI:7.6~13.1),截至2023年12月,中位总生存期(overall survival,OS)未达到,1年OS率为93.8%。
2.4 治疗过程中的不良反应
本研究共有26例患者出现了不同程度的不良反应,其中骨髓抑制、肝功能异常、皮疹及腹泻的发生率较高,均超过30%,详见表2。

2.5 生活质量评估
研究结果显示,在吞咽困难、疼痛及进食受限领域有明显改善,同时,在焦虑、反流症状领域也较之前好转,在躯体形象领域改善不明显,可能与治疗周期较短有关(表3)。因此,我们在保证患者客观疗效的同时,更应在意患者的主观感受。
3 讨 论
对于LAGC,新辅助化疗已被广泛用于提高R0切除率和PFS,但其疗效仍受到低病理学消退的限制[16]。既往研究已证实,单独接受新辅助治疗的LAGC患者的平均pCR率为6.7%[17],而接受新辅助化疗联合免疫治疗的LAGC患者的平均pCR率可以达到20.0%[18],从理论上讲,由于免疫系统完整、新抗原充足和肿瘤克隆率低,新辅助治疗是免疫治疗的最佳选择。本研究通过在围手术期治疗中结合ICI、抗血管生成药物和化疗,实现了22.2%的pCR率和38.9%的MPR率,但因为手术患者倒数较少,且是单臂性研究,数据差异性比较大,并且是否能转化为生存获益仍需长时间随访,同时,对于未能行手术且治疗不敏感的患者,下一步的治疗该如何选择仍是需要探讨的问题。
本研究在保证疗效的同时,更重视治疗的安全性,因此在药物的选择方面,免疫治疗药物选用了派安普利单抗,派安普利单抗是一种Fc工程化的免疫球蛋白G1(immunoglobulin G1,IgG1)抗PD-1抗体,具有更高的疗效和更低的免疫相关不良反应发生率,同时,抗血管生成药物安罗替尼的选用,也是考虑到其有较低的半数抑制浓度。本研究共有26例患者出现了不同程度的不良反应,主要集中在骨髓抑制及丙氨酸氨基转移酶水平异常,未发生4~5级不良反应,对于骨髓抑制的患者嘱其口服生血宝合剂,个别患者予以人粒细胞集落刺激因子注射液,肝功能异常的患者主要予以保肝药物治疗,对症处理后未耽误后续治疗,2例患者在5~6个周期时出现了对奥沙利铂的过敏症状,停药后症状消失,奥沙利铂的神经毒性仍是难以避免的不良反应,主要嘱患者注意保暖。安罗替尼引起的不良反应主要为高血压及蛋白尿,嘱患者密切监测血压及降压治疗,警惕脑血管不良反应的发生;有3例患者出现了呕血症状,其中1例患者较为严重,停止了靶向治疗,予禁食、禁水、补液及艾司奥美拉唑对症处理,稳定后进行介入栓塞治疗,追问病史发现此患者为脑梗患者,长期口服阿司匹林。免疫治疗相关不良反应较少,且都是较轻的腹泻、皮疹,甲状腺功能减退的患者也在可控范围内,服用优甲乐之后症状明显好转,有2例患者考虑诱发了免疫心肌损害,但因未进行穿刺活检无法确定,化验上主要体现在肌钙蛋白异常及脑钠肽升高,予以甲强龙40 mg治疗后,指标有所下降,未见免疫输注反应及相关性肺炎,且此联合治疗方案未增加不良反应的发生率。
本研究大部分入组的患者一般状态较差,肿瘤负荷大,初始治疗时无法接受根治性手术,且部分患者无法耐受1个标准剂量的化疗,同时,本研究的起始时间为2022年4月,入组的大多数患者治疗期间都多次感染新冠肺炎病毒,新冠肺炎病毒可以通过引发人体细胞因子风暴导致宿主出现免疫失调现象[19],过量的细胞因子引起一部分初始T淋巴细胞出现混乱,使后者向着低效能、低活性的方向分化[20],在这些因子的影响下,初始T淋巴细胞会分化为低活化T淋巴细胞,最终导致T淋巴细胞过度激活,会使人体的CD4+、CD8+ T淋巴细胞数量显著减少[21],这些因素也会极大地影响免疫治疗效果。同时,过量细胞因子的活化会诱发一系列免疫损伤,增加免疫治疗的风险[22]。本研究中2例患者的病情突然进展,可能与新冠病毒感染有关,因此,本研究在保证安全性的同时,尽可能地追求最佳疗效。
本研究考虑到部分患者的耐受性差,且新冠病毒感染后免疫功能的抑制状态,对化疗药物根据个体情况进行了充分优化,尽可能地保护自身的免疫功能[23],增加免疫治疗效果。同时,在用药的顺序上选择抗血管生成药物首先给药。基础研究证实,肿瘤诱发的血管网中多是未成熟的新生血管,不具备正常血管的组织结构[24],新生血管内皮细胞连接疏松,缺乏周细胞和基底细胞的支撑,导致组织液从异常血管网中渗出到TME中进一步压迫血管,无法运输氧气和营养物质到肿瘤内部继而造成肿瘤内部的低氧坏死[25],同样,大部分杀伤性T淋巴细胞不能够浸润到肿瘤中,其杀伤作用被抑制[26]。而少部分跨越血管内皮细胞进入TME的T淋巴细胞,在长时间低氧条件下,亦无法杀死肿瘤细胞[27]。因此,只有抗血管治疗后有杀伤活性的T淋巴细胞浸润到肿瘤区域,抗PD-1治疗才能获得好的疗效[28]。本研究选用的抗血管生成药物是小剂量的,高剂量的抗血管生成药物会导致过多的血管修剪,从而导致正常化窗口缩短,从而加剧TME的低氧和酸中毒,低氧可促进免疫抑制并促进肿瘤免疫细胞(如单核细胞和粒细胞)浸润,从而影响免疫治疗效果[29],因此本研究选用了8 mg的安罗替尼。
部分入组的患者近期都有明显的体重减轻,主要因为肿瘤消耗及胃肠功能紊乱。考虑到胃癌患者的特殊性,大多数患者会有消化及吸收功能障碍,再加上化疗药物及止吐、止痛药物的使用,导致大部分患者有便秘症状,从而引起腹胀、腹痛及难以进食的恶行循环,因此部分患者需要长期口服乳果糖及外用开塞露来促进排便,从而导致胃肠功能紊乱、菌群失调。之前,也有研究[30]证实了菌群失调对免疫治疗的影响,例如,双歧杆菌、鼠李糖乳杆菌及阿克曼氏菌属等有益微生物,可以在肠道上皮表面与ICI相互作用,并协同促进抗原提呈细胞(特别是树突状细胞)的活化,增强抗肿瘤效应T淋巴细胞反应,抑制调节性T淋巴细胞反应[31]。因此,本研究中嘱患者口服策格,策格是中亚地区以鲜马奶为原料自然发酵生成的一种传统发酵乳制品[32]。之前的研究[33]表明,酸马奶能够显著增加患者肠道菌群的丰度和多样性。同时有研究[34]表明。酸马奶可能会促进大鼠淋巴细胞的增生分化,增强机体的体液免疫和细胞免疫,并辅助机体免疫调节。上述研究结果提示酸马奶对免疫治疗效果可能有一定的促进作用,且酸马奶会很好地促进排便及调理肠道菌群,在保证疗效的同时,能够改善患者的生活质量。此外,酸马奶作为一种食物,更有利于人体的消化及吸收。
随着人文观念的改变,癌症治疗在关注客观缓解的同时更注重患者的主观感受,保持好的主观情绪能让患者更积极地接受治疗,更容易获得好的疗效[35],心理痛苦会对患者应对癌症及其后遗症的能力产生负面影响[36]。在各种癌症诊断的不同阶段都存在高水平的心理疾病,且心理痛苦会影响免疫治疗效果[37]。因此,本研究选用EORTC QLQ-STO22中文版量表来评价患者治疗后的主观感受,该量表包括9个分量表,共22个条目,分别为吞咽困难4个条目、胃部疼痛4个条目、恶逆3个条目、饮食受限4个条目、焦虑3个条目、口干1个条目、味觉1个条目、身体外观1个条目和掉头发1个条目。问卷调查时发现大部分患者主要是因为吞咽困难、疼痛、进食后自觉腹胀或不想进食为主要症状前来就诊,经过3~4个周期治疗后大部分患者自觉疼痛减轻,能正常饮食且体重增加,生活质量明显改善。同时,此治疗方案未给患者带来太多的不良反应及消极情绪,患者主观上更愿意接受治疗,也更有助于疗 效。
免疫治疗的出现彻底改变了肿瘤的治疗格局,不同于化疗、放疗及靶向治疗的疗效时限性,从免疫治疗中获益的人群更易实现长期生存[38]。目前有研究[39]表明,在胃癌中仅有MSI-H、EB病毒阳性的患者更易从免疫治疗中获益,但是这部分患者仅占6%左右,因此,需要寻找一些新的敏感人群。有研究[40]提示,POLE/POLD1突变与肿瘤突变负荷(tumor mutation burden,TMB)相关。本研究中共有2例患者为POLE基因突变,其中1例患者为POLE、MSI-H共突变,疗效方面1例为MPR、1例为pCR,但是由于此治疗方案为联合治疗,化疗、抗血管生成治疗都会对免疫微环境有调控作用,因此POLE基因突变的患者是否属于免疫治疗获益人群还需要从分子生物学角度进一步研究,之前的基础研究已证实POLE和POLD1的基因分别编码DNA聚合酶ε和聚合酶δ的催化和校对亚基[41],负责校对功能的Polε和Polδ如出现致病性突变将会影响基因组的稳定性,可导致突变增加和肿瘤形成[42]。因此,POLE基因突变的患者,在免疫微环境中会产生更多的新抗原而成为免疫治疗的靶点,但本研究中POLE基因突变的比例仅为6.2%,因此,如何将一些浸润性T淋巴细胞丰度较低且无法有效应答的免疫抑制肿瘤转化成T淋巴细胞高浸润、肿瘤免疫原性更高的热肿瘤,是目前急需解决的。本研究是以免疫治疗为核心,化疗、抗血管生成药物为辅助来设计的治疗方案,为塑造一个有利的免疫微环境,在治疗中,对化疗药物的剂量进行了充分优化,以此来保护患者的白细胞、淋巴细胞及中性粒细胞等免疫细胞,从根本上提升患者的免疫能力[43],同时,在抗血管生成药物的剂量选用及给药顺序上也进行了精心的设计,在阻断肿瘤异常增生血管的前提下,尽可能地保证血管正常化从而使杀伤性T淋巴细胞更好地浸润到肿瘤内部,来提升免疫治疗效果[44],并且嘱患者口服酸马奶以及日常查房中对患者情绪的开导,都是为了让患者塑造一个有益的肠道菌群微环境,以此来提升免疫治疗效果。
本研究存在一定的局限性。首先,本研究为临床实践中的一项真实世界研究,实验过程中有很多不确定因素,且是小样本研究,实验数据有一定的偏差;其次,由于时间关系未能对接受手术治疗的患者进行长时间随访,能否真正地转化为生存获益仍需要长期观察;最后,此研究考虑到围手术期单用化疗的效果已经很明确,因此未设计对照组,无法进行严格意义上的统计学分析。
综上所述,在LAGC围手术期治疗中,奥沙利铂+替吉奥+安罗替尼+派安普利单抗的联合治疗方案,在保证安全性的同时,能够提高疗效,有望成为LAGC新的治疗方式。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
刘帅:文章撰写,数据资料收集,数据统计分析;
张凯:文献检索;
张晓青:英文翻译,整理参考文献;
栾巍:选题,审校;
[参考文献]
[1] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[3] ZHANG X, LIANG H, LI Z, et al. Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastro-oesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): an open-label, superiority and noninferiority, phase 3 randomised controlled trial[J]. Lancet Oncol, 2021, 22(8): 1081-1092.
[4] WANG P H, YANG S T, LIU C H. Neoadjuvant therapy[J]. J Chin Med Assoc, 2023, 86(2): 133-134.
[5] CHAMOTO K, AL-HABSI M, HONJO T. Role of PD-1 in immunity and diseases[J]. Curr Top Microbiol Immunol, 2017, 410: 75-97.
[6] JANJIGIAN YY, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[7] SHITARA K, RHA S Y, WYRWICZ L S, et al. Neoadjuvant and adjuvant pembrolizumab plus chemotherapy in locally advanced gastric or gastro-oesophageal cancer (KEYNOTE-585): an interim analysis of the multicentre, double-blind, randomised phase 3 study[J]. Lancet Oncol, 2024, 25(2): 212-224.
[8] JANJIGIAN Y Y, VAN CUTSEM E, MURO K, et al. MATTERHORN: phase Ⅲ study of durvalumab plus FLOT chemotherapy in resectable gastric/gastroesophageal junction cancer[J]. Future Oncol, 2022, 18(20): 2465-2473.
[9] ZHANG Y L, ZHANG B, YANG J P, et al. Perioperative safety and effectiveness of neoadjuvant therapy with fluorouracil, leucovorin, oxaliplatin, and docetaxel plus apatinib in locally advanced gastric cancer[J]. Cancer Manag Res, 2021, 13: 2279-2286.
[10] CICIOLA P, CASCETTA P, BIANCO C, et al. Combining immune checkpoint inhibitors with anti-angiogenic agents[J]. J Clin Med, 2020, 9(3): 675.
[11] PENG Z, WEI J, WANG F, et al. Camrelizumab combined with chemotherapy followed by camrelizumab plus apatinib as firstline therapy for advanced gastric or gastroesophageal junction adenocarcinoma[J]. Clin Cancer Res, 2021, 27(11): 3069-3078.
[12] American Joint Committee on Cancer. AJCC cancer staging manual[M]. 8th edition. Chicago: Springer, 2018.
[13] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[14] US Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE) version 5.0[EB/OL]. (2017-11-27)[2024-01-30]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/ctcae_v5_quick_reference_5x7.pdf.
[15] 孟 琼, 罗家洪, 万崇华, 等. 胃癌患者生命质量测定量表EORTC QLQ-STO22中文版的制定和评价[J]. 昆明医科大学学报, 2012, 33(10): 34-38.
MENG Q, LUO J H, WAN C H, et al. Development and evaluation on Chinese version of measurement instrument of quality of life for patients with stomach cancer: EORTC QLQSTO22[J]. J Kunming Med Univ, 2012, 33(10): 34-38.
[16] KANG Y K, YOOK J H, PARK Y K, et al. PRODIGY: a phase Ⅲ study of neoadjuvant docetaxel, oxaliplatin, and S-1 plus surgery and adjuvant S-1 versus surgery and adjuvant S-1 for resectable advanced gastric cancer[J]. J Clin Oncol, 2021, 39(26): 2903-2913.
[17] JIANG H P, YU X F, LI N, et al. Efficacy and safety of neoadjuvant sintilimab, oxaliplatin and capecitabine in patients with locally advanced, resectable gastric or gastroesophageal junction adenocarcinoma: early results of a phase 2 study[J]. J Immunother Cancer, 2022, 10(3): e003635.
[18] GUO H H, DING P A, SUN C Y, et al. Efficacy and safety of sintilimab plus XELOX as a neoadjuvant regimen in patients with locally advanced gastric cancer: a single-arm, open-label, phase Ⅱ trial[J]. Front Oncol, 2022, 12: 927781.
[19] 姜慧欣, 黄学涵, 林 果, 等. 细胞因子风暴在2019新型冠状病毒肺炎肺损伤中的作用[J]. 临床与病理杂志, 2022, 42(2): 462-471.
JIANG H X, HUANG X H, LIN G, et al. Role of cytokine storm in lung injury of coronavirus disease 2019[J]. J Clin Pathol Res, 2022, 42(2): 462-471.
[20] 阎 岩, 吕春燕, 王 旭, 等. 基于本土奥密克戎变异株感染轻重症患者的临床特征变化[J]. 中华危重病急救医学, 2023, 35(1): 32-36.
YAN Y, (LÜ/LV/LU/LYU) C Y, WANG X, et al. Analyze the clinical characteristics of mild and severe SARS-CoV-2 infected patients based on the local Omicron variant epidemic[J]. Chin Crit Care Med, 2023, 35(1): 32-36.
[21]CHEN Z Y, JOHN WHERRY E. T cell responses in patients with COVID-19[J]. Nat Rev Immunol, 2020, 20(9): 529-536.
[22]BIAN H, CHEN L, ZHENG Z H, et al. Meplazumab in hospitalized adults with severe COVID-19 (DEFLECT): a multicenter, seamless phase 2/3, randomized, third-party double-blind clinical trial[J]. Signal Transduct Target Ther, 2023, 8(1): 46.
[23]WU J J, WAXMAN D J. Immunogenic chemotherapy: dose and schedule dependence and combination with immunotherapy[J]. Cancer Lett, 2018, 419: 210-221.
[24]DUDLEY A C, GRIFFIOEN A W. Pathological angiogenesis: mechanisms and therapeutic strategies[J]. Angiogenesis, 2023, 26(3): 313-347.
[25]ALI KHAWAR I, KIM J H, KUH H J. Improving drug delivery to solid tumors: priming the tumor microenvironment[J]. J Control Release, 2015, 201: 78-89.
[26]PARMAR D, APTE M. Angiopoietin inhibitors: a review on targeting tumor angiogenesis[J]. Eur J Pharmacol, 2021, 899: 174021.
[27]ALLEN E, JABOUILLE A, RIVERA L B, et al. Combined antiangiogenic and anti-PD-L1 therapy stimulates tumor immunity through HEV formation[J]. Sci Transl Med, 2017, 9(385): eaak9679.
[28]SHIGETA K, DATTA M, HATO T, et al. Dual programmed death receptor-1 and vascular endothelial growth factor receptor-2 blockade promotes vascular normalization and enhances antitumor immune responses in hepatocellular carcinoma[J]. Hepatology, 2020, 71(4): 1247-1261.
[29]PÀEZ-RIBES M, ALLEN E, HUDOCK J, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis[J]. Cancer Cell, 2009, 15(3): 220-231.
[30]ROUTY B, LE CHATELIER E, DEROSA L, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359(6371): 91-97.
[31]SILLO T O, BEGGS A D, MIDDLETON G, et al. The gut microbiome, microsatellite status and the response to immunotherapy in colorectal cancer[J]. Int J Mol Sci, 2023, 24(6): 5767.
[32]杜晓敏. 内蒙古地区传统酸马奶中营养组分分析、乳酸菌分离鉴定及污染微生物检测[D]. 呼和浩特: 内蒙古农业大学, 2017.
DU X M. Analysis of nutrient components, isolation and identification of lactic acid bacteria and detection of contaminated microorganisms in traditional sour horse milk in Inner Mongolia[D]. Hohhot: Inner Mongolia Agric Univ, 2017.
[33]刘亚华. 酸马奶对高脂血症患者降血脂效果和肠道菌群的影响[D]. 呼和浩特: 内蒙古农业大学, 2019.
LIU Y H. Effect of sour horse milk on lowering blood lipids and intestinal flora in patients with hyperlipidemia[D]. Hohhot: Inner Mongolia Agric Univ, 2019.
[34]LI Q Y, ZHANG C J, XILIN T Y, et al. Effects of koumiss on intestinal immune modulation in immunosuppressed rats[J]. Front Nutr, 2022, 9: 765499.
[35]KAPTEIN A A, MORITA S, SAKAMOTO J. Quality of life in gastric cancer[J]. World J Gastroenterol, 2005, 11(21): 3189-3196.
[36]RIBA M B, DONOVAN K A, ANDERSEN B, et al. Distress management, version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(10): 1229-1249.
[37]MOSHER C E, DUHAMEL K N. An examination of distress, sleep, and fatigue in metastatic breast cancer patients[J]. Psycho-oncology, 2012, 21(1): 100-107.
[38]KHAN K A, KERBEL R S. Improving immunotherapy outcomes with anti-angiogenic treatments and vice versa[J]. Nat Rev Clin Oncol, 2018, 15: 310-324.
[39]KAWAZOE A, SHITARA K, KUBOKI Y, et al. Clinicopathological features of 22C3 PD-L1 expression with mismatch repair, Epstein-Barr virus status, and cancer genome alterations in metastatic gastric cancer[J]. Gastric Cancer, 2019, 22(1): 69-76.
[40]VOUTSADAKIS I A. High tumor mutation burden and other immunotherapy response predictors in breast cancers: associations and therapeutic opportunities[J]. Target Oncol, 2020, 15(1): 127-138.
[41]AGBOR A A, GÖKSENIN A Y, LECOMPTE K G, et al. Human Polε-dependent replication errors and the influence of mismatch repair on their correction[J]. DNA Repair, 2013, 12(11): 954-963.
[42]LANGE S S, TAKATA K I, WOOD R D. DNA polymerases and cancer[J]. Nat Rev Cancer, 2011, 11(2): 96-110.
[43]TAKEI S, KAWAZOE A, SHITARA K. The new era of immunotherapy in gastric cancer[J]. Cancers, 2022, 14(4): 1054.
[44]FUKUMURA D, KLOEPPER J, AMOOZGAR Z, et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges[J]. Nat Rev Clin Oncol, 2018, 15(5): 325-340.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#免疫治疗# #局部进展期胃癌# #围手术期治疗#
92