European Radiology:深度学习在胸腺上皮肿瘤组织学亚型鉴别诊断中的应用
2024-03-03 shaosai MedSci原创 发表于上海
增强计算机断层扫描(CECT)可以提供纵隔软组织病变的详细形态学信息,是一种有无创诊断和评估TET的重要临床工具。
胸腺上皮瘤(TETs)是一组起源于前纵隔的胸腔肿瘤。根据2015年WHO的规定,根据上皮细胞的病理形态及其与淋巴细胞的比例,TETs被划分为胸腺瘤(A、AB、B1、B2和B3亚型)或胸腺癌(C亚型)。TET的临床治疗和预后与WHO分类有关;与更具侵略性的高危亚型(B2、B3和C)相比,低危亚型(A、AB和B1)通常采用手术切除治疗,复发率较低、整体预后较好。此外,目前的证据表明,手术前的新辅助化疗或化放疗可以改善高危TET的可切除性和生存率。因此,对TET患者进行术前风险评估对决策和预后意义重大。
增强计算机断层扫描(CECT)可以提供纵隔软组织病变的详细形态学信息,是一种有无创诊断和评估TET的重要临床工具。CECT的发现,如肿瘤的位置、大小、密度和与邻近结构的关系是区分TETs侵袭性等级的重要影像学特征。然而,读片人经验的读片人之间的差异是不可避免的,必须加以限制以获得对TETs肿瘤内异质性的更准确评估。
随着诊断性能的提高,CT纹理定量分析已被用于前纵隔病变的评估。放射组学可基于常规成像进行定量特征的提取,已被应用于肿瘤的病理和遗传特征分析。CT图像的放射组学在评估前纵隔病变和TET肿瘤分级方面表现出优异的性能。传统的放射组学方法使用人工预定义的特征来建立模型。然而,人工预定义的特征是通过固定的数学公式计算出来的,对目标任务没有针对性。同时,人工预定义特征的计算需要准确的分割结果,而特征值可能受到分割结果的影响。
最近,基于人工神经网络的深度学习(DL)算法的实用价值在医学影像分析中得到认可。DL模型中的卷积神经网络是一个数据驱动的模型,可以直接从输入的医学图像中自动学习任务相关的特征,以提高模型的准确性。此外,这种方法消除了对输入图像的准确病变边界的要求。

近日,发表在European Radiology杂志上的一篇研究探讨了基于CECT图像的DL技术识别TETWHO分类的的能力及价值,同时生成并评估了一个可用于预测TETs风险状态的深度学习放射组学列线图(DLRN)。
本项研究于2008年10月至2020年5月期间纳入了来自三个医疗中心的257名连续的手术和病理证实的TETs患者。研究使用基于变压器的卷积神经网络从所有病变中提取深度学习特征,并使用选择器算子回归和最小绝对收缩创建深度学习特征(DLS)。通过接收器操作特征曲线的曲线下面积(AUC)评估了结合了临床特征、主观CT结果和DLS的DLRN的预测能力。
为了构建DLS,研究从116个低风险TET(A、AB和B1亚型)和141个高风险TET(B2、B3和C亚型)中选择了25个系数不为零的深度学习特征。结合主观的CT特征,如浸润和DLS,在区分TETs风险状态方面表现得最好。训练、内部验证、外部验证1和2队列中的AUC分别为0.959(95%置信区间[CI]:0.924-0.993)、0.868(95%CI:0.765-0.970)、0.846(95%CI:0.750-0.942)和0.846(95%CI:0.735-0.957)。DeLong测试和曲线决策分析显示,DLRN是最具预测性和临床作用的模型。
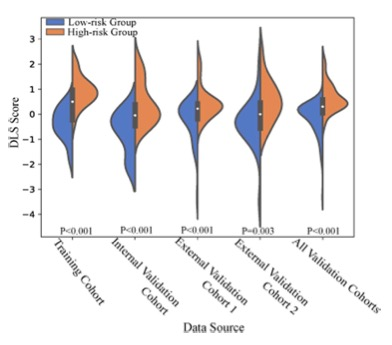
图 训练队列、内部验证队列、两个外部验证队列和所有验证队列中,低风险组和高风险组的深度学习特征的得分分布
本项研究表明,由CECT衍生的DLS和主观CT表现组成的DLRN在预测TETs患者的风险状态方面表现出很高的诊断性能。
原文出处:
Xiangmeng Chen,Bao Feng,Kuncai Xu,et al.Development and validation of a deep learning radiomics nomogram for preoperatively differentiating thymic epithelial tumor histologic subtypes.DOI:10.1007/s00330-023-09690-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#深度学习# #胸腺上皮肿瘤#
47
学习了,谢谢分享
53
认真学习了
39