一、病史简介
男性,49岁,江苏人,2018-11-06入中山医院感染病科
主诉:咳嗽咳痰1年,胸痛7月余
现病史:
2017年11月患者无明显诱因下咳嗽咳痰,痰黄不易咳出,无发热、盗汗、胸痛、气喘、咯血等不适,患者未予重视,未行诊治。
2018年3月自觉右侧前上胸部疼痛,范围约手掌大小,呈发作性胀痛,吸气相加重,每次持续数分钟,休息后自行好转,每周发作1-2次,无其他不适,仍未重视,也未做心电图。后胸痛呈渐进性加重,持续时间延长,最长持续半小时。
2018-08-06就诊于当地医院,查胸部CT:右肺上叶支气管狭窄不通,右肺上叶阻塞性炎症及不张,纵隔淋巴结肿大,予抗感染治疗3天(具体药物不详)后胸痛无好转;08-10复诊查:CRP 10.63mg/L,ESR 120mm/H,肺炎支原体抗体IgM(+);复查胸部CT:右肺上叶多发片状实变影,病灶较前无明显吸收。
2018-08-14当地行超声引导下肺穿刺活检,病理报告:肺间质纤维组织增生并水肿变性,少量淋巴细胞浸润,肺泡腔内组织细胞反应,肺泡上皮增生,表面间皮细胞增生;予左氧氟沙星、阿奇霉素等抗感染治疗,09-21复查胸部CT:右肺上叶多发浸润实变影,部分较前吸收,部分较前新出现,右肺上叶后段支气管扩张,纵隔及右肺门多发淋巴结显示。
2018-10-08随访:CRP 0.64mg/L,ESR 42mm/H,行支气管镜检查:右肺上叶开口管腔狭窄,粘膜充血水肿,余管腔通畅;活检病理示:支气管粘膜固有膜内大量淋巴细胞、浆细胞及嗜酸性粒细胞浸润,符合炎症表现;肺功能提示通气功能轻度限制性减退伴气道阻塞,弥散功能受损,气道阻力增高;后继续予以左氧氟沙星抗感染治疗。治疗后仍有间断咳黄脓痰,胸痛较前稍有缓解,但仍有发作,并出现右上肢抬举时胸部牵拉痛,为明确诊断和进一步治疗收入我科。
病程中患者体温正常,精神尚可,食欲睡眠可,二便无异常,体重无明显波动。
既往史:2015年曾有肺炎史,予抗感染治疗1月后好转,后复查胸部CT提示支气管扩张,未予治疗;吸烟史3年,每天10-20支,已戒烟5年;工作环境中有六氟化硫、变压器油接触史。否认生食史,否认霉变环境、禽类和野生动物接触史。
二、入院检查(2018-11-06)
【体格检查】
-
T 37.5℃, P 96bpm, R 20次/分, BP130/78mmHg;
-
双肺呼吸音粗,未及明显干湿啰音。心尖部未及杂音。腹平软,无压痛反跳痛。双下肢无明显水肿。
【实验室检查】
-
血常规:Hb 115g/L;WBC 4.30X10^9/L;NE 39.9%;Eos 9.0%;
-
炎症标志物:hs-CRP 32.9mg/L;ESR 85mm/H;PCT 0.04ng/mL;
-
尿常规及粪常规+OB:均阴性;
-
肝肾功能、出凝血:未见明显异常;
-
肿瘤标志物:CEA 6.5ng/mL;CYFRA21-1 3.5ng/mL;;
-
心肌酶谱:未见明显异常;
-
自身抗体:ANA (-),ANCA (-),抗GBM抗体(-);抗CCP 34.8U/mL;
-
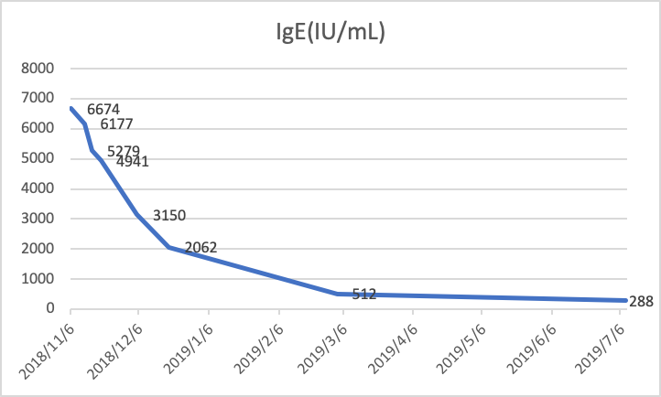
免疫球蛋白全套:IgE 6177 IU/mL,C3、C4均正常;
-
细胞免疫检查:正常;
-
痰细菌、真菌培养:阴性;血培养:阴性;
-
肺炎支原体抗体(-);呼吸道病原体九联检:均(-);
-
血隐球菌荚膜抗原:(-);G试验:1-3-β-D葡聚糖 :阴性;
-
T-SPOT:A/B:0/0;
-
血气分析(不吸氧):PaO2 79mmHg;
【辅助检查】
-
11-06 心电图:正常心电图;
-
11-06 超声心动图:静息状态下未见明显异常;
-
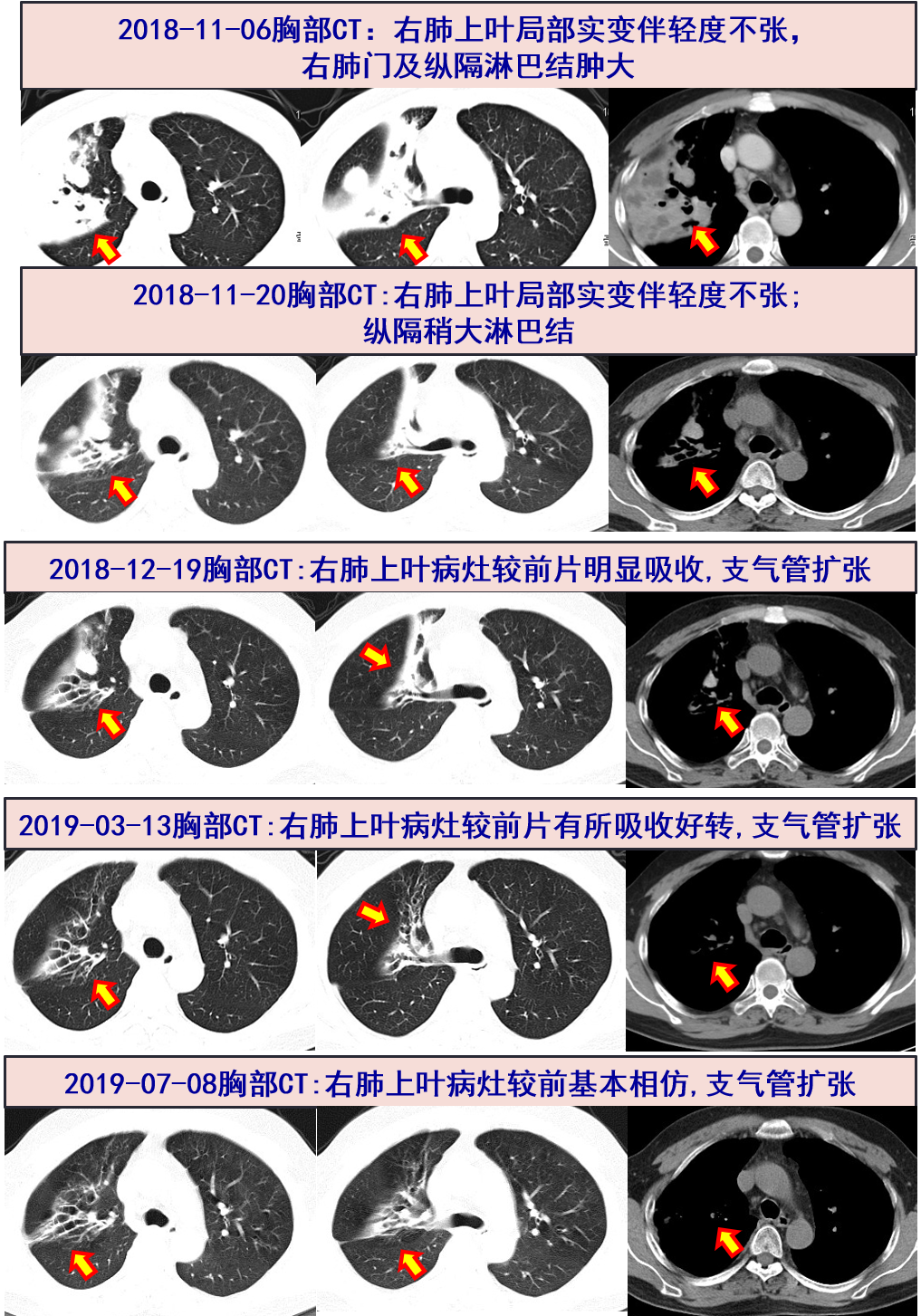
11-06 胸部CT:右肺上叶局部实变伴轻度不张,右肺门及纵隔淋巴结肿大,两肺局部支气管扩张伴周围炎症;
三、临床分析
病史特点:患者中年男性,既往有肺炎后支气管扩张病史,主要表现为反复黄脓痰及胸痛;炎症标志物升高,胸部CT提示右肺上叶局部实变伴轻度不张,数月后随访示右肺上叶病灶变化不明显,肺门及纵隔淋巴结稍肿大;外院予以左氧氟沙星、阿奇霉素等药物抗感染治疗效果不佳。本次入院后查血嗜酸性粒细胞轻度升高,炎症标志物及IgE明显升高,血培养及痰细菌、真菌培养均阴性;抗CCP抗体阳性,肿瘤标志物见CEA、CYFRA21-1轻度升高,T-SPOT阴性。需考虑以下疾病可能:
-
肺癌伴阻塞性肺炎:患者中年男性,有吸烟史,胸部CT显示右上肺实变伴部分不张,肺门及纵隔淋巴结肿大,支气管镜检查也发现右肺上叶支气管开口管腔狭窄和粘膜充血水肿,结合肿瘤标志物见CEA、CYFRA21-1轻度升高,需要考虑中央型肺癌伴阻塞性肺炎,但支气管镜检查及肺穿刺活检均未见明确肿瘤证据,必要时可再次支气管镜活检以明确。
-
慢性肺脓肿/坏死性肺炎:常由于口腔内细菌吸入肺部导致的化脓性炎症,多为混合感染,肺组织坏死后液化常可形成空洞,若急性肺脓肿治疗不佳,可逐渐转变为慢性肺脓肿即坏死性肺炎。该患者慢性病程,反复有黄脓痰咳出,多次查炎症标志物明显升高,胸部CT表现为右肺上叶大片实变影,纵膈床见部分区有低密度灶,使用左氧氟沙星治疗部分有效;但该患者非急性起病,病程较长,发热等毒性症状不明显,胸部CT未见明显坏死空洞形成,单纯细菌性感染的可能性较小。
-
肺曲霉病:患者有支气管扩张病史,胸部CT提示病灶位于右肺上叶通气良好部位,呈阻塞性肺炎表现,有反复黄脓痰咳出,常规抗感染治疗病灶无明显吸收,血嗜酸性粒细胞及免疫球蛋白E明显升高,需考虑混合性肺曲霉病(变应性支气管肺曲霉病合并慢性坏死性肺曲霉病)可能,可进一步完善曲霉三联检,必要时可再次行支气管镜检查或CT引导下肺穿刺,灌洗液送检NGS检查以明确。
-
非感染性疾病:患者工作环境中有六氟化硫、变压器油接触史,需考虑是否存在长期吸入导致脂质体肺炎、机化性肺炎等可能;此外,患者入院后抗CCP抗体阳性,需考虑患者是否合并存在结缔组织疾病进而累及肺部可能;但是,患者病程中无明显发热,胸部CT以大片实变以及肺门及纵隔淋巴结肿大为表现,既往外院肺穿刺及支气管镜检查活检结果均未见明确相关依据,且病灶仅累及右肺上叶,故可能性较小。
四、进一步检查、诊治过程和治疗反应
-
2018-11-08 支气管镜检查+右肺上叶前段活检(TBLB),镜下见气管及左右支气管管腔通畅,粘膜光滑,未见新生物;
-
2018-11-08 考虑合并细菌感染不除外,予以美罗培南1g q8h抗感染治疗;
-
2018-11-09 初步病理回报:肺泡组织内见大量炎性细胞及灶性坏死;
-
2018-11-09 曲霉三联检:GM试验<=0.25ug/L;烟曲霉IgG抗体≥500AU/mL;烟曲霉IgM抗体<=31.25AU/mL;
-
2018-11-12 特异性IgE检查结果:烟曲霉特异性IgE 19KIU/L(4级,非常高);
-
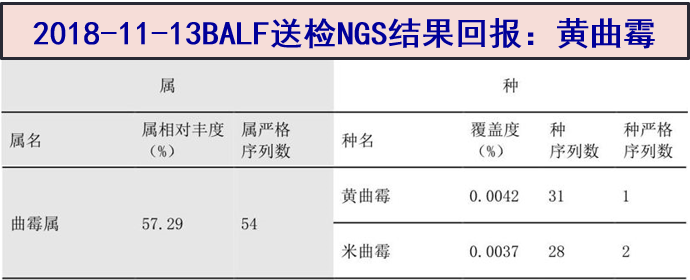
2018-11-13 支气管灌洗液送检mNGS结果:检出少量黄曲霉核酸序列。
-
2018-11-14 考虑变应性支气管肺曲霉菌病(ABPA)合并慢性肺曲霉菌病可能,予以甲强龙40mg qd治疗,联合伏立康唑200mg q12h抗曲霉治疗;
-
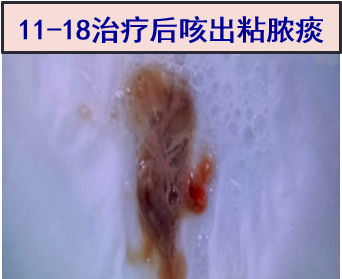
2018-11-18 咳出大量暗红色粘脓性痰(如图所示);
-
2018-11-19 随访IgE 4941 IU/mL,hsCRP 0.4mg/L,ESR 22mm/H;较前明显下降;
-
2018-11-20 复查胸部CT:右肺上叶炎症较前明显吸收。
-
2018-11-21 右上肺组织(2018-11-08气管镜采样)病理最终结果回报:肺泡组织内见大量炎性细胞及灶性坏死;特殊染色未查见真菌菌丝及孢子,抗酸染色阴性,结核PCR(-)。
-
2018-11-21 予停用美罗培南,改口服伏立康唑0.2g q12h+美卓乐28mg qd出院,嘱门诊定期随访。

出院后随访
-
2018-12-19 随访EOS:0.02*10^9,CRP:2.4mg/L,ESR:29mm/H,IgE:2062 IU/mL;随访胸部CT见右肺上叶病灶较前明显吸收;因肝功能异常:ALT/AST:116/28 U/L,停用伏立康唑;激素逐渐规律减量。
-
2018-03-13 随访EOS:0.02*10^9,CRP:0.3mg/L,ESR:22mm/H,IgE:512 IU/mL,较前明显下降;胸部CT:右上肺病灶较前片(2018-12-19)有所吸收好转。
-
2019-07-08 随访EOS:0.01*10^9,CRP:1.2mg/L,ESR:32mm/H,IgE:288 IU/mL;随访胸部CT:右肺上叶支扩伴感染,较3-13片基本相仿,左肺上叶舌段及右肺中下叶局部轻度支扩。予以停用美卓乐。

胸部CT
五、最后诊断与诊断依据
最后诊断:
-
变应性支气管肺曲霉病(ABPA)
诊断依据:
患者中年男性,主要表现为反复黄脓痰伴胸痛,炎症标志物升高,胸部CT提示右肺上叶局部实变伴轻度不张,抗感染治疗效果不佳;血嗜酸性粒细胞升高,IgE则明显升高,曲霉三联检提示烟曲霉IgG明显升高,特异性IgE检查示烟曲霉特异性IgE 4级,灌洗液NGS检查提示检出曲霉序列;糖皮质激素+短期伏立康唑(因为肝损停用)治疗后,肺内病灶明显吸收,而呈现较多的扩张支气管和纤维条索病灶,血IgE也基本恢复正常,故诊断成立。
六、经验与体会
-
曲霉广泛存在于自然界,最常见的致病菌为烟曲霉及黑曲霉,其它如黄曲霉、土曲霉等也可导致人类感染。肺曲霉病主要包括慢性肺曲霉病(chronic pulmonary aspergillosis, CPA)、变应性支气管肺曲霉菌病(allergic bronchopulmonary aspergillosis,ABPA)以及侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)。慢性肺曲霉病又可分为曲霉结节、单发曲霉球、慢性空洞性肺曲霉病、慢性纤维化性肺曲霉病,以及慢性坏死性肺曲霉病。肺曲霉病与患者的免疫状态以及曲霉的毒力有关。不同类型多单独存在,但同一患者也可同时存在两种及以上类型。
-
ABPA的临床特征包括反复发作的喘息、慢性咳嗽咳痰等,咳出带分支的黏液痰栓通常具有诊断价值,少数患者可以出现咯血;肺部的哮鸣音通常不明显,部分患者也可表现为无症状的阻塞性肺炎表现。实验室检查异常通常包括血嗜酸性粒细胞升高、血清总IgE升高;曲霉特异性IgE和IgG抗体的免疫测定(曲霉三联检)具有较好的判断价值。对于咳出的痰液涂片常可见较多嗜酸性粒细胞,痰培养可发现曲霉生长。中央型支气管扩张是ABPA患者的常见特征,主要累及肺上叶及中叶,常可见痰液嵌塞导致的“牙膏样阴影”或支气管壁增厚导致的“指套征”,也可继发阻塞性肺炎以及肺不张。本例患者肺部影像学表现不典型,考虑患者既往黄脓痰明显,有支气管扩张基础,可能存在合并的细菌感染,因此在入院后我们使用了美罗培南进行治疗,后续结合患者烟曲霉特异性IgE明显升高,使用糖皮质激素治疗后咳出较多粘稠痰液,复查胸部CT提示病灶明显吸收,故支持ABPA的诊断。
-
ABPA患者的治疗旨在控制急性炎症的发作和减少进行性肺损伤。全身性糖皮质激素和抗曲霉药物的作用,因疾病活动度不同而异。抗曲霉治疗可能有助于减少发作次数,降低糖皮质激素的剂量。根据2016年IDSA的曲霉病治疗指南推荐,急性或复发性ABPA的患者可以联合应用糖皮质激素和伊曲康唑。由于在部分患者中,伏立康唑的耐受性更好且吸收良好,故也可选择伏立康唑来替代伊曲康唑。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言