【论著】| 整体纵向应变评估乳腺癌放疗所致心脏毒性的价值:系统综述和meta分析
2023-08-30 中国癌症杂志 中国癌症杂志 发表于上海
本文旨在对左心室整体纵向应变(global longitudinal strain,GLS)评估早期放射性心脏损伤的价值进行系统综述和meta分析。
[摘要]
背景与目的:乳腺癌已超过肺癌成为全球最常见的恶性肿瘤。早期乳腺癌患者经过综合治疗可以获得较长的生存期,但放疗引起的心脏毒性可能会影响远期预后。因此,早期监测放疗相关心脏损伤对于改善乳腺癌患者生存期具有重要意义。斑点追踪超声心电图(speckle-tracking echocardiography,STE)是一项研究心肌变形的新技术,其中整体纵向应变(global longitudinal strain,GLS)是评估放疗所致早期心脏损伤的良好参数。本文旨在探讨GLS评估乳腺癌放疗所致心脏毒性的价值。
方法:计算机检索PubMed、EMBASE、Web of Science、Cochrane Library、万方及中国知网即中国知识基础设施工程(China National Knowledge Infrastructure,CNKI)数据库,检索时间为2010年1月—2022年3月,按照预先设定的纳入排除标准,筛选利用GLS、整体纵向应变率(global longitudinal strain rate,GLSr)及左心室射血分数(left ventricular ejection fraction,LVEF)评估乳腺癌放疗过程中及放疗后心肌功能变化。由2名研究者独立进行文献筛选、资料提取。采用Review Manager 5.4分析软件进行数据分析。
结果:最终纳入9项研究,共涉及543例患者,meta分析结果显示,左侧乳腺癌患者LEVF在放疗后即刻轻微下降,WMD为-0.98,在放疗后6个月有所上升,WMD为-0.83,但仍低于基线水平。右侧乳腺癌放疗后LVEF几乎没有变化。左侧乳腺癌患者放疗后即刻、放疗后6周、6个月、12个月GLS显著下降,WMD分别为1.57、1.84、1.04、1.69,差异有统计学意义,各研究之间无显著异质性。而右侧乳腺癌放疗后GLS无显著变化。不同侧乳腺癌GLSr的变化相差不大。结论:GLS可能是左侧乳腺癌患者放射治疗所致心脏损伤的较好预测指标。
[关键词] 乳腺癌;斑点追踪超声心动图;放射治疗;心脏毒性
乳腺癌发病率居所有女性恶性肿瘤的首位[1]。早期乳腺癌保乳术后辅助放疗可以减低局部复发及远处转移风险,提高早期乳腺癌患者总体生存率,达到与乳腺癌改良根治术后相同的疗效。然而,有研究显示,与未接受放疗的乳腺癌患者相比,放疗后乳腺癌患者心血管相关死亡增加30%[2],左侧乳腺癌放疗相关心脏事件发生率更高[3]。在临床上,常规超声心动图测定左心室射血分数(left ventricular ejection fraction,LVEF)被广泛用于识别相关心脏损伤。然而,LVEF的降低主要反映明显的左心室功能障碍。值得注意的是,在LVEF未见变化的情况下,心肌功能可以发生很大的变化[4]。放射性心脏损伤(radiation-induced heart disease,RIHD)在早期通常不伴有LVEF的显著下降[5],且没有临床症状,这提示需要更敏感 的参数来早期发现心脏损害。
目前,越来越多的证据支持斑点追踪超声心动图(speckle-tracking echocardiography,STE)是早期发现左心室功能改变的一种有前景的工具[6-7]。STE可以量化心肌的变形特性,从而通过心肌的变形评估区域心肌功能[8]。多 项研究表明,在常规超声心动图参数发生任何可测量的变化之前,STE可以检测到局部心肌功能的降低[9-11]。本文旨在对左心室整体纵向应变(global longitudinal strain,GLS)评估早期放射性心脏损伤的价值进行系统综述和meta分析。
1 资料和方法
1.1 检索策略
2名研究者通过PubMed、EMBASE、Web of Science、Cochrane Library、万方及中国知网即中国知识基础设施工程(China National Knowledge Infrastructure,CNKI)数据库进行文献检索。检 索时间为2010年1月—2022年3月,语言限制为中文或英文。英文数据库检索词主要有“breast cancer”、“radiotherapy”、“cardiotoxicity”、“echocardiography”等,中文数据库检索词主要有“乳腺癌”、“放射治疗”、“心脏毒性”和“超声心动图”等。
1.2 纳入及排除标准
纳入标准:① 研究对象经组织病理学诊断为乳腺癌,接受了辅助放疗(乳腺或胸壁,保乳手术者选择瘤床加量),接受或不接受辅助化疗;② 研究类型为前瞻性或回顾性研究,放疗前及随访过程中行斑点超声心动图检查,并有LVEF、GLS、整体纵向应变率(global longitudinal strain rate,GLSr)记录。
排除标准:① 左右侧乳腺癌数据未单独记录;② 重复发表的文献;③ 文献类型为综述、信件、病例报道、会议摘要等;④ 原始数据不完整,不包含LVEF、GLS等相关数据。
1.3 数据提取
2 名研究者独立对符合纳入标准的研究进行数据提取,如遇分歧则通过讨论或由第3人裁定。提取的数据包含作者姓名、发表年份、国家、研究类型、患者特征(年龄及性别)、是否接受化疗及靶向治疗等。
1.4 统计学处理
采用Review Manager 5.4分析软件进行数据分析。LVEF、GLS及GLSr为连续性数据,采用加权均数差(weighted mean difference,WMD)作为效应值。Q检验被用于分析各研究间是否存在异质性,I2则被用于评估各研究间异质性的大小,若Q检验结果为P<0.05或I2>50%,则提示各研究间存在明显的异质性,将使用随机效应模型,否则使用固定效应模型。所有统计学检验水准取α = 0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 检索结果
根据检索策略,从PubMed、EMBASE、Web of Science、Cochrane Library、万方及中国知网数据库中共检索相关文献186篇。剔除重复文献后,对剩余的160篇文献进行初步筛选。仔细阅读上述文献摘要和标题后,得到需要获取全文的文献共26篇。经过阅读全文,最终纳入9篇文献[4-5, 9-15]进行meta分析。Meta分析的文献筛选流程图1,纳入文献基本信息见表1。
2.2 Meta分析结果
2.2.1 左侧乳腺癌放疗前后LVEF变化
放疗前平均LVEF为60.9%~73.3%,放疗后为58.7%~70.5% 。合并分析显示,放疗后LVEF低于基线,WMD为-0.98 ( 95% CI:-1.88~-0.08,P=0.03),各研究之间无显著异质性(I2=13%,P=0.33,图2A)。在放疗结束后6个月,LVEF较放疗后略有升高,但仍未恢复基线水平,WMD为-0.83(95% CI:-3.09~1.43,P=0.47),各研究之间无显著异质性(I2=0%,P=0.84,图2B)。
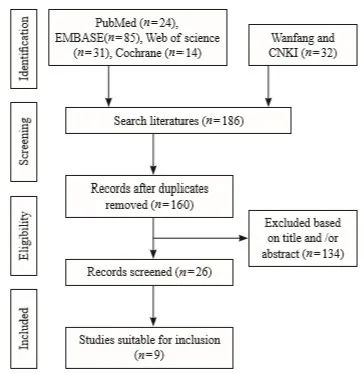
图1 Meta分析的文献筛选流程图
Fig. 1 Flow chart for literature search processing in the meta- analysis
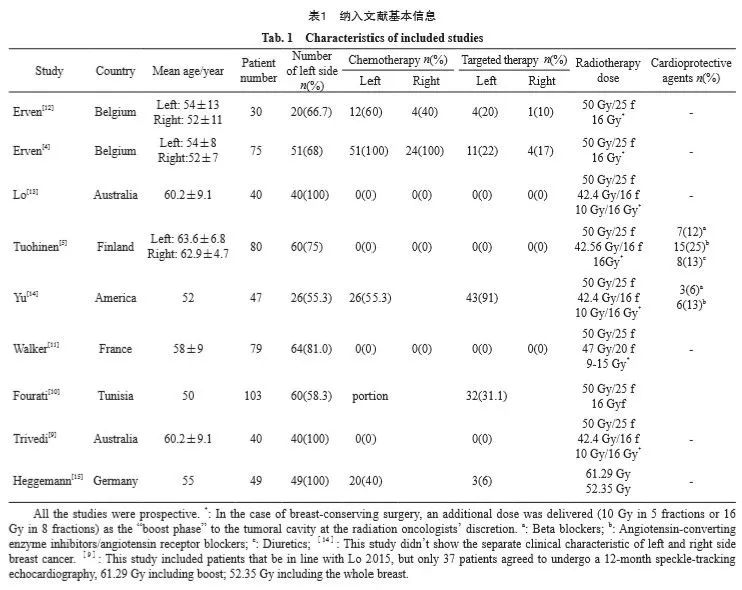
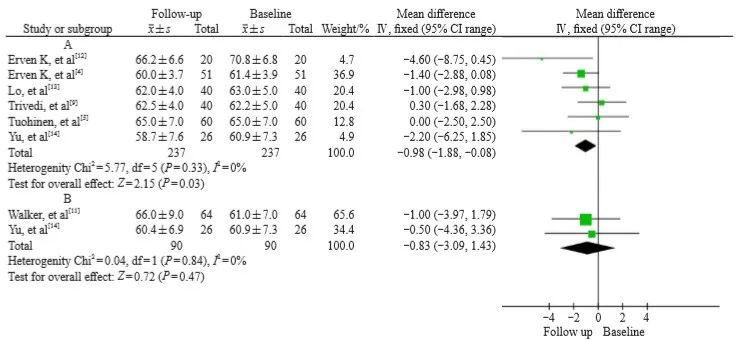
图2 左侧乳腺癌放疗前后LVEF变化的森林图
Fig. 2 Forest plot of LVEF changes before and after radiotherapy for left breast cancer
2.2.2 右侧乳腺癌放疗前后LVEF变化
右侧乳腺癌放疗后LVEF几乎没有出现变化,WMD为-0.17(95% CI:-2.07 ~ 1.72,P=0.86),各研究之间差异无异质性(I2=0%,P=0.54,图3)。
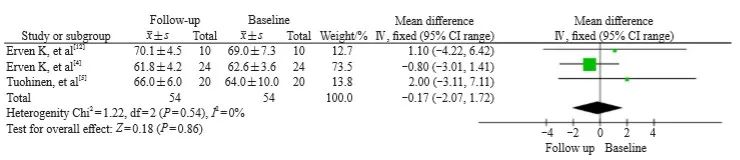
图3 右侧乳腺癌放疗前后LVEF变化的森林图
Fig. 3 Forest plot of LVEF changes before and after radiotherapy for left breast cancer
2.2.3 左侧乳腺癌放疗前后GLS变化
左侧乳腺癌放疗后,GLS显著下降, 平均GLS值在放疗前为-21.4~-16.0,放疗后为-18.7~-17.2。WMD为1.57(95% CI:1.08~2.07,P<0.000 01),各研究之间存在异质性(I2=14%,P=0.32,图4A)。在放疗后6 周、6个月和12个月,GLS均低于基线值水平,WMD分别为1.84(95% CI:1.13 ~ 2.55,P< 0.000 01,图4B)、1.04(95% CI:0.35~1.73,P<0.003,图4C)和1.69(95% CI:0.88~2.50,P<0.000 1,图4D),各研究之间无异质性。

图4 左侧乳腺癌放疗前后GLS变化的森林图
Fig. 4 Forest plot of GLS changes before and after radiotherapy for left breast cancer
2.2.4 右侧乳腺癌放疗前后GLS变化
右侧乳腺癌放疗后,GLS轻微下降,WMD为0.18(95% CI:-0.55~0.91,P=0.62),各研究之间无异质性(I2=0%,z=0.50,95% CI:P=0.58,图5)。
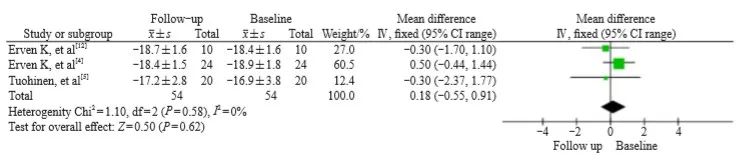
图5 右侧乳腺癌放疗前后GLS变化的森林图
Fig. 5 Forest plot of GLS changes before and after radiotherapy for right breast cancer
2.2.5 左侧乳腺癌放疗前后GLSr变化
左侧乳腺癌放疗后,GLSr轻微下降,WMD为0.14(95% CI:0.09~0.19,P<0.000 01,图6A),在放疗后6周,WMD为0.12(95% CI:0.07~0.17,P<0.000 1,图6B)。各研究之间无异质性。
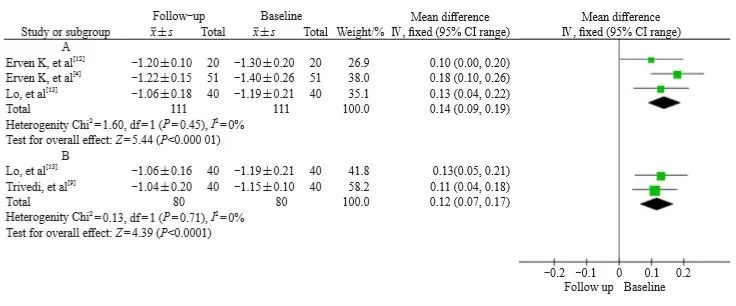
图6 左侧乳腺癌放疗前后GLSr变化的森林图
Fig. 6 Forest plot of GLSr changes before and after radiotherapy for left breast cancer
2.2.6 右侧乳腺癌放疗前后GLSr变化
右侧乳腺癌放疗后,GLSr轻微下降,WMD为0.10(95% CI:0.04~0.17,P=0.002),各研究之间无异质性(I2=35%,P=0.21,图7)。

图7 右侧乳腺癌放疗前后GLSr变化的森林图
Fig. 7 Forest plot of GLSr changes before and after radiotherapy for right breast cancer
3 讨 论
在全球范围内,乳腺癌已成为女性群体中最常见的恶性肿瘤。随着各种治疗手段的不断进步与更新,乳腺癌综合治疗后的生存期逐渐延长。放疗对提高长期生存率和降低局部复发率都有明显的好处。然而,放疗引起的早期心脏毒性也日益引起人们的关注。乳腺癌放射治疗后的心脏毒性是由于心脏大量体积暴露于照射范围,从而对心脏组织产生不利影响。随着现代放射治疗技术和治疗计划不断进步,许多机构采用呼吸门控或阻断心脏切向场来减少心脏照射,但这些现代技术在一定程度上仍然可能影响心脏的一部分,从而增加心脏病的风险[16]。
放射性心脏病可能在治疗后10年以上才出现临床表现。放疗后的早期事件包括心肌细胞损伤和内皮细胞丢失,随之而来的是炎症和血管损伤[17],最终,心脏组织发生纤维化,修复微血管系统损伤[18-19]。这可能在一定程度上解释了早期受损的心肌变形。因此,早期识别辐射对心脏组织的损伤对改善乳腺癌幸存者的生活质量至关重要。
肌钙蛋白I和肌钙蛋白T是心脏发病的敏感和特异性血清标志物。在过去的几年里,许多研究证明肌钙蛋白I和肌钙蛋白T可以作为预测化疗后心脏毒性的生物标志物[20-21]。在放疗所致心脏损伤的研究领域,D’Errico等[22]发现左侧乳腺癌患者在放疗后5~22个月的肌钙蛋白T水平没有变化。相反,Erven等[4]发现51例左侧乳腺癌患者在照射后肌钙蛋白I的平均水平升高。综上, 血清生物标志物在预测乳腺癌放疗后早期心脏损伤方面仍然存在争议。此外,研究[12]表明,常规超声心动图在检测放疗后心功能变化方面不太敏感。本meta分析同样显示左侧乳腺癌患者在放疗后LVEF小幅度下降,但始终保持在正常范围内,而右侧乳腺癌放疗后LVEF没有明显变化。基于多普勒超声心动图的STE是一种较敏感的技术,可以检测和量化放疗后早期心功能的细微区域变化,它可能是评估现代放疗所致心脏毒性的有用工具[4]。STE可以测定多项参数,评估区域心肌功能。其中GLS在许多生理病理过程中都是 最先受到影响的,可能因为大多数纵向纤维位于最容易受损的心内膜下[23]。因此,GLS减少可能是检测亚临床心功能障碍的敏感工具[24-25]。
本meta分析共纳入9篇前瞻性研究文献,其中有两项研究纳入的为只接受放射治疗的患者,其余研究部分或全部患者均接受了化疗。Erven等[12]对未接受化疗的亚组进行单独分析,结果发现接受化疗组放疗前LVEF基线值较低,但放疗导致的下降幅度基本一致,因此并不会影响本meta分析的结果。此外,Erven等[4]研究中所有患者在放疗前均接受了蒽环类药物化疗,不排除晚期化疗对心肌功能的影响。但是亚组分析结果发现右侧乳腺癌患者或接受低剂量辐射的左侧乳腺癌患者心肌段(下壁)的应变在放疗后未见显著降低,因此放疗后应变的下降主要是由放疗导致的。Meta分析结果显示在放疗后6和12个月GLS显著下降,GLSr轻微下降。Heggemann等[15]研究表明在放疗后24个月,GLS仍低于基线水平,但优于放疗后6个月。其中,左侧乳腺癌下降更为明显。可能因为左侧乳腺距离心脏更近,左侧乳腺癌的放疗靶区中心脏组织接受的剂量更高。此外,研究[12]显示,与暴露于较低剂 量的节段相比,暴露剂量高于3 Gy的片段在放疗后应变显著减少。在单因素分析中,放疗后应变的变化与平均左心室节段剂量和接受30 Gy的左心室体积呈显著相关性。目前尚没有研究进行长期随访患者的生存与放疗所致心脏损伤的关系,因此需要进一步的长期随访,以确定应变降低较大的患者是否更容易发生心功能障碍。
本meta分析存在的局限性:① 在放射治疗期间和随访过程中进行超声心动图评估的时间并不一致,这可能对心肌变化的检测有一些影响;② 不同中心对心脏靶区勾画方法及剂量限制差异也会导致心肌变化的差异;③ 研究来自不同中心,采用不同的仪器进行STE检测;④ 相关研究少,且随访时间不一致,不同的时间纳入的研究不同。
综上所述,放疗所致心脏损伤主要发生在左侧乳腺癌,GLS可能是评估放疗后早期心脏损伤的较好参数。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]LOIBL S, POORTMANS P, MORROW M, et al. Breast cancer[J]. Lancet, 2021, 397(10286): 1750-1769.
[2]TAYLOR C, CORREA C, DUANE F K, et al. Estimating the risks of breast cancer radiotherapy: evidence from modern radiation doses to the lungs and heart and from previous randomized trials[J]. J Clin Oncol, 2017, 35(15): 1641-1649.
[3]GAASCH A, SCHÖNECKER S, SIMONETTO C, et al. Heart sparing radiotherapy in breast cancer: the importance of baseline cardiac risks[J]. Radiat Oncol, 2020, 15(1): 117.
[4] ERVEN K, FLORIAN A, SLAGMOLEN P, et al. Subclinical cardiotoxicity detected by strain rate imaging up to 14 months after breast radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2013, 85(5): 1172-1178.
[5] TUOHINEN S S, SKYTTÄ T, POUTANEN T, et al. Radiotherapy-induced global and regional differences in early- stage left-sided versus right-sided breast cancer patients: speckle tracking echocardiography study[J]. Int J Cardiovasc Imaging, 2017, 33(4): 463-472.
[6]SAWAYA H, SEBAG I A, PLANA J C, et al. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients[J]. Am J Cardiol, 2011, 107(9): 1375-1380.
[7]THAVENDIRANATHAN P, POULIN F, LIM K D, et al. Use of myocardial strain imaging by echocardiography for the early detection of cardiotoxicity in patients during and after cancer chemotherapy: a systematic review[J]. J Am Coll Cardiol, 2014, 63(25): 2751-2768.
[8] HEIMDAL A, STØYLEN A, TORP H, et al. Real-time strain rate imaging of the left ventricle by ultrasound[J]. J Am Soc Echocardiogr, 1998, 11(11): 1013-1019.
[9]TRIVEDI S J, CHOUDHARY P, LO Q, et al. Persistent radiation therapy in patients with breast cancer[J]. Radiother Oncol, 2019, 132: 148-154.
[10]FOURATI N, CHARFEDDINE S, CHAFFAI I, et al. Subclinical left ventricle impairment following breast cancer radiotherapy: is there an association between segmental doses and segmental strain dysfunction? [J]. Int J Cardiol, 2021, 345: 130-136.
[11]WALKER V, LAIREZ O, FONDARD O, et al. Early detection of subclinical left ventricular dysfunction after breast cancer radiation therapy using speckle-tracking echocardiography: association between cardiac exposure and longitudinal strain reduction (BACCARAT study)[J]. Radiat Oncol, 2019, 14(1): 204.
[12]ERVEN K, JURCUT R, WELTENS C, et al. Acute radiation effects on cardiac function detected by strain rate imaging in breast cancer patients[J]. Int J Radiat Oncol Biol Phys, 2011, 79(5): 1444-1451.
[13]LO Q, HEE L A, BATUMALAI V, et al. Subclinical cardiac dysfunction detected by strain imaging during breast irradiation with persistent changes 6 weeks after treatment[J]. Int J Radiat Oncol, 2015, 92(2): 268-276.
[14]YU A F, HO A Y, BRAUNSTEIN L Z, et al. Assessment of early radiation-induced changes in left ventricular function by myocardial strain imaging after breast radiation therapy[J]. J Am Soc Echocardiogr, 2019, 32(4): 521-528.
[15]HEGGEMANN F, GROTZ H, WELZEL G, et al. Cardiac function after multimodal breast cancer therapy assessed with functional magnetic resonance imaging and echocardiography imaging[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 836-844.
[16]TRAVIS L B, NG A K, ALLAN J M, et al. Second malignant neoplasms and cardiovascular disease following radiotherapy[J]. J Natl Cancer Inst, 2012, 104(5): 357-370.
[17]STEWART F A, HOVING S, RUSSELL N S. Vascular damage as an underlying mechanism of cardiac and cerebral toxicity in irradiated cancer patients[J]. Radiat Res, 2010, 174(6): 865-869.
[18]SCHULTZ-HECTOR S, TROTT K R. Radiation-induced cardiovascular diseases: is the epidemiologic evidence compatible with the radiobiologic data? [J]. Int J Radiat Oncol, 2007, 67(1): 10-18.
[19]CARDINALE D, SANDRI M T, COLOMBO A, et al. Prognostic value of troponin Ⅰ in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy[J]. Circulation, 2004, 109(22): 2749-2754.
[20]GARRONE O, CROSETTO N, LO NIGRO C, et al. Prediction of anthracycline cardiotoxicity after chemotherapy by biomarkers kinetic analysis[J]. Cardiovasc Toxicol, 2012, 12(2): 135-142.
[21]D’ERRICO M P, GRIMALDI L, PETRUZZELLI M F, et al. N-terminal pro-B-type natriuretic peptide plasma levels as a potential biomarker for cardiac damage after radiotherapy in patients with left-sided breast cancer[J]. Int J Radiat Oncol, 2012, 82(2): e239-e246.
[22]STOKKE T M, HASSELBERG N E, SMEDSRUD M K, et al. Geometry as a confounder when assessing ventricular systolic function: comparison between ejection fraction and strain[J]. J Am Coll Cardiol, 2017, 70(8): 942-954.
[23]HO E, BROWN A, BARRETT P, et al. Subclinical anthracycline- and trastuzumab-induced cardiotoxicity in the long-term follow-up of asymptomatic breast cancer survivors: a speckle tracking echocardiographic study[J]. Heart, 2010, 96(9): 701-707.
[24]HARE J L, BROWN J K, LEANO R, et al. Use of myocardial deformation imaging to detect preclinical myocardial dysfunction before conventional measures in patients undergoing breast cancer treatment with trastuzumab[J]. Am Heart J, 2009, 158(2): 294-301.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











