Science Bulletin 空军军医大学马恒教授团队揭示跨细胞线粒体成分传递触发缺血后心肌纤维化的机制
2023-08-04 论道心血管 论道心血管 发表于上海
该文通过在体MI/R模型和细胞学实验发现,MI/R损伤情况下存在一种心肌细胞来源的sEV (Myo-sEVI/R),其内容物富含线粒体成分。
心肌纤维化是心肌缺血/再灌注(MI/R)损伤后引发心源性猝死的重要原因。MI/R损伤可导致心肌细胞损伤甚至死亡,而成纤维细胞却出现激活、增殖并导致纤维化和心脏重构,导致这一矛盾现象的细胞间通讯机制仍不清楚。因此,阐明MI/R损伤后心肌纤维化过程中,成纤维细胞和心肌细胞之间的细胞间通讯机制具有重要意义。
小细胞外囊泡(small extracellular vesicles, sEVs)在细胞间通讯中起重要作用,通过将蛋白质、脂质和核酸等细胞成分从供体细胞运输到受体细胞,参与广泛的病理生理过程。基于上述生物学功能,sEVs在心血管疾病的临床诊断和治疗中的作用日益受到关注。但是,sEVs是否以及如何介导MI/R后心肌细胞和成纤维细胞间的通讯尚属未知。
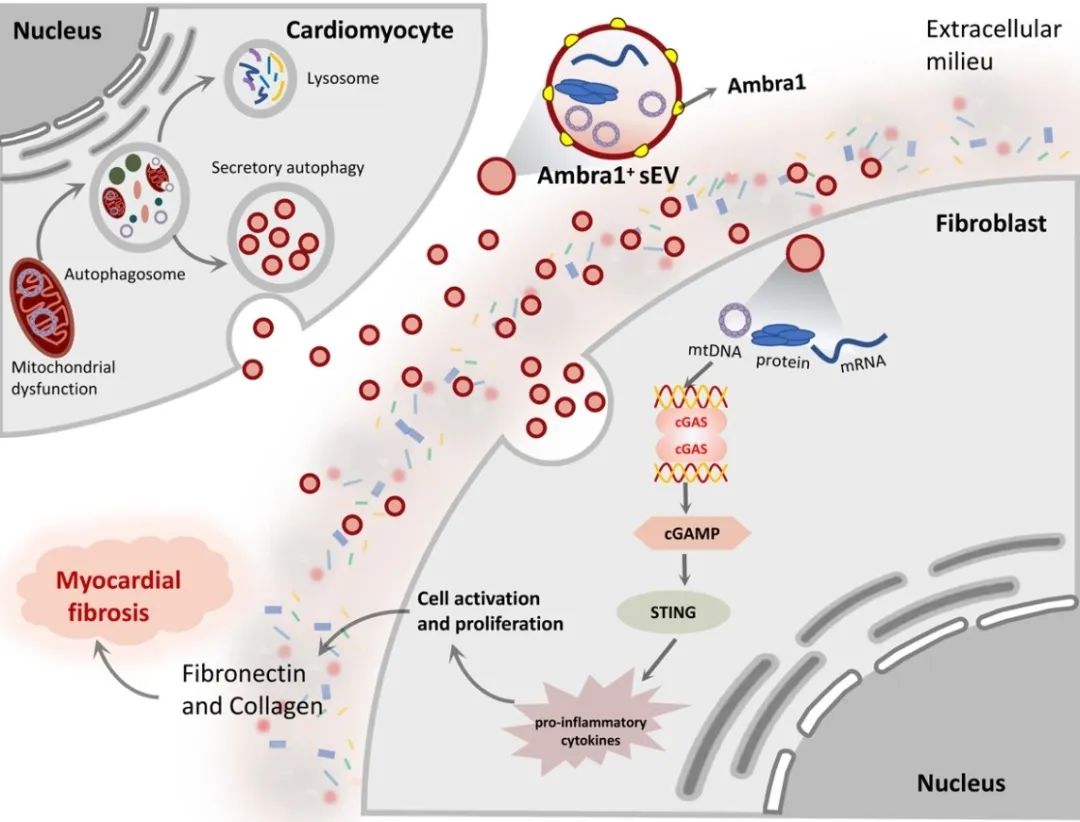
2023年7月24日,空军军医大学基础医学院生理学与病理生理学系马恒教授团队在Science Bulletin上发表了题为“Intercellular mitochondrial component transfer triggers ischemic cardiac fibrosis”的研究论文。该文通过在体MI/R模型和细胞学实验发现,MI/R损伤情况下存在一种心肌细胞来源的sEV (Myo-sEVI/R),其内容物富含线粒体成分。Myo-sEVI/R被成纤维细胞摄取并触发其增殖活化,最终导致纤维化。在研究中,通过生物信息学筛选和实验验证,新发现Ambra1是Myo-sEVI/R中的关键组分和潜在标志物。并且证实,Ambra1定位于Myo-sEVI/R表面;Ambra1+-Myo-sEVs的释放是由MI/R损伤后心肌细胞的分泌型自噬所驱动,而不是经典的降解型自噬。在缺血和缺血周边区域,Ambra1+-Myo-sEVs被成纤维细胞内吞导致跨细胞线粒体成分传递;线粒体DNA (mtDNA)激活cGAS-STING通路,促进成纤维细胞的活化和增殖。此外,该研究的数据显示,心脏特异性的下调Ambra1可抑制Ambra1+-Myo-sEVs的释放和成纤维细胞摄取,有效抑制缺血后心肌纤维化。

首先,研究者检测了MI/R后心肌纤维化的程度和分子特征,发现MI/R可导致梗死区发生病理性纤维化、cGAS-STING通路激活和自噬体降解障碍。值得注意的是,实验结果发现在未降解的自噬小体中富含线粒体成分。
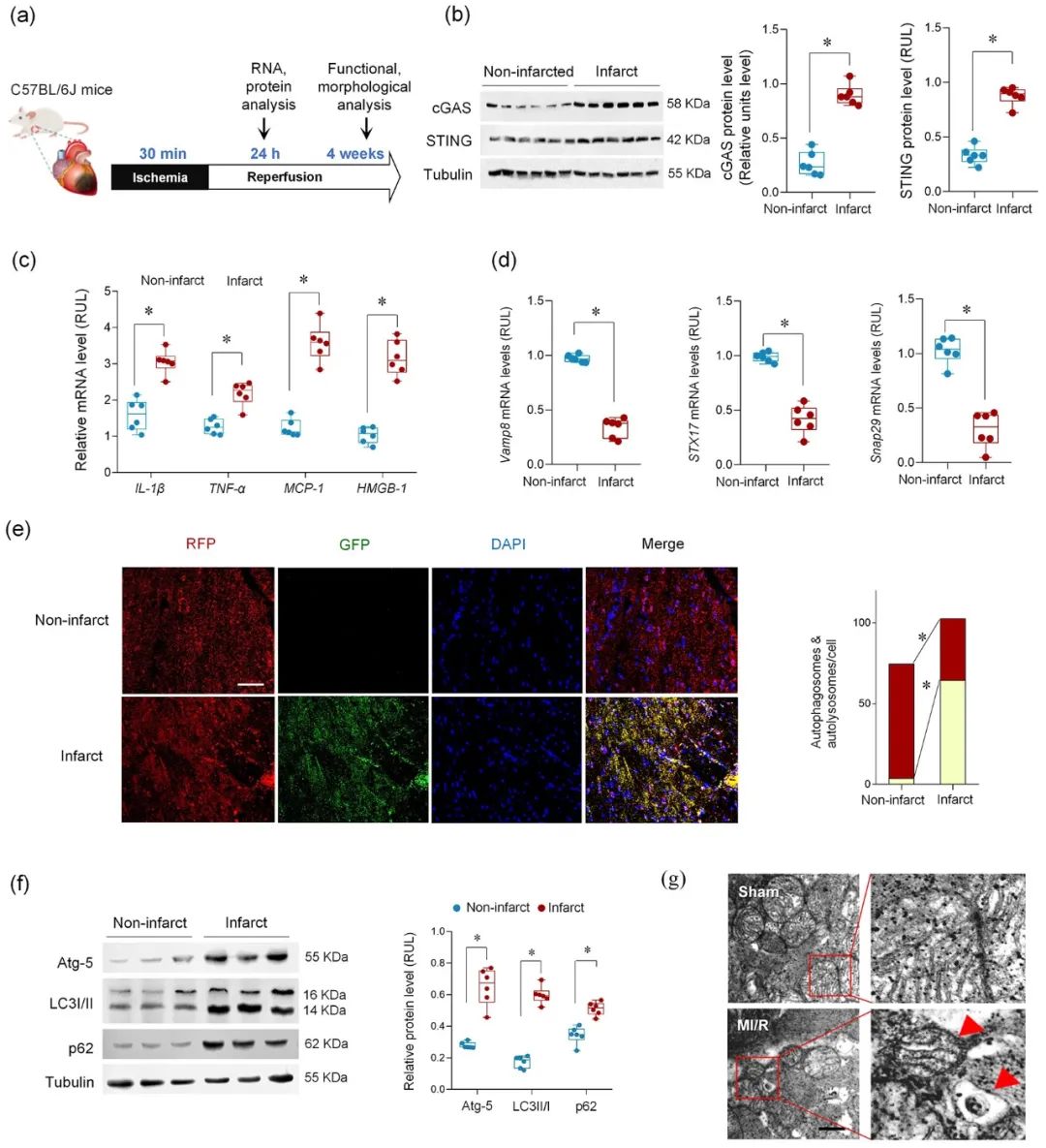
进而,从左心室血中纯化并分离出心肌sEVs (Myo-sEVs),同时使用纳米颗粒跟踪分析(NTA)和电镜来评估Myo-sEVs的大小、分布和形态。结果表明,与Myo-sEVsSham相比,Myo-sEVsI/R尺寸更大、数量更多且蛋白含量更高。进一步通过实验发现,Myo-sEVsI/R的形成和释放受到自噬功能状态驱动;缺血再灌注损伤的心肌细胞以分泌型自噬的方式形成Myo-sEVsI/R。通过生物信息学分析发现,与细胞自噬密切相关的功能分子Ambra1是Myo-sEVsI/R的重要分子标志;Ambra1与LC3紧密结合并定位于Myo-sEVsI/R膜表面。
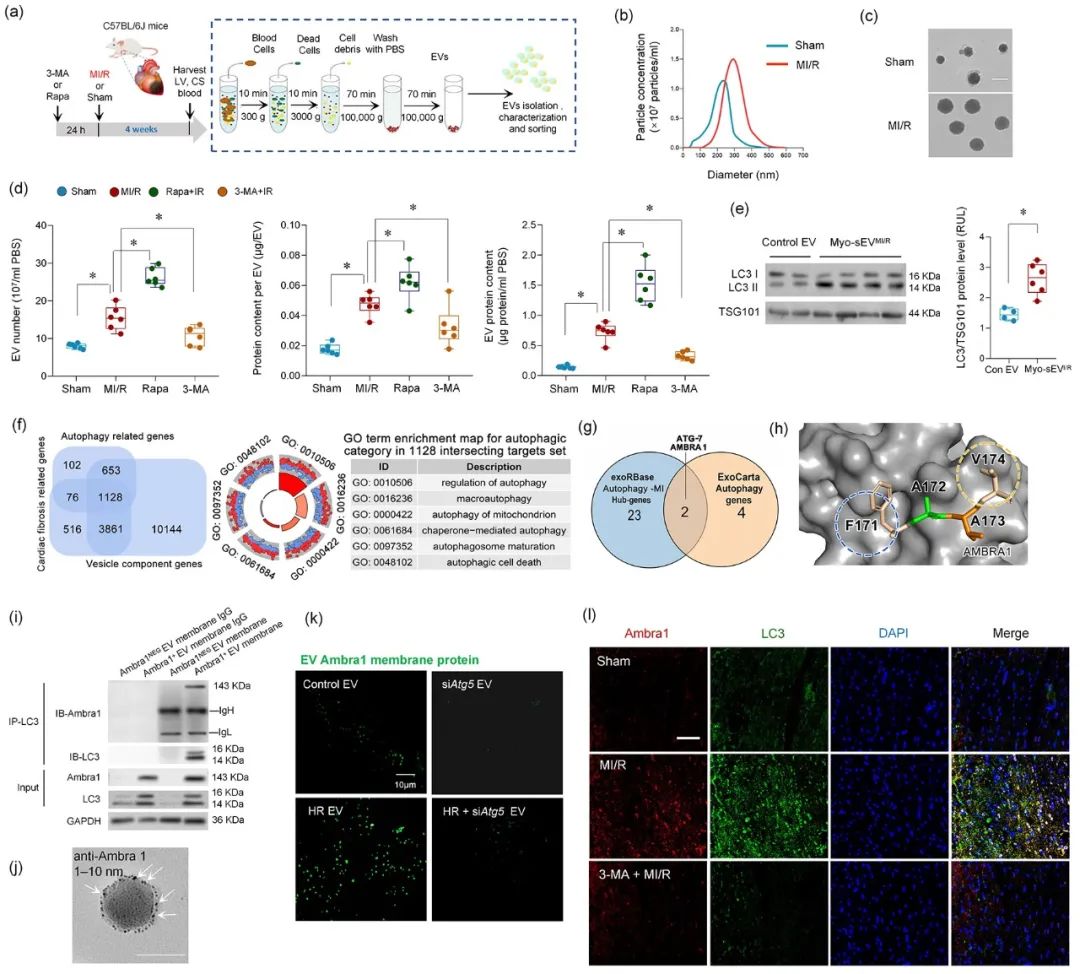
在证明了Ambra1+-Myo-sEVsI/R起源于心肌后,研究者进一步发现成纤维细胞能够优先摄取Ambra1+-Myo-sEVsI/R;其所内含的心肌来源mtDNA被成纤维细胞内化,激活成纤维细胞cGAS-STING通路,促进成纤维细胞的病理性增殖。
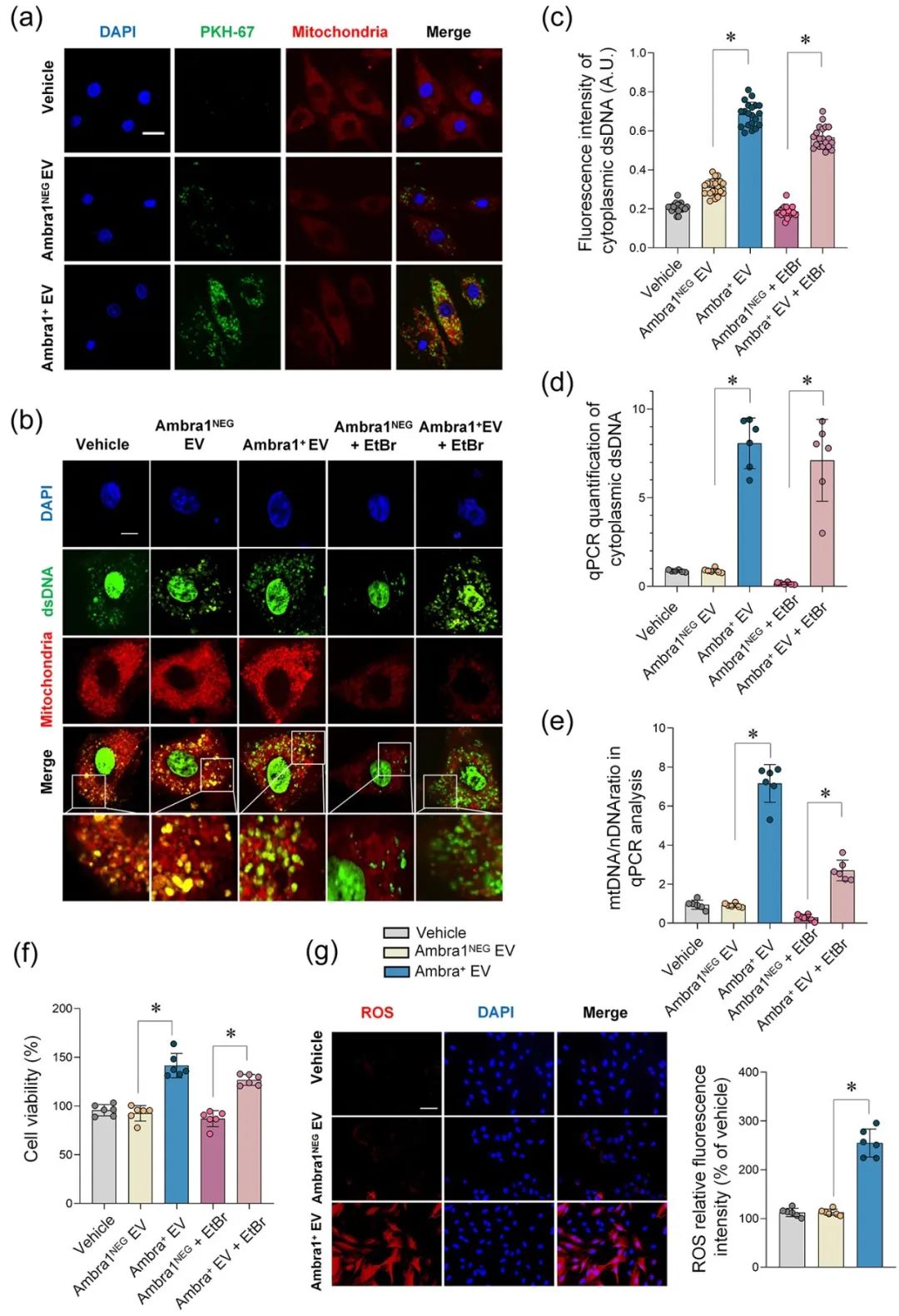
进一步通过gain-and-loss实验在细胞和在体动物水平证实Ambra1+-Myo-sEVsI/R可被成纤维细胞摄取,激活cGAS-STING通路,导致心肌纤维化和心脏功能受损;心肌特异性敲低Ambra1可降低Myo-sEVsI/R的分泌,一定程度抑制成纤维细胞cGAS-STING的激活以及炎症因子的表达,减轻MI/R导致的心肌纤维化程度。
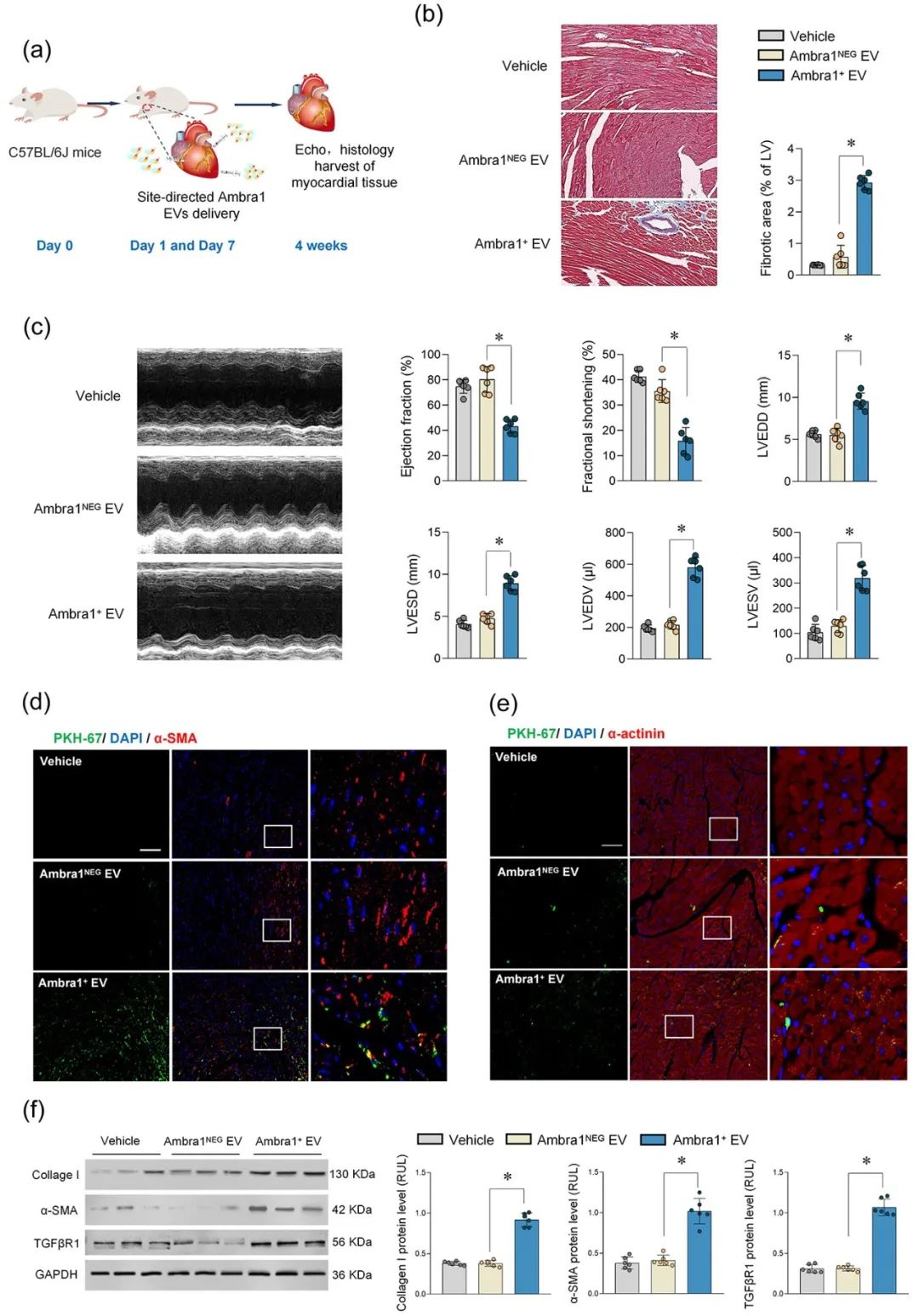
综上所述,本研究表明心肌来源的细胞外囊泡是MI/R后的一种新的细胞间通讯介质。该研究创新性地证实了MI/R损伤的心肌细胞可通过分泌型自噬的方式将受损的线粒体成分外排,并被成纤维细胞摄取,实现跨细胞的线粒体成分传递;阐明了Ambra1可能是分泌型自噬相关的Myo-sEVI/R的新型标志分子,并具有重要的生物活性;靶向Ambra1+-Myo-sEVs可能是缓解MI/R损伤引发纤维化和心脏重构的新策略,该研究为缺血后心脏重塑提供了新的治疗靶点。
西北工业大学医学研究院张婵副教授和空军军医大学郝好助理研究员、王一石博士、穆楠副教授为该论文的共同第一作者。上海精准医学院张家毓教授、空军军医大学马恒教授和余璐教授为论文的共同通讯作者。论文撰写过程中得到了北京大学张岩教授和空军军医大学刘世宇教授、隋秉东教授的帮助和指导。该研究工作得到国家自然科学基金、国家重点研发计划、中国博士后科学基金等多个项目的支持。
原文链接:
https://doi.org/10.1016/j.scib.2023.07.030
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







