孤儿药市场分析之二:孤儿药将成为医药市场强大劲的增长动力
2017-08-02 佚名 新浪医药新闻
1983年《孤儿药法案》颁发以来,孤儿药研发的面貌彻底改观,虽然罕见病患者依旧需要面对高昂的医疗投入,但是FDA和美国政府相应的税收、研发补贴、优先审批等加速措施让更多的罕见病患者有了行之有效的临床控制手段。
1983年《孤儿药法案》颁发以来,孤儿药研发的面貌彻底改观,虽然罕见病患者依旧需要面对高昂的医疗投入,但是FDA和美国政府相应的税收、研发补贴、优先审批等加速措施让更多的罕见病患者有了行之有效的临床控制手段。无论是特朗普政府还是FDA新任掌门人Scott Gottlieb,其对孤儿药研发持相当积极态度,FDA对孤儿药的审批将会进一步加速。上篇《孤儿药市场分析之一: 罕见病背后是巨大的医疗成本》,着眼于孤儿药现状,主要分析了罕见病背后巨大的医疗成本,这篇文章则更多关注孤儿药市场的未来走势,从孤儿药的现实中预测其未来几年的发展态势。
孤儿药研发现状:已成“燎原之势”
我们注意到,个别药物既有罕见病适应症又同时有着非罕见病适应症,那么孤儿药也应该又一个判断标准,evaluatePharma[1]给出了以下几个判定标准:
1、药物审批是基于罕见病适应症;
2、罕见病适应症所带来的销售额应该不低于药物全部销售收入的25%,故Avastin, Enbrel, Herceptin不应归为孤儿药;
3、孤儿药Phase III临床试验往往规模相对小,而药物上市后价格相对较高。
由于政府及监管机构的一系列措施,孤儿药的研发日益获得重视,并取得了非常显着的效果,孤儿药获批数量从1974-1983年的10款药物到1983-2016年的583款,孤儿药研发从“星星之火”,渐成“燎原之势”。
数据显示2016年,FDA总计颁发孤儿药资格认定333款,虽然相较于2015年下跌6%,但是数据显示孤儿药申请依旧十分火热,2016年FDA共计收到孤儿药申请582款,达到历史新高。
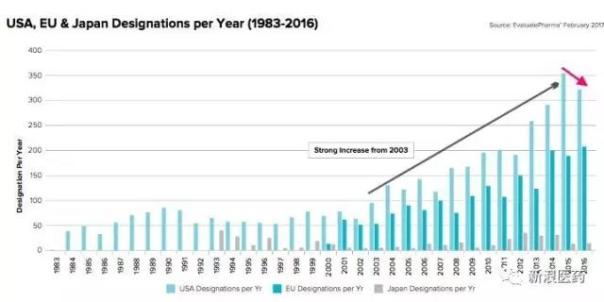
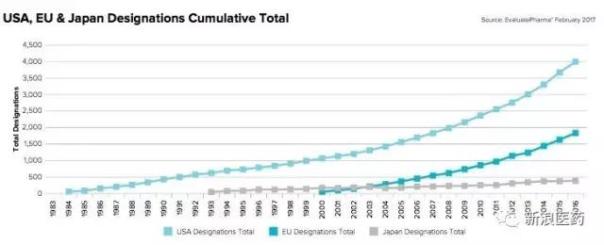
另外,FDA实施孤儿药认定以来,FDA总计有3976项孤儿药认定颁发(截止2016年),而欧盟颁发了1824项,日本颁发了387项。
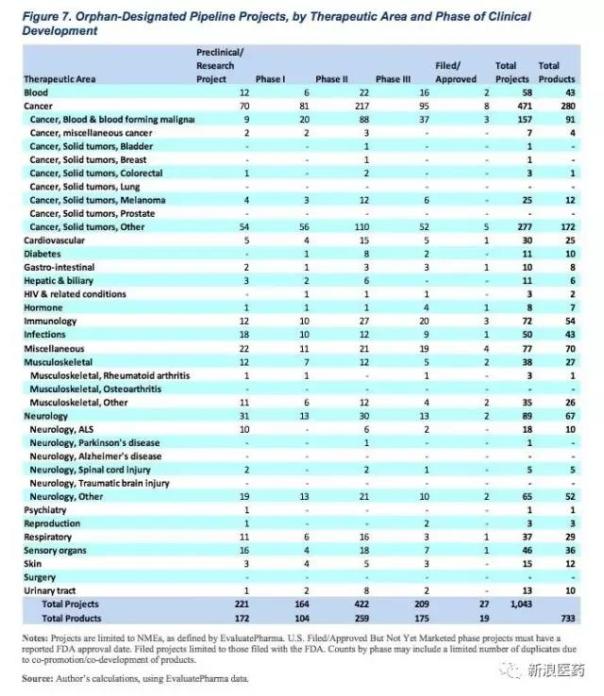
而孤儿药所涉及的适应症包括肿瘤、血液性疾病、心血管疾病等等,总结为下表:
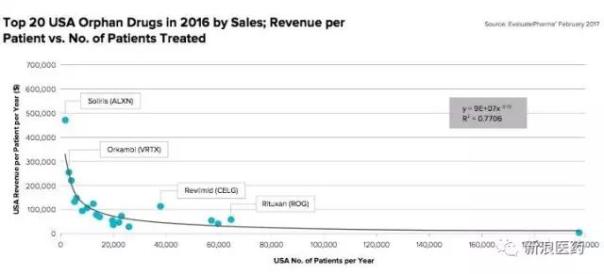
未来5年 孤儿药的市场占比将进一步增加
孤儿药所面向的市场份额是小的,但是产品给原研企业所带来的投资回报同样是客观的,相较于常规药物,孤儿药的销售溢价十分明显,孤儿药所面向的患者群体越小,销售溢价越是明显。
未来五年,孤儿药成为拉动医药市场增长的一个不可小觑的因素,统计显示,未来五年孤儿药市场将会以11.1%的复合年增长率快速增长,并于2022年达到2090亿美金,占世界医药市场的21.4%,其中新基、shire、阿斯利康、abbvie、强生将会成为孤儿药市场中强劲的领导者,而revlimid、opdivo将会成为最为闪亮的销售单品。

另外,有数据显示2022年,孤儿药将贡献55%的欧洲所有研发管线累积价值,这是一个值得注意的研发趋势。
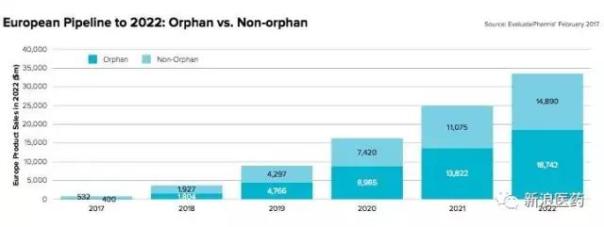
孤儿药研发正在进入快轨道,并日益活跃,日益成为医药市场中贡献巨大的分支领域,孤儿药研发固然具有非常大的投资风险,但是政府和监管部门日益灵活多变的监管审批及市场政策也给孤儿药研发带来更多的机遇,FDA最近公布成立“孤儿产品”开发办公室,以消除孤儿药申请挤压,并要求在90天内予以回应,这无疑是一个重大利好。未来,孤儿药审批可能将会进一步松绑,该领域能够有所作为。
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#市场分析#
65
#医药#
64