Mol Cell:贡红日/饶子和/高岩/刘凤江揭示人源线粒体ATP合成酶的结构
2023-05-30 iNature iNature 发表于上海
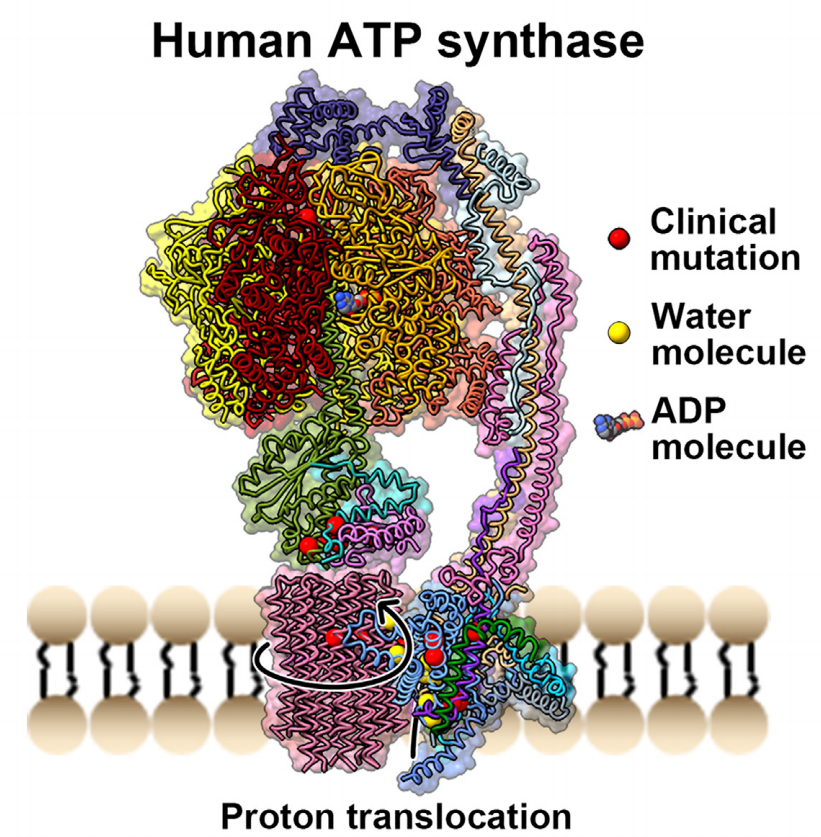
该研究利用冷冻电镜展示了人类ATP合成酶的三个主要旋转状态和一个亚状态的结构特征。
生物能量货币ATP是由F1Fo-ATP合成酶产生的。然而,ATP合成酶作用的分子机制尚不清楚。
2023年5月26日,南开大学贡红日、饶子和、上海科技大学高岩、广州实验室刘凤江共同通讯在Molecular Cell在线发表题为“Structure of the human ATP synthase”的研究论文,该研究利用冷冻电镜展示了人类ATP合成酶的三个主要旋转状态和一个亚状态的结构特征。这些结构揭示了当F1Fo-ATP合成酶的β亚基处于开放构象时ADP的释放发生,显示了ADP结合在合成过程中是如何协调的。F1和Fo“电机”对称性失配的调节是通过整个复合物的扭转挠曲,特别是γ亚基和c亚基的旋转子步来解决的。
水分子在入口和出口半通道中被识别,表明质子在这两个半通道中的转移是通过Grotthus机制进行的。临床相关的突变被映射到结构上,表明它们主要位于亚基-亚基界面,从而导致复合物的不稳定性。总之,该研究解析了人源ATP合成酶四种构象的高分辨率电镜结构,为其功能机制及相关疾病的理解和靶向药物的开发奠定了重要基础。

ATP合成酶嵌入线粒体内膜(IMM)提供了大量的细胞内ATP,是能量流通的普遍来源。这种酶在有氧呼吸下催化氧化磷酸化(OXPHOS)的最后一步富含能量的化合物、脂肪酸、碳水化合物和氨基酸的氧化,产生的电子沿着嵌入在IMM中的电子传递链(ETC)复合物(I-IV)穿梭到分子氧中,产生水并释放必要的能量,从而在IMM中产生质子动力(PMF)。ATP合成酶利用PMF通过旋转机制从ADP和无机磷酸盐(Pi)中产生ATP,这是以前在细菌、线粒体和叶绿体的F1Fo-ATP酶中观察到的一个常见过程。
随着冷冻电镜(cryo-EM)技术的最新进展,对F1Fo-ATP酶的结构和机制的了解取得了巨大的飞跃。这些复合物的一系列结构已经被确定,包括来自细菌和叶绿体的完整的单体状态的F1Fo-ATP酶,以及来自各种线粒体的单体、二聚体或四聚体结构。哺乳动物线粒体中的F1Fo-ATP酶单体由可溶性F1头部结构域(亚基α3β3), ATP合成位点和膜Fo结构域组成,Fo负责质子易位。这两个结构域由一个在F1区域内旋转的中心茎和一个固定的外围茎连接。人ATP合成酶的单个(单体)亚基组装由29个不同亚基的18条多肽链组成,总分子量为592 kDa。虽然许多物种ATP合成酶的结构和机制已被广泛研究,但迄今为止,对人类ATP合成酶的结构和机制知之甚少。
机理模式图(图源自Molecular Cell )
该研究生成了一个完整的模型,人体ATP复合体在三个主要的旋转状态和一个亚状态构成。这种结构促进了人们对其催化机制的理解,并为自然发生的突变体诱导的疾病提供了分子水平的见解。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00324-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







