短效抑制 JNK 信号,增强造血干细胞移植功能
2022-06-24 “生物世界”公众号 “生物世界”公众号
在体外获得足够数目、具有体内造血重建能力 HSC 的突破是该领域向医学转化,临床应用的关键。
造血干细胞(Hematopoietic Stem Cell,HSC)是一类可以重建人体整个免疫系统的成体干细胞,通过维持自我更新和多世系分化的精确平衡,不仅可以维持生物体发育过程各个阶段的造血系统功能,而且在生物体免疫系统的重建过程中起到关键性的作用。
造血干细胞(HSC)移植广泛应用于临床,能够治疗包括血液性疾病,如血液肿瘤、血液遗传缺陷,以及免疫,遗传性等疾病【1】。通常,HSC 来自于骨髓,脐带血和富集的外周血,不仅数量有限,而且很难在体外进行高效地基因编辑,目前领域内尚无一致认可的能够产生跨代、多系、安全、稳定的人源 HSC 方法,严重限制了 HSC 移植的广泛临床应用。
因此,在体外获得足够数目、具有体内造血重建能力 HSC 的突破是该领域向医学转化,临床应用的关键。
而 JNK 信号通路,在干细胞的自我更新和重编程方向的能力一直被忽视。近期,我国学者在该领域接连取得新突破,大大拓展了 HSC 的临床应用潜能。
2022年4月15日,清华大学谢皇帆博士、孙忠杰博士、肖雄博士等在干细胞权威学术期刊 Stem Cell Translational Medicine 发表论文,证明了短效抑制 JNK 信号通路对造血干细胞(HSC)的静息态和移植能力有重大促进作用。而在2019年,正是肖雄博士、来威锋博士、谢皇帆博士等人在 Cell Discovery 期刊发表论文,首次证明抑制 JNK 信号途径能够促进 HSC 体外扩增。
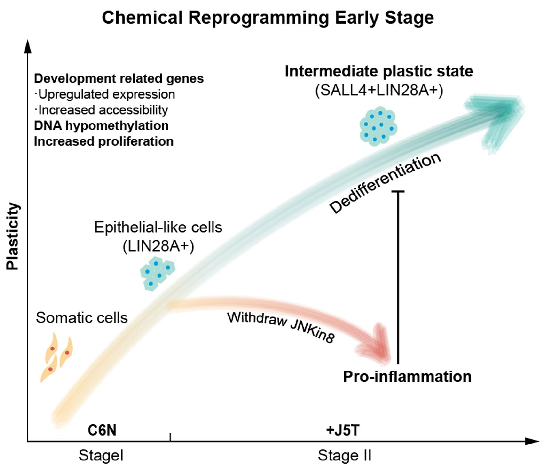
2022年4月13日,邓宏魁团队在 Nature 发表论文,实现了完全利用化学小分子诱导人成体细胞转变为多潜能干细胞,其中 JNK 抑制剂 JNK-IN-8 在人 CiPS 的分阶段精确诱导过程中,扮演了举足轻重的突破性作用。JNK 信号通路被证明是化学重编程的重大障碍,通过抑制 JNK 信号抑制促炎症通路来诱导细胞可塑性、重新获得类似再生的中间状态至关重要。
如何在体外获得足够数目、具有体内造血重建能力的 HSC,是 HSC 临床应用的关键难题,针对这一难题,目前主要的解决方案包括:
1)通过确定及靶向特定基因以及相关的信号通路对脐带血 HSC 进行扩增(ex vivo Expansion)【2】;
2)通过对体细胞直接进行重编程获得功能性 HSC(Direct Conversion)【3】;
3)通过诱导分化将胚胎干细胞(ESCs)或者诱导性多能干细胞(iPSCs)自上而下分化形成【4】。
近十年,该领域在体外扩增人源 HSC 研究上已经有突破性的进展,其中,利用化学小分子直接扩增具有移植功能的 HSC,是最接近临床应用的办法,也是科研领域的新热点。
2010年,Michael P. Cooke 团队通过筛选上万个小分子化合物,发现芳烃受体(AhR)抑制剂 Stem Regenin 1(SR1)对 CD34+ 造血干祖细胞扩增效果明显。通过拮抗 AhR 信号通路调控造血干细胞的自我更新和扩增,低浓度的 SR1 可扩增 CD34+ 细胞50多倍,扩增 HSC 17倍,并且维持了造血干细胞的“干”性能力,与 SCF、TPO、FLT-3L 和 IL-6 等细胞因子混合培养、扩增 CD34+ 细胞,能够维持长期的自我更新能力【5】。
2014年,Guy Sauvageau 团队发现嘌呤类衍生物 UM171 对 LT-HSC 具有显着扩增作用【6】。SR1 和 UM171 的I、II期临床数据显示,异体造血干细胞经过这些小分子体外扩增,然后移植于患者体内,显着的提高了患者的生存率和降低了移植物抗宿主病(GvHD)。
国外在 HSC 体外扩增的研究中,一路领先,我国的研究人员和临床工作者立志开发一种更加有效地扩增办法,为解决 HSC 来源不足的问题提供更好的解决方案。
2019年,北京大学邓宏魁实验室(第一作者为肖雄博士、来威锋博士、谢皇帆博士等)在开发体外 HSC 的基础培养体系过程中,通过对上千个对干细胞有重要调控能力的信号通路的小分子筛选中,发现 JNK 信号通路抑制剂 JNK-IN-8 可以促进造血干细胞体外扩增,其扩增细胞具有连续移植能力【7】。相比于小分子 SR1,JNK-IN-8 对 LT-HSC 的扩增效果更佳,扩增细胞具有长期移植重建和连续移植能力;与 UM171 相比,JNK-IN-8 不抑制红系基因,对其他谱系基因亦无明显抑制效果。

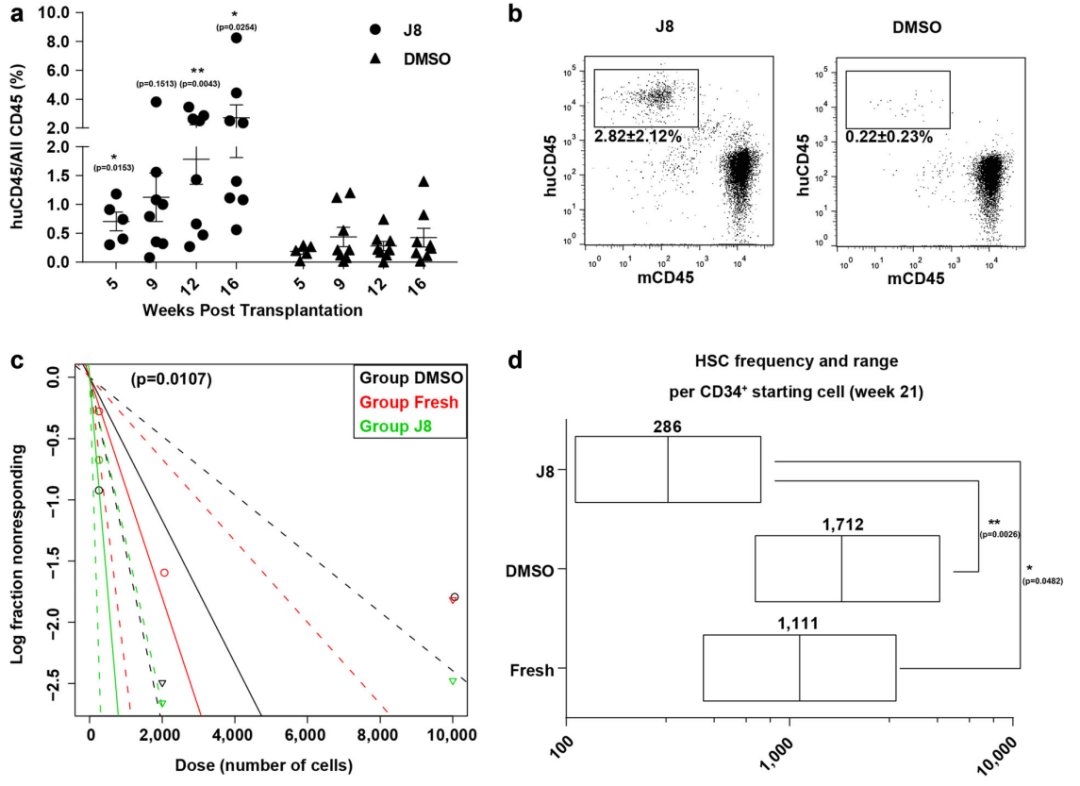
此后,该论文的第一作者肖雄博士和谢皇帆博士继续探索在体外能够维持和培养 HSC 的基础培养体系。
2022年4月15日,谢皇帆博士、孙忠杰博士、肖雄博士等在 Stem Cell Translational Medicine 期刊发表了题为:Transient Inhibition of the JNK Pathway Promotes Human Hematopoietic Stem Cell Quiescence and Engraftment 的研究论文【8】。
他们发现,利用高浓度的 JNK-IN-8 短效抑制 JNK 信号通路,即可提高人源脐血来源的HSCs(CB HSCs)的移植能力。


该研究显示,通过 JNK-IN-8 瞬时抑制 JNK 途径,提升了具有造血干细胞能力的 CB HSCs 13.46倍,而且该研究详细阐释了 JNK-IN-8 瞬时阻断 JNK 途径的分子机制,通过促进 CB CD34+ 细胞进入细胞周期的 G0-G1 期,降低代谢,上调造血干细胞静息态的“干”性基因,MECOM、HOXA5、HLF、MYB、HOXB5、ETV6、MLLT3、MSI2 和 HOPX;维持细胞自我更新能力,增强造血干细胞长期移植功能。
将 JNK-IN-8 培养24小时的 CB HSCs 通过尾静脉注射到免疫缺陷型小鼠体内,经过长达20周的一次移植和14周的二次移植过程的检测,研究团队发现,相比于对照组,JNK-IN-8 短效刺激后的 CB HSCs 造血重建能力提升了14.92倍。
无独有偶,2022年4月13日,邓宏魁团队在 Nature 发表论文,实现了完全利用化学小分子诱导人成体细胞转变为多潜能干细胞,其中 JNK 抑制剂 JNK-IN-8 在人 CiPS 的分阶段精确诱导过程中,扮演了举足轻重的突破性作用。JNK 信号通路被证明是化学重编程的重大障碍,通过抑制 JNK 信号抑制促炎症通路来诱导细胞可塑性、重新获得类似再生的中间状态至关重要。
以上多篇研究论文,通过对 HSC 体外数量的扩增和移植功能的增强,初步证明了利用化学小分子可以解决造血干细胞体外数量不足的难题,进一步拓展了 HSC 的临床应用潜能。
HSC 是人体血液系统和免疫系统的发动机,利用 HSC 在体外可以分化获得免疫细胞(NK细胞、T细胞、B细胞)、红细胞、血小板等终末分化细胞,未来的临床应用价值前景远大!
通过 iPSC 或 ESC 分化获得的 NK 细胞、红细胞、血小板、巨噬细胞,部分已经进入临床研究并取得积极的临床进展,如果未来通过 iPSC 可以直接分化获得造血干细胞,利用上述研究所开发的造血干细胞体外培养体系,先建立造血干细胞库,通过基因编辑进行定点修饰,将获得更加成熟便捷的定制化血液细胞产品,那么首先抗肿瘤临床应用将迎来崭新的局面。届时诸多因血液系统病变造成的疾病,也将以真正的细胞替代性策略予以解决。
参考文献:
1. Orkin, S.H. and L.I. Zon, Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 2008 132(4): p. 631-644.
2. RENTAS S, HOLZAPFEL N, BELEW M S, et al., Musashi-2 attenuates AHR signalling to expand human haematopoietic stem cells [J]. Nature, 2016 532(7600): 508-511.
3. Vo, L.T. and G.Q. Daley, De novo generation of HSCs from somatic and pluripotent stem cell sources. Blood, 2015 125(17): p. 2641-8.14.
4. Shinya Yamanaka., Pluripotent Stem Cell-Based Cell Therapy-Promise and Challenges. Cell Stem Cell, 2020 1;27(4):523-531.
5. Wagner J E., Safety and Exploratory Efficacy Of Ex Vivo Expanded Umbilical Cord Blood (UCB) Hematopoietic Stem and Progenitor Cells (HSPC) Using Cytokines and Stem-Regenin 1 (SR1): Interim Results Of a Phase 1/2 Dose Escalation Clinical Study[J]. Blood, 2013 122(21):698-698.
6. Iman Fares, Jalila Chagraoui, Yves Gareau et al., Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science, 2014 19;345(6203):1509-1512.
7. Xiong Xiao, Weifeng Lai, Huangfan Xie et al., Targeting JNK pathway promotes human hematopoietic stem cell expansion [J]. Cell Discov, 2019 5:2.
8. Huangfan Xie, Zhongjie Sun, Xiong Xiao et al., Transient Inhibition of the JNK Pathway Promotes Human Hematopoietic Stem Cell Quiescence and Engraftment. Stem Cells Translational Medicine, 2022 szac019, 1–7.
9. Jingyang Guan, Guan Wang, Jinlin Wang et al., Chemical reprogramming of human somatic cells to pluripotent stem cells. Nature, 2022 605(7909):325-331.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#细胞移植#
49
#造血干细胞#
59
#造血#
56