大脑越用越“废”?Nature发现神经元DNA修复机制,或推动相关疾病研究进展
2023-02-25 生物探索 生物探索 发表于安徽省
研究人员确定了NuA4复合物的一种特殊神经元形式,它在激活的神经元中围绕NPAS4组装,以调节细胞类型特异性诱导转录并抑制DNA损伤。
用进废退”这句俗语广泛适用于从人体肌肉到思想的一切事物,随着年龄的增长,这种趋势会愈加明显。但当涉及大脑时,这种使用或许并不是一件好事。尽管脑细胞的使用确实可能有助于保持整个生命过程中的记忆和其他认知功能,但科学家却发现相关的大脑活动会引发大量DNA的断裂,进而损伤神经元。
基于此,我们想要知道的是,神经元如何在大脑中执行其重要工作的一生中保持健康和功能正常的呢?
近日,来自哈佛医学院的研究人员在Nature上发表了一篇题为“A NPAS4-NuA4 complex couples synaptic activity to DNA repair”的研究论文。该项研究发现了神经元中存在着一种独特的DNA修复机制,解释了为什么神经元在高强度重复工作的情况下仍然能够持续发挥作用。
 图1 研究成果(图源:[1])
图1 研究成果(图源:[1])
在人体内所有的细胞类型中,神经元是与众不同的,原因在于其不会再生或复制。日复一日,年复一年,它们不知疲倦地根据环境线索改造自己,确保大脑能够在一生中都能保持正常运行。这种重塑过程部分是通过激活大脑中基因转录的新程序来完成的,神经元使用这些程序将DNA转化为组装蛋白质的指令。但神经元中的这种活跃转录带来了高昂的代价,即这一过程加速了DNA的断裂,破坏了制造对细胞功能至关重要的蛋白质所需的遗传指令。
研究人员之一Daniel Gilliam表示,生物学层面上存在的这种矛盾,对神经元的功能及存活至关重要,但对细胞DNA也确实是存在伤害。他们开始对大脑如何平衡神经元的成本和收益感兴趣,对此,Pollina表示:“我们想知道神经元是否有特定的机制来减轻这种伤害,以便让我们保持思考、学习和记忆。”
在这项研究中,研究人员的注意力集中在转录因子NPAS4上,其功能由Michael Greenberg的实验室于2008年发现。NPAS4是一种已知对神经元具有高度特异性的蛋白质,它调节活动依赖性基因的表达,以控制兴奋性神经元对外界刺激的反应抑制。
研究人员在小鼠身上进行了一系列生化和基因组实验。首先,他们确定NPAS4作为由21种不同蛋白质组成的复合物的一部分存在,称为NPAS4-NuA4。研究人员发现,NPAS4-NuA4复合物在激活的神经元中组装以协调诱导基因转录并动态重组大脑中受刺激的神经元回路。
接下来,通过γH2AX ChIP-seq、sBLISS-seq 和 END-seq 对DNA损伤的独立测量表明NPAS4优先结合神经元中经历活性诱导DNA断裂的位点,同时还发现,NPAS4-NuA4结合位点是激活神经元中DNA损伤和修复的热点。
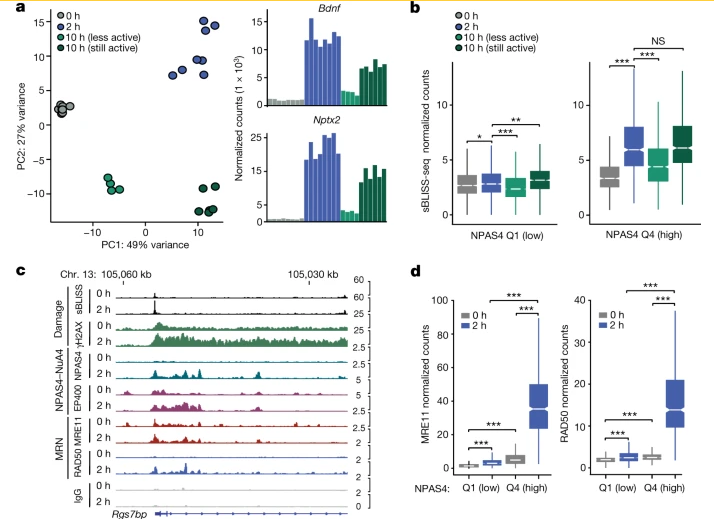 图2 NPAS4-NuA4结合位点随着可诱导转录的消退进行DNA修复(图源:[1])
图2 NPAS4-NuA4结合位点随着可诱导转录的消退进行DNA修复(图源:[1])
试验数据表明,NPAS4-NuA4功能的破坏会导致活性依赖性基因表达失调、活性调节启动子和增强子处的DNA断裂增加、保护性修复机制的定位受损以及锥体神经元体细胞抑制缺陷。据此,研究人员推断,随着动物年龄的增长,NPAS4-NuA4复合物的破坏最终会产生广泛的长期后果。这些变化可能包括对基因组完整性、兴奋性/抑制性平衡和有机体寿命的有害影响。
值得注意的是,研究人员观察到这种神经元因子的缺失大大缩短了雄性和雌性小鼠的寿命,导致其中位寿命分别为12个月和11个月。种系Npas4基因敲除小鼠的寿命缩短特别是由于大脑中NPAS4的丢失,这一点得到了snRNA-seq数据的支持,该数据表明NPAS4对神经元具有高度特异性。
通过该项研究,研究人员确定了NuA4复合物的一种特殊神经元形式,它在激活的神经元中围绕NPAS4组装,以调节细胞类型特异性诱导转录并抑制DNA损伤。未来的研究将探索神经元用于修复活动引起的损伤的精确机制,包括那些由NPAS-4-NuA4介导的机制,这将是重要的研究领域。
研究人员之一的Greenberg渴望更深入地研究该机制的细节,以了解复合物中的每种蛋白质在做什么,涉及哪些其他分子,以及修复过程究竟是如何进行的。他表示下一步是在人类神经元中再次进行试验。
如果以上研究结果在人类身上再次得到证实,这些发现会让科学家们更加深入了解神经元如何以及为什么会随着衰老以及罹患神经退行性疾病而崩溃,还可以帮助科学家们制定策略以保护神经元基因组中易受损的其他区域,或治疗神经元DNA修复出现问题的疾病。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






