Nat Genet:中国学者揭示母亲肥胖导致胚胎缺陷的分子机制
2018-02-20 BioArt BioArt
近几十年来,肥胖显然已经成为一个重要的健康问题,全球范围内超重育龄成年人的流行率急剧增长。过去有研究表明,人群中母亲肥胖与生殖谱( reproductive spectrum)的不良后果密切相关,这些不良后果包括早期妊娠失败、先天性异常以及新生儿系列状况。此外,肥胖母亲的后代在后期也有发生代谢疾病的风险。鉴于肥胖流行的持续增长,因此十分有必要了解母亲营养是如何影响胚胎发育和影响后代健康的。
2月19日,来自南京医科大学王强课题组与北京辐射医学研究所Wenjie Shu课题组合作在Nature Genetics杂志上发表了题为“Embryonic defects induced by maternal obesity in mice derive from Stella insufficiency in oocytes”的研究论文,发现了卵母细胞中Stella蛋白的不充足可能代表了介导了母体肥胖在胚胎和后代中的表型效应的关键分子机理。
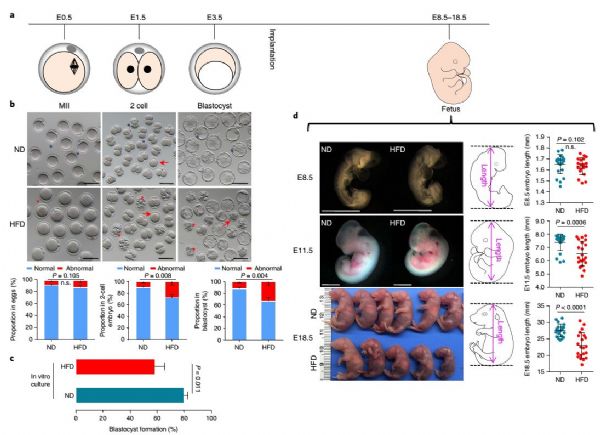
在发育关键窗口期间的环境暴露会影响新生儿成长轨迹,并增加后代的疾病风险。通过小鼠动物模型,许多研究人员发现孕前和孕期暴露于母体肥胖会导致胚胎发育迟缓。然而也有许多胚胎移植实验研究表明,上述缺陷表型并非由于子宫环境造成的,而是本身来自卵母细胞内的原因,这些原因包括减数分裂异常、线粒体功能障碍和氧化应激等。尽管如此,仍然有许多关于母体肥胖改变卵母细胞最终导致胚胎发育和胎儿生长异常的分子机制需要被认识。
在这项研究中,研究人员在采用高脂饲养(HFD)的雌性肥胖小鼠模型中观察了一系列表型,发现HFD后代早期胚胎发育过程中的缺陷——主要是胚胎发育迟缓或者阻滞(下图)。
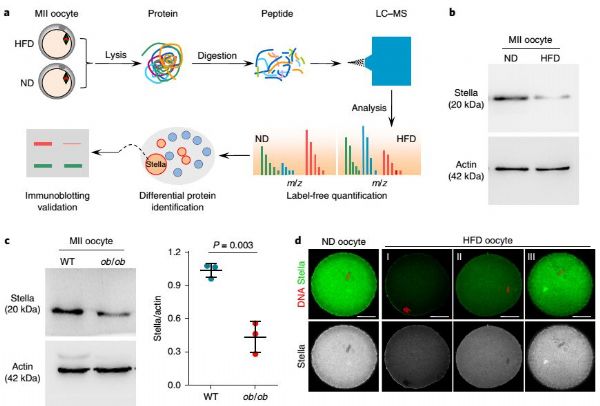
锁定了关键蛋白的变化之后,对于后续分子机制的研究将大大缩小了范围。关于Stella蛋白,过去的的研究表明Stella在早期胚胎发育中是重要的母源因子,Stella敲除的胚胎会导致胞质碎片和发育迟缓(该表型与上述HFD模型小鼠后代早期胚胎发育表型相似)。此外,过去还有研究表明Stella在哺乳动物受精过程发生后参与整体的表观遗传(DNA甲基化)重塑。
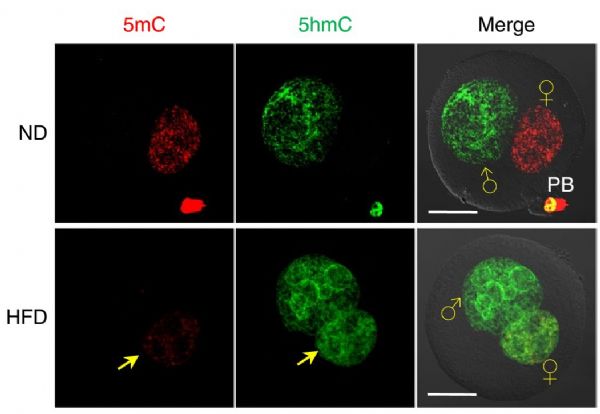
有了上述信息,接下来显然可以在HFD小鼠模型中检测DNA甲基化水平。研究表明,在HFD合子中相比于正常合子(ND)其母源5mC水平显着下降,而5hmC甲基化水平显着增加(下图)。
在早期胚胎发育过程中,TET3介导的DNA去甲基化过程十分重要,此前有报道表明Stella蛋白能够抑制TET3的活性。随后研究人员发现,HFD小鼠的卵母细胞中由于Stella蛋白的不足增加了TET3的活性,从而使得合子中母源DNA的5mC水平下降而5hmC水平升高。值得注意的是,在HFD喂养的小鼠的卵母细胞中过表达Stella不仅能够恢复受精卵中的DNA甲基化图谱,而且还部分改善了早期胚胎和胎儿生长中母体 - 肥胖相关的发育缺陷。

总的来说,该研究确立了卵母细胞中的Stella功能确实可能代表母体代谢综合征,并深入到早期胚胎发育DNA甲基化水平变化揭示了相关分子机制(上图)。相关工作充分利用了高灵敏度的质谱技术鉴定到关键蛋白,然后在前人的系列研究中剥茧抽丝最终比较完整的讲述了一个很好的story,逻辑清晰,阅读起来非常流畅。
王强,1978年生,南京医科大学生殖医学国家重点实验室教授。2007年博士毕业于中国科学院动物研究所生殖生物学国家重点实验室。2007年至2012年在美国华盛顿大学医学院遗传学系和妇产科系从事博士后研究。主要致力于卵母细胞成熟机理以及母源营养跨代影响机制的研究。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Nat#
41
#NET#
36
#胚胎缺陷#
44
#Gene#
51
#Genet#
39
#胚胎#
46
学习
57
努力学习.好好看下
67
近几十年来.肥胖显然已经成为一个重要的健康问题.全球范围内超重育龄成年人的流行率急剧增长.
66
了解一下.谢谢分享!
54