间充质干细胞(MSC)临床应用概况及思考
2016-04-25 东海先生 干细胞者说
MSC的临床研究始于1995年Caplan教授从恶性血液病患者骨髓抽取并分离培养出这些贴壁的细胞,然后回输到患者体内,观察临床效果并证明其临床应用的安全性[1]。虽然有临床实验报道MSC引起心脏毒性,表现为一过性心律不齐,发生率为7%(30例患者中有2例出现)[2-4]。有一个非随机对照试验(造血干细胞移植)中,MSC治疗组100名患者中的3名患者,及对照组100名患者中的8名患者,由于治疗后
MSC的临床研究始于1995年Caplan教授从恶性血液病患者骨髓抽取并分离培养出这些贴壁的细胞,然后回输到患者体内,观察临床效果并证明其临床应用的安全性[1]。虽然有临床实验报道MSC引起心脏毒性,表现为一过性心律不齐,发生率为7%(30例患者中有2例出现)[2-4]。有一个非随机对照试验(造血干细胞移植)中,MSC治疗组100名患者中的3名患者,及对照组100名患者中的8名患者,由于治疗后出现感染而导致死亡[5]。但是,多个随机对照临床试验,通过统计学分析,发现MSC治疗组和对照组的感染率没有差异,明确提出MSC治疗不会增加感染的风险,而且MSC治疗组和对照组在恶液质和成瘤方面没有差异[6-9]。长期观察也没有发现病人增加微生物感染和间充质干细胞致瘤的现象[10-12]。
虽然多个随机对照临床试验证明MSC在临床应用的安全性(无致瘤性),虽然多个国家已经批准MSC上市(见下图1);而美国FDA没有批准上市,这可能导致了很多人对MSC的安全性依然有顾虑,其实美国FDA不批准Osiris公司的Prochymal(骨髓MSC)上市,不是出于安全性考虑,而是因为其治疗GVHD的III期临床试验结果达不到预期。

图1
受精卵发育过了囊胚期后,就不存在胚胎干细胞;整个人体自然生命中,不存在诱导的多潜能干细胞(iPS);但是人体中却存在MSC和造血干细胞(HSC)。这个现象能告诉我们多少信息?
第一,MSC是人体所必需存在的一种细胞类型。目前尚未发现或证明肿瘤细胞来源于MSC,甚至有学者认为肿瘤干细胞不是来源于正常的干细胞[13, 14],那么可以认为自身体内的MSC不会癌变为肿瘤细胞或癌细胞。至于MSC是否促进肿瘤细胞的生长?如果没有免疫系统的存在,MSC分泌丰富的营养性细胞因子,促进肿瘤细胞生长的可能性极大。但是机体存在免疫系统的情况下,外源的MSC能否有促瘤作用?免疫系统、间充质干细胞、肿瘤细胞/癌细胞,这三者的关系需要深入研究(见下图2)。
图2
第二,MSC不等同于免疫抑制剂。MSC一直广泛存在于人体中,而且随机对照临床试验证明MSC的应用没有增加感染率,这说明人体里的MSC并没有发挥抑制免疫反应的作用,免疫抑制功能只是MSC对免疫系统发挥作用的其中一个功能。我们现在对MSC免疫功能的认知需要进一步的加深。虽然国际细胞治疗协会提出免疫调节功能分析作为MSC临床研究的细胞产品放行标准(或者评价标准)[15],但是这个标准无法量化,不具有可操作性。
第三,经过体外扩增后的MSC的安全性是否等同于体内的MSC?未经体外扩增的MSC,细胞本身是安全无害的,除非本身有某种基因缺陷。体外扩增最大的风险在于基因突变。有一研究小组发现骨髓MSC体外培养至18代时,出现基因突变、染色体异常[16]。另一个研究小组发现脐带MSC体外培养至30代才出现染色体异常[17]。我们不能从这两个研究结论得出体外培养的骨髓MSC比脐带MSC更容易出现染色体异常,因为培养体系可能不一样;但也能说明MSC在体外培养代数过高(超过10代)的情况下才会引起染色体异常。
第四,MSC制剂产品(注射液)的安全性不同于MSC细胞本身的安全性。MSC制剂产品,除了MSC外,还含有其他的辅料(缓冲液),比如生理盐水等;还需要考虑培养生产工艺带来的安全隐患。有研究发现利用胎牛血清(FBS)培养MSC,可能会增加MSC的免疫原性[18, 19]。胎牛血清广泛应用于MSC的体外扩增培养,考虑到胎牛血清中存在大量的异种蛋白,我们也应该尽可能地降低MSC细胞制剂中的胎牛血清残留量。无血清培养基是否能满足MSC产业化的需求,值得深入研究。更值得注意的是,MSC细胞制剂中含有二甲基亚砜(DMSO,细胞冻存必须要用的试剂)能明显增加毒副作用,引起超敏反应[20-22]。如果MSC制剂中的内毒素含量超标,则很容易引起发烧。有学者对目前大量的临床试验的文献进行分析(Meta-Analysis),发现MSC输入治疗仅仅与发烧存在一定的关联性,而与其他文献所报道的不良反应没有必要的联系,认为MSC治疗是安全的[23]。MSC治疗引起的发烧,与MSC制剂产品的“胎牛血清、二甲基亚砜和内毒素”这三者的残留量密切相关。胎牛血清残留量、二甲基亚砜和内毒素均与生产工艺密切相关。MSC制剂产品的细胞活率过低、死细胞过多,这些死细胞及细胞碎片均可以引起发烧。另外,需要注意MSC采集时是否有微生物污染,以及在培养过程中引进的外源性微生物污染。微生物污染也是MSC制剂产品的高风险因素。
第五,异体MSC进入体内的代谢。目前关于MSC在机体里的代谢动力学认知均来源于动物实验。由于MSC具有趋化到损伤的组织器官部位的特性,那么MSC在健康机体和疾病机体两种状态下的代谢动力学是不大一样的。MSC来源也是一个影响因素,比如骨髓MSC的细胞体积大于脐带血MSC,导致骨髓MSC在肺部的滞留多于脐带血MSC[24]。实验动物的物种也会影响MSC的代谢动力学,比如没有肺部损伤的狗,MSC在肺部停留的时间约1天[25],但是MSC可在健康的大鼠肺部停留3天[26];给予大鼠肺部放射性损伤后,MSC在肺部停留时间延长只7天[26]。有研究显示MSC在肺部的滞留,肺部环境能激活MSC表达TSG-6,有利于MSC发挥治疗作用[27]。MSC经过肺部后,会随时血液循环到达其他器官,比如肝、肾、脾[25]等。异体MSC在免疫系统健全的小鼠体内的存活时间大约是22天,MSC在小鼠体内的存活时间和小鼠的免疫细胞的缺陷程度成反比,即MSC在NOD/SCID小鼠的存活时间最长,Nude裸鼠次之,正常健康小鼠最短[28]。
第六,适应症的选择。由于MSC广泛存在于人体,那么人体出现的所有疾病,是否都可以应用MSC来治疗?在clinicaltrials网站登记注册的MSC临床试验(I-III期)的病种或适应症有数十种(见下图3),其中不少已经发表了临床研究的结果。那么MSC治疗的适应症的选择依据是什么?MSC的干细胞生物学功能决定了MSC的疗效(治疗方案也很重要),因此,深入研究MSC的功能显得非常重要。早期认为MSC的分化功能适合用来治疗某种疾病,但是MSC的治疗机理更可能在于分泌细胞因子[29-34]。但是目前还没有数据或文章支持生物活性分子组合可以取代MSC来治疗疾病;而且MSC的一些优点是生物活性分子所不具有的,比如低免疫原性、趋化聚集到损伤的局部位置、与组织器官的细胞与细胞间的交流(cell-cell crosstalk)等。
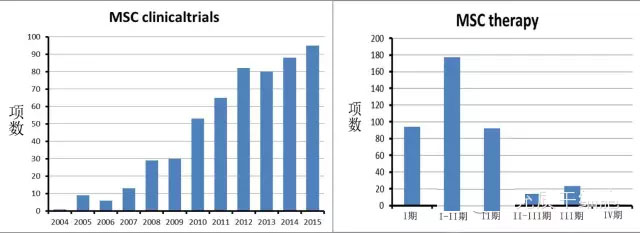

图3
第七,何种情况适合自体MSC治疗。MSC存在于机体多个组织器官,包括骨髓、脂肪、胸腺、外周血等。人体有年龄,组织器官有年龄,干细胞同样有年龄。年龄大的MSC的增长速度明显下降[35, 36]。年龄大的MSC在体外培养时,细胞的胞体比年青的要大很多[36, 37]。而细胞胞体的增大与细胞衰老密切相关[38]。有证明表面衰老的MSC有三个方面的改变:品质下降、分化/再生能力衰减、迁移能力减弱[39]。这部分内容的详细论述可参考本公众号《病人自体干细胞有功能缺陷,不适合自体移植治疗》。某种疾病的患者自身MSC会出现某种功能的缺陷(见下图4),这些功能的缺陷是否严重到影响疗效,这依然需要进一步的深入研究。

图4
总结:
虽然MSC已经被一些国家批准上市,安全性和有效性得到官方和市场的认可;但是,上市并不意味着对MSC研究的终止。MSC的迷人在于她总能给我们一些惊喜,我们要做的就是研究这些惊喜背后的谜团
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#间充质干细#
62
#临床应用#
60
#MSC#
61
好东西值得推广
146
期待成果
224
值得继续研究
158