2022年度盘点|肝癌、胆管癌、胰腺癌多款创新疗法涌现,显著延长生存期!
2023-01-03 厚朴方舟 厚朴方舟 发表于上海
肝癌、胆管癌、胰腺癌的发病均十分隐匿,多数患者确诊时已经是中晚期,预后效果相对不佳。近年来,随着医疗技术的不断进步,越来越多的创新疗法出现在肝胆胰治疗领域。
肝癌、胆管癌、胰腺癌的发病均十分隐匿,多数患者确诊时已经是中晚期,预后效果相对不佳。近年来,随着医疗技术的不断进步,越来越多的创新疗法出现在肝胆胰治疗领域。2022年,针对肝癌、胆管癌、胰腺癌有哪些创新疗法获得突破呢?
2022年肝胆胰治疗领域突破
-
双免疫疗法提高肝癌缓解率近4倍
-
创新靶向疗法治疗胆管癌1年生存率73.1%
-
首款胆管癌免疫疗法获批,效果显著
-
用于胆管癌等20多种癌症的创新疗法获FDA加速批准
-
FGFR抑制剂治疗胆管癌、胰腺癌等效果显著
-
潜在首款!HER2靶向疗法治疗胆管癌效果显著
▲图源:创客贴
1.双免疫疗法提高肝癌缓解率近4倍
10月21日,抗CTLA-4抗体Imjudo(tremelimumab)已经获得美国FDA批准,与抗PD-L1抗体Imfinzi(durvalumab)联用,治疗不可切除的肝细胞癌患者,成为肝癌治疗领域的重要选择!
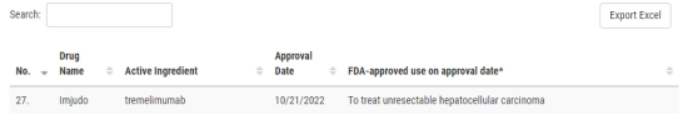
▲图源:参考来源[1]
研究数据显示,与对照组相比,接受双免疫疗法的肝细胞癌患者死亡风险降低了22%;中位总生存期显著延长(16.4个月 vs 13.8个月);客观缓解率增长近4倍(20.1% vs 5.1%)。且约31%的肝细胞癌患者在接受双免疫疗法的3年后仍然存活(对照组为20%)。
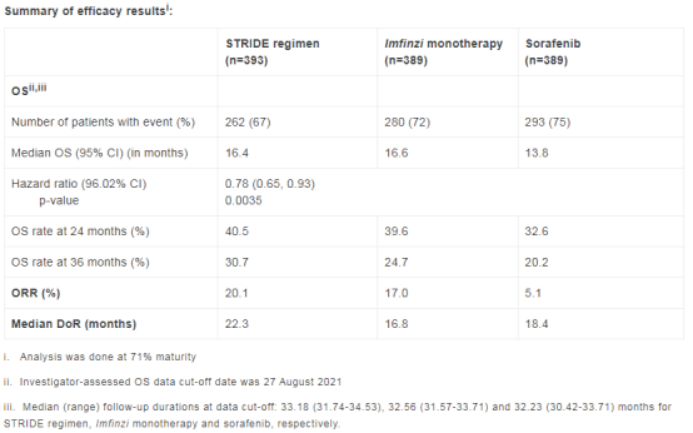
▲图源:参考来源[2]
2.创新靶向疗法治疗胆管癌1年生存率73.1%
今年10月,美国FDA已加速批准Lytgobi(futibatinib)上市,用于治疗携带FGFR2基因融合或其它重排的不可切除、局部晚期或转移性肝内胆管癌经治成人患者。
▲图源:参考来源[3]
2022年美国临床肿瘤学会(ASCO)年会中公布的最新研究结果显示,Futibatinib治疗的缓解率为41.7%,疾病控制率(DCR)为82.5%,中位缓解持续时间(DOR)为9.5个月,74%患者的缓解持续时间超过6个月,中位无进展生存期(PFS)为8.9个月,1年无进展生存率为35.4%;中位总生存期(OS)为20.0个月,1年生存率为73.1%[4]。
3.首款胆管癌免疫疗法获批,效果显著
美国FDA宣布,批准抗PD-L1抗体Imfinzi(durvalumab,度伐利尤单抗)与化疗联用,一线治疗局部晚期或转移性胆管癌(BTC),这是FDA批准的首款用于胆管癌的免疫疗法!
▲图源:参考来源[5]
研究结果显示,Imfinzi联合化疗的组合疗法将胆管癌患者的死亡风险降低了20%,Imfinzi组的中位总生存期为12.8个月,对照组仅为11.5个月;Imfinzi组的中位无进展生存期为7.2个月,对照组仅为5.7个月;Imfinzi组的缓解率为27%,对照组仅为19%。
4.用于胆管癌等20多种癌症的创新疗法获FDA加速批准
今年6月,美国FDA加速批准BRAF抑制剂Tafinlar(dabrafenib,达拉非尼)+MEK抑制剂Mekinist(trametinib,曲美替尼)的组合疗法,用于治疗接受前期疗法后疾病出现进展并且没有满意的替代治疗选择的,携带BRAF V600E的无法切除或转移性实体瘤成人和6岁以上儿科患者。
Tafinlar+Mekinist是首款获批不限癌种治疗BRAF V600E实体瘤的BRAF/MEK抑制剂,也是BRAF/MEK抑制剂首次获批用于儿科患者。

▲图源:参考来源[6]
此次FDA的加速批准是基于三项临床试验中展示的安全性和临床疗效结果。研究结果显示,Tafinlar+Mekinist治疗携带BRAF V600E的实体瘤患者(包括高级别和低级别胶质瘤、胆管癌、妇科癌症以及胃肠道癌症)缓解率达到80%。
5.FGFR抑制剂治疗胆管癌、胰腺癌等效果显著
2022年美国临床肿瘤学会(ASCO)年会中,研究人员公布了EGFR激酶抑制剂Balversa(Erdafitinib)在具有特定FGFR突变的晚期实体瘤患者中的使用效果(RANGER试验)。研究结果显示,对于具有不同种类FGFR驱动突变的实体瘤患者(包括胰腺癌、胆管癌等),Balversa治疗的效果显著。

▲图源:参考来源[7]
具体数据为,Balversa治疗的总体缓解率(ORR)为29.2%,疾病控制率(DCR)为72.5%。Balversa对于14种不同种类的肿瘤有效果,包括唾液腺癌(缓解率为100%)、胰脏癌(缓解率为31%)、胶质母细胞瘤(缓解率为21%)等难治癌症。
6.潜在首款!HER2靶向疗法治疗胆管癌效果显著
2022年12月,靶向HER2的双特异性抗体Zanidatamab作为单一疗法用于既往接受过治疗的HER2扩增和表达(HER2-amplified and expressing)的胆道肿瘤(BTC)患者的结果披露。

▲图源:参考来源[8]
研究结果显示,在既往接受过治疗的HER2扩增和表达的胆道肿瘤患者(包括胆囊癌和胆管癌)中,Zanidatamab单药治疗确认的客观缓解率(cORR)为41.3%,中位缓解持续时间为12.9个月。
此前,美国FDA已授予Zanidatamab突破性疗法认定和快速通道资格,并将其定位为在胆道肿瘤中潜在的“first-in-class"疗法。如果Zanidatamab获批,将可能成为首个针对胆道肿瘤患者的HER2靶向疗法。
总而言之,今年多款药物的获批为肝癌、胆管癌、胰腺癌的治疗提供了新的方向,显著延长患者的生存期。未来,研究人员将继续探索有关肝癌、胆管癌、胰腺癌治疗的研究,旨在让更多癌症患者受益。
参考来源:
[1]Novel Drug Approvals for 2022 | FDA
https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2022
[2] Immunotherapies for hepatocellular carcinoma | Nature Reviews Clinical Oncology
https://www.nature.com/articles/s41571-021-00573-2
[3]FDA Approves Taiho's LYTGOBI:registered: (futibatinib) Tablets for Previously Treated, Unresectable, Locally Advanced or Metastatic Intrahepatic Cholangiocarcinoma
https://www.prnewswire.com/news-releases/fda-approves-taihos-lytgobi-futibatinib-tablets-for-previously-treated-unresectable-locally-advanced-or-metastatic-intrahepatic-cholangiocarcinoma-301638254.html
[4]Taiho Oncology Announces Updated Efficacy and Safety Data for Futibatinib in Cholangiocarcinoma at 2022 ASCO Annual Meeting
[5]FDA approves durvalumab for locally advanced or metastatic biliary tract cancer | FDA
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-durvalumab-locally-advanced-or-metastatic-biliary-tract-cancer?utm_medium=email&utm_source=govdelivery
[6]Novartis Tafinlar + Mekinist receives FDA approval for
https://www.globenewswire.com/news-release/2022/06/22/2467557/0/en/Novartis-Tafinlar-Mekinist-receives-FDA-approval-for-first-tumor-agnostic-indication-for-BRAF-V600E-solid-tumors.html
[7]Janssen Presents Initial Results from the Phase 2 RAGNAR Study of BALVERSA:registered: (erdafitinib) in Patients with Advanced Solid Tumors with FGFR Alterations | Johnson & Johnson
https://www.jnj.com/janssen-presents-initial-results-from-the-phase-2-ragnar-study-of-balversa-erdafitinib-in-patients-with-advanced-solid-tumors-with-fgfr-alterations
[8]Zymeworks Announces Positive Topline Data in the Pivotal HERIZON-BTC-01 Trial of Zanidatamab | Zymeworks Inc.
https://ir.zymeworks.com/news-releases/news-release-details/zymeworks-announces-positive-topline-data-pivotal-herizon-btc-01
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言