名家论道:余科达教授:OFS在绝经前HR阳性EBC的研究回顾与应用探索(下)
2017-11-02 佚名 肿瘤资讯
时代发展,高屋建瓴,2017年第15届St. Gallen国际乳腺癌大会主要议题围绕早期乳腺癌治疗的“加法”与“减法”,最后达成的共识文本也于8月1日在Ann Oncol杂志正式发表,明确治疗的评估涉及到方案强度、用药时间及副作用,根据肿瘤分期和肿瘤生物学预测,力求尽可能大的获益情况下,寻求合理的“加”或“减”治疗方案。专家组支持多数ER阳性乳腺癌患者可以不行化疗的基因表达特征,而对于较高风险患者
时代发展,高屋建瓴,2017年第15届St. Gallen国际乳腺癌大会主要议题围绕早期乳腺癌治疗的“加法”与“减法”,最后达成的共识文本也于8月1日在Ann Oncol杂志正式发表,明确治疗的评估涉及到方案强度、用药时间及副作用,根据肿瘤分期和肿瘤生物学预测,力求尽可能大的获益情况下,寻求合理的“加”或“减”治疗方案。专家组支持多数ER阳性乳腺癌患者可以不行化疗的基因表达特征,而对于较高风险患者,专家组推荐“加法”的辅助内分泌治疗,建议对绝经前患者给予OFS强化治疗,绝经后患者进行AI延长治疗。
新实践: OFS治疗5年获益增“加”
2016年国际乳腺癌研究组(IBCSG)对1978年-1985年间乳腺癌患者(N=4105)的5项RCT研究发表在JCO,24年的随访结果显示,ER阳性患者5年后的复发风险显着,甚至在10年以上的随访后仍然存在重大复发风险。随着ATAC研究长期随访结果陆续发表,明确了绝经后患者阿那曲唑治疗可显着降低乳腺癌术后两大复发高峰。2016圣安东尼奥乳腺癌大会(SABCS)上集中报道了3项AI辅助治疗延长治疗研究结果,自此真正迎来了辅助治疗内分泌“加”的时代。
5年TAM基础上的OFS强化策略点燃新希望
绝经前ER+和/或PR+乳腺癌治疗的大型Ⅲ期临床研究SOFT试验(N=3066),中位随访5.5年的结果可见,根据未化疗和既往化疗(化疗患者占比为53%,末次化疗后8个月内确定保持绝经前状态)进行分层,随机将患者分为5年TAM、5年OFS联合TAM或 AI三组。5年OFS联合TAM方案在总体人群和既往化疗患者中,相较于TAM单药的5年DFS均未有显着获益差别;而5年OFS联合AI治疗在接受化疗亚组患者中可显着降低复发风险达35%;同时,5年OFS联合TAM或AI在<35岁年轻患者(其中接受化疗比例为94%)无病生存率较TAM单药的绝对获益分别达11.2%或15.7%。由此看来,患者联合OFS内分泌治疗获益与化疗或年龄存在着密切关系。但是,是因高危因素而导致化疗的缘故,还是只是因为年龄的关系,尚待我们进一步分析探讨。
5年OFS基础上选择AI成为较高危患者辅助治疗标准
SOFT试验在研究进程中发现研究入组低风险人群数量比预期的多,且DFS也较预期好很多,为确保及时解决试验设计初衷的联合治疗方案选择,研究组修订了原设计方案,2011年对TEXT和SOFT两个研究进行合并分析。结果表明, OFS联合AI组较OFS联合TAM组显着降低复发风险达28%(P<0.001)。
自此,国内外权威指南均进一步加强了OFS的治疗地位,其中NCCN指南从2016 V2开始将5年AI联合OFS作为1类推荐用于较高危绝经前HR阳性早期乳腺癌患者的标准治疗。
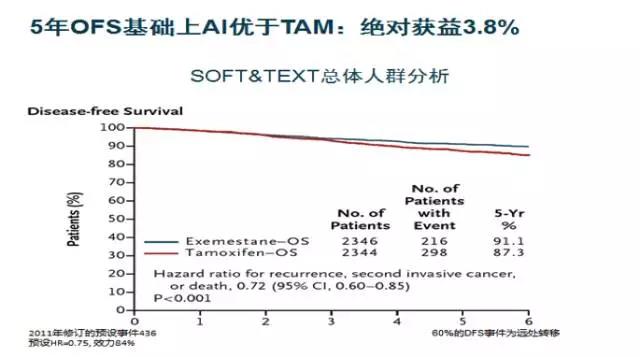
图1:SOFT&TEXT研究结果
探索中前进:如何选择需要OFS联合AI治疗的患者
我们需要从以下两个方面考量OFS+AI的应用:
第一,在前提条件上,OFS通过中枢性调节作用降低雌激素水平是年轻且未绝经患者获益的保障。
第二,在必要性上,还需考虑患者是否“足够高危”(化疗等因素)以及是否对OFS治疗敏感(ER表达)。临床上特别低危患者和特别高危的患者较易判断,但是介于之间的较高危患者一直是判断的模糊地带。鉴于目前尚缺乏一个统一的标准量化指标来帮助我们认识“足够高危”, STEPP分析方法在实践中的应用不失为临床风险评估的一个较好启示,也期待有更多的回顾性和前瞻性研究的进一步验证和考量。
基于TEXT&SOFT研究的STEPP分析是根据临床病理指标的优先级,综合评价和权衡各项指标:年龄、淋巴结状态、肿瘤大小、ER表达情况、PR表达情况、肿瘤分级、Ki67表达, 采用Cox模型计算复发风险的composite risk。分析结果显示:5年OFS联合AI较他莫昔芬单药治疗可提高“足够高危”患者5年无乳腺癌生存率(BCFI)达10%~15%。2017版CBCS乳腺癌指南和规范设定了OFS的主要应用前提:第一是高危患者(如淋巴结转移数4枚及以上);第二是中危化疗患者并伴有年轻或组织学高级别等风险因素。
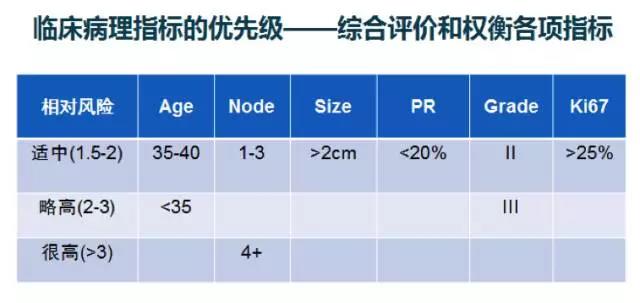
图2:STEPP分析
其次,临床分析也证实ER表达越高,内分泌治疗越敏感,SOFT&TEXT研究入组患者人群中超过95%的患者ER≥50%,因此临床上对ER阳性值较低患者是否采用OFS目前缺乏直接的循证证据。
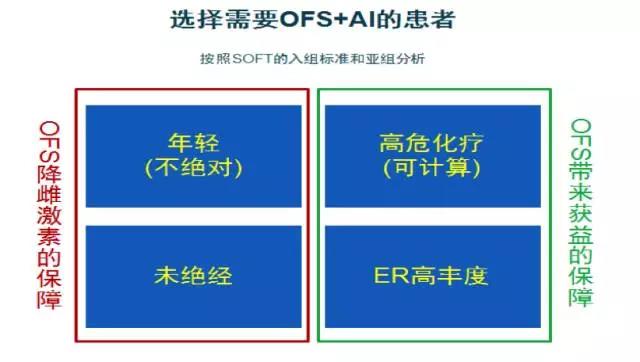
图3:按照SOFT的入组标准和亚组分析
发展中的新问题:如何预测药物OFS的抑E2效果
在OFS的临床应用中,我们已经做到了越来越精准地去判断一个患者是否可以应用OFS,那么在5年OFS应用中,OFS的疗效又如何得到评估监测呢?
2016年西班牙学者Bellet等在JCO上发表的一项卵巢功能抑制试验(SOFT)的前瞻性亚组分析(SOFT-EST)结果显示,在AI联合OFS组中,基线E2、E1和E1S水平的中位减少值始终≥95%。AI联合OFS治疗组患者的3、6和12个月E2水平低于临界值E2水平2.72 pg/ml的比例分别为75%、76.4%和83%。与治疗有关的E2水平超过2.72 pg/ml的相关基线因子包括之前未接受过化疗(P=0.06),较高的体质指数(P=0.05)和较低的卵泡刺激素和黄体生成素(P<0.01)。
从SOFT-EST研究中不难发现,OFS应用至1年时,仅有极少的患者会出现“不完全卵巢功能抑制”( E2>20 pg/ml)。该研究中的E2标准2.72 pg/ml代表着在卵巢功能抑制基础上再进一步利用AI降低90%以上E2浓度的严苛情况。但临床实践中真需要把E2降低到如此低的水平吗?这一问题可能需要我们进一步地探讨。分析来曲唑和阿那曲唑头对头比较的FACE研究疗效等同结果,以及对两药既往相关的理论基础研究可知,能够达到雌激素抑制的阈值,即具有良好的临床疗效,在此阈值基础上进一步降低雌激素水平,可能不会对全部患者均明显增加疗效(虽然不能排除更低的E2可能对某些高危患者或对E2高敏感肿瘤具有一定价值),反而可能增加不良事件如骨关节、心血管疾病等风险。因此只要临床对高BMI、未经过化疗、基线较低的FSH和LH的患者给予一定警惕,适当对其进行E2监测即可。
源于循证,臻于实践,相信大数据时代的来临,乳腺癌内分泌治疗必将百年经典不动摇,百尺竿头更加进步!
余科达教授
复旦大学附属肿瘤医院乳腺外科行政副主任
复旦大学附属肿瘤医院乳腺外科副主任医师
中国抗癌协会乳腺癌专业委员会委员
中国抗癌协会肿瘤靶向治疗专业委员会委员
上海市抗癌协会乳腺癌专业委员会常委
国家自然科学基金会评审
香港研究资助局Research Grants Council评审
《Lancet Oncol》《Cancer Res》《中国肿瘤临床》等国内外肿瘤学知名期刊同行评审
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#HR阳性#
77
#绝经前#
73
#OFS#
63
#绝经#
50