Mol. Neurodegener:Prion蛋白寡聚体在快速进展的阿尔茨海默病中引起神经元细胞骨架损伤
2022-12-07 brainnew神内神外 brainnew神内神外 发表于安徽省
高密度寡聚体的prion蛋白先前已在患有快速进行性阿尔茨海默氏病(rpAD)患者的脑组织中鉴定出来。目前的研究旨在确定rpAD大脑中HDP的相互作用伴侣,以阐明HDP如何参与快速进展的病理学原因。
导 读
高密度寡聚体的prion蛋白(HDPs)先前已在患有快速进行性阿尔茨海默氏病(rpAD)患者的脑组织中鉴定出来。目前的研究旨在确定rpAD大脑中HDP的相互作用伴侣,以阐明HDP如何参与快速进展的病理学原因。研究人员使用蔗糖密度梯度离心法从rpAD大脑额叶皮层组织中分离HDPs,然后通过共免疫沉淀与质谱法鉴定与HDPs相互作用的蛋白质,并使用蛋白质组学工具,免疫印迹和共聚焦激光扫描显微镜进行了进一步的验证。
最终研究人员确定了rpAD特异的HDPs相互作用物,包括growth arrest specific 2-like 2 蛋白(G2L2)。有趣的是,研究人员在G2L2及其相关蛋白(即末端结合蛋白1,α-微管蛋白和β-肌动蛋白)的定位中发现了rpAD特异性干扰。这些结果表明,HDPs参与了神经元肌动蛋白/微管蛋白基础设施的不稳定,这种干扰可能是rpAD的一个促成因素。
论文ID
原名:Prion protein oligomers cause neuronal cytoskeletal damage in rapidly progressive Alzheimer’s disease
译名:Prion蛋白寡聚体在快速进展的阿尔茨海默氏病中引起神经元细胞骨架损伤
期刊:Molecular Neurodegeneration
IF:9.599
发表时间:2021.02
通讯作者:Inga Zerr
通讯作者单位:哥廷根大学医学部神经病学系和德国神经退行性疾病研究中心
实验设计
 实验结果
实验结果
1. 高密度prion蛋白寡聚物(HDPs)
在我们以前的工作中已经报道,与spAD相比,rpAD患者脑匀浆中有HDPs的特定发生。使用10–45%的逐步梯度进行密度梯度超速离心,以获得二十种变化的密度分数。在分离的12至17级分中始终检测到prion蛋白寡聚体(图1b)。由于rpAD和sCJD的高密度级分具有重叠,因此级分12至17被进一步用于下游相互作用组学(图2a)。
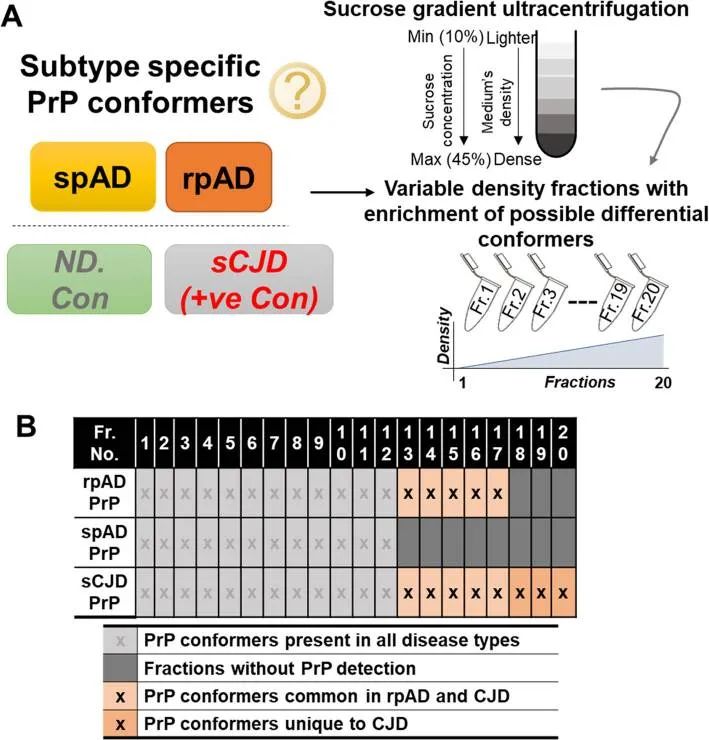
图1 疾病特异性PrP构象体的实验设置和表征
(A)不同构象异构体的分级方案。采用密度梯度离心法,用10-45%的蔗糖梯度分离密度变异体,离心在50000转/分和5°C下进行,从上到下取20个密度组分(从轻到密)用于下游的生化分析;(B)rpAD,spAD,sCJD患者(+ ve con)和非痴呆对照(ND.Con)的皮质分离物中HDPs寡聚物的发生情况。与spAD不同的是,rpAD中的HDP寡聚体在密度范围12到17中被检测到,因此与从sCJD样品中分离出的HDPs有重叠。 
图2 疾病亚型中与HDPs寡聚体特异性相互作用因子
(A)用于进行HDPs及其潜在相互作用物的免疫共沉淀的实验装置;B)维恩图显示了特定于亚型的HDPs相互作用因子的重叠。pF12-pF17:来自多个患者样本的高密度组分12-17的池;IP-F-CON:控制HDFs池中的高密度PrP互作子;IP-F-spAD:spADHDFs池中的HDPs互作子;IP-F-rpAD:rpAD HDFs池中的HDPs互作子;IP-F-MM1:sCJD-MM1 HDFs池中的互作子;IP-F-VV2:sCJD中的HDP互作子。
表1 用抗PrP抗体进行质谱辅助免疫共沉淀鉴定RPAD高密度组分中的HDP结合因子
 2. 鉴定与脑组织中HDPs结合的相互作用因子
2. 鉴定与脑组织中HDPs结合的相互作用因子
通过免疫沉淀从密度梯度组分中分离出具有相互作用的HDPs,并通过MS / MS分析对其进行表征,我们总共鉴定出六个相互作用因子,要么唯一存在于rpAD特异的HDFs中,要么共同存在于rpAD和sCJD亚型特异的HDFs中,而对照和spAD亚型与rpAD没有共同的相互作用因子。有趣的是,来自rpAD HDFs的一些HDP相互作用因子也通常被发现为来自sCJD亚型的HDP构象的相互作用因子。
在rpAD HDFS(IP-F-RPAD)和sCJD-MM1(IP-F-MM1)、sCJD-MM2(IP-F-MM2)和sCJD-VV2(IP-F-VV2)的co-IP洗脱液中发现了3个HDP相互作用因子,即哺乳动物室管膜蛋白相关蛋白1(EPDR1)、钙/钙调蛋白依赖性蛋白激酶II(CaMKII)β亚基(CAMK2B)和δ亚基(CAMK2D)。
IP-F-VV2和IP-F-rpAD还共享共同的相互作用元件,即GTP结合蛋白Di-Ras2(DIRA2)和14-3-3蛋白sigma(1433S),但是观察到G2L2与rp-AD的HDPs特异性的互作(图2,表1)。在补充数据部分讨论了各个亚型的HDPs相互作用因子以及spAD和sCJD亚型样品中常见的相互作用因子。
3. G2L2及其相关蛋白的表达
在rpAD中被鉴定为与HDP相互作用的蛋白质中,由于G2L2在细胞骨架完整性中的重要作用,以及与AD病理学的可能相关性,我们选择G2L2进行进一步的功能验证。据报道,G2L2在肌动蛋白丝和微管的共对准中发挥作用,在其中它通过交联两个结构起作用。肌动蛋白/微管的交联由微管正端的末端结合蛋白-1(EB-1)辅助。
为了更详细地研究样本队列中的G2L2,我们还研究了与G2L2生理功能相关的蛋白质,包括EB-1,微管蛋白和肌动蛋白。通过蛋白质印迹分析评估这些蛋白质在额叶皮质匀浆中的表达,我们发现AD各亚型和对照之间的G2L2水平没有显着差异。同样,在EB-1,α-微管蛋白和β-肌动蛋白组之间也没有发现显著差异(图3)。

图3 G2L2和相关蛋白在实验人群的额叶皮质中的表达
(A和B)免疫印迹显示G2L2、EB-1、α-微管蛋白和β-肌动蛋白的表达水平,GAPDH作为对照。(C-F)G2L2、EB-1、α微管蛋白和β-肌动蛋白在spAD(n=7)、rpAD(n=7)和对照(n=6)病例中的表达。G2L2及其相关蛋白的表达差异无统计学意义。用单因素方差分析计算统计学意义,然后用Tukey's后处理检验。
4. G2L2和HDP的差异共定位会影响神经元的细胞骨架完整性
4.1 G2L2和HDP的神经元共定位会影响G2L2 / EB1的结合
我们在额叶皮层的灰质区域进行了免疫组化实验,在G2L2 / PrP共定位中观察到某些亚型特异性趋势,在rpAD和spAD样品中观察到PrPC和G2L2之间的最高共定位水平(图4a)。ThresholdMander的重叠系数值用于评估显微图像中红色和绿色通道的共定位,其中tM1代表来自红色通道(G2L2)的像素与绿色通道(PrP)的像素重叠,而tM2代表来自绿色通道(PrP)的像素与红色通道(G2L2)的像素重叠。
重叠系数值显示出rpAD中最高的G2L2-PrPC共定位,其次是spAD和对照(图4b)。但是,与spAD和对照相比,我们在rpAD中观察到G2L2和EB-1的共定位显著降低(图4c)。Mander重叠系数值的差异(图4d)也表示rpAD中的共定位水平最低,其次是spAD中的重叠率较高,而对照中的最高。


图4 G2L2和HDP的神经元共定位作用影响rpAD大脑皮层中G2L2 / EB-1的结合和细胞骨架的完整性
(A)用抗G2L2和抗PrP(SAF70)抗体染色的rpAD、spAD和对照的额叶皮质切片的代表性显微照片。(B)rpAD组G2L2通道与PrP通道重叠的阈值Mander's系数(tM1)显著高于spAD组。rpAD的平均tM2(PrP通道与G2L2通道重叠的Mander's系数)也明显高于spAD。(C)G2L2和EB-1染色的rpAD、spAD和对照的代表性额叶组织切片。(D)rpAD组tM1(G2L2)和tM2(EB-1)值明显低于spAD组和CON组。(E&F)用抗α-微管蛋白和抗β-肌动蛋白抗体染色的spAD(E)和rpAD(F)切片的代表性显微照片。
4.2 G2L2 / EB1共定位的干扰与β-肌动蛋白/α-微管蛋白整合的丧失有关
我们使用共聚焦激光扫描显微镜研究了肌动蛋白-微管蛋白共定位,在 z截面进行聚焦扫描,然后用于构建三维图像。与rpAD相比,我们在spAD样品的灰质神经元轴突过程中观察到更明显的肌动蛋白-微管蛋白共定位(图4e和4f);同样,肌动蛋白和微管蛋白通道相关图显示,通道强度之间的重叠程度明显更大(图4e和4f)。
z截面的三维重建还显示,与rpAD相比,在spAD中肌动蛋白-微管蛋白共定位的细丝延伸更长,肌动蛋白和微管蛋白通道重叠更高(图4e和4f)。
5.蛋白质组学也表明rpAD中较高的细胞骨架崩解程度
我们对样本进行MS / MS分析,并将观察到的蛋白质组变异与SWATH-MS获得的基线总体蛋白质组数据集进行了比较,以识别细胞骨架蛋白质的变异。观察到与其他组相比,rpAD患者中的微管蛋白亚基水平显著降低,rpAD中某些神经丝亚基,肌动蛋白和肌动蛋白结合蛋白的水平也显著下降,而与sCJD相比,我们在rpAD中观察到微管相关蛋白(MAP 1A,MAP 1B和MAP 2),FLNA,丝聚蛋白(FLG)和凝集素(PLEC)的水平明显更高。
有趣的是,我们发现rpAD特异性微管相关蛋白tau(MAPT)的水平低于spAD,尽管高于对照和sCJD亚型的水平(图5a)。在来自全球蛋白质组学数据的细胞骨架蛋白中,我们发现肌动蛋白G(ACTG)的表达在rpAD中与对照组相比显著增加,而在spAD和rpAD之间我们未观察到差异。
与rpAD相比,SVD和DFTL中ACTG的表达显着降低。在rpAD中观察到微管蛋白α1a(TBA1A)的表达明显高于其他样本(DFTL,SVD和r-DLB)。同样,与对照,DLB,DFTL和SVD相比,rpAD中TBA4A的表达差异较高(图5b)。

图5 高密度级分中细胞骨架蛋白的变化
(A)通过高分辨率MS / MS分析检测细胞骨架蛋白的相对丰度,结果显示细胞骨架蛋白在rpAD特异性HDF中显著减少;(B)通过SWATH-MS确定细胞骨架蛋白和缔合蛋白表达的差异,热图表示spAD(n=3)、rpAD(n=3)、DLB(n=3)、rDLB(n=2)、D-FTL(n=3)、SVD(n=3)和对照组(n=3)的相对蛋白质表达;(C)G2L2向HDP寡聚体募集的模型。G2L2向HDPs募集导致其与EB-1的结合丧失,从而影响肌动蛋白引导的微管(MT)的完整性。
讨论
阿尔茨海默氏病(AD)是痴呆症最普遍的形式,在全世界影响了超过3000万人,占所有痴呆症病例的60–70%。散发性AD(spAD)和家族性AD(FAD)病例的典型特征是进行性认知功能减退,平均诊断后生存期为8年。然而,在过去几年中,已经有研究报道了一些与快速进展性痴呆类似的AD病例,即进展速度快和认知下降急剧。据报道,与典型的AD病例(平均八年)相比,rpAD病例的诊断后生存时间也短(不到四年)。
由于进展迅速,最初这些病例通常被误诊为病毒疾病,而研究者rpAD患者病情加重的生理变化知之甚少。rpAD患者表现出明显的关于神经变性的CSF生物标记物的表达。Abu Rumeileh等人的研究报告rpAD病例的CSF tau水平显著高于spAD,但是,rpAD和spAD患者之间的磷酸化tau(p-tau),Aβ40,Aβ42,α突触核蛋白和YKL-40的CSF水平没有显著差异。
此外,在一项包含300多个患者样本的大规模研究中,研究者发现rpAD患者的CSF p-tau / tau比值低于spAD患者的CSF p-tau / tau比值。区别rpAD与spAD的其他特征有发病年龄更年轻,APOE4等位基因频率较低,rpAD的血清促炎细胞因子(G-CSF,TNFα,IL-6和IL-13)水平升高,并且rpAD病例的CSF中14–3-3蛋白呈阳性反应的病例增加。
尽管由于快速进展的定义不同因此无法与我们的研究直接比较,但是Ba等人也报道了rpAD患者在[18F]氟脱氧葡萄糖-正电子发射断层显像中表现出区域特异性低代谢。此外,高丰度的低分子量(LMW)淀粉样蛋白低聚物已显示与快速进展的AD病例独特地相关。在较早的研究中,我们描述了额叶皮质中存在细胞病毒蛋白(PrPC)的高分子量寡聚体,特别是在患有快速进行性AD的患者中。
先前的研究已经强调了PrPC在神经元表面利用cAMP / PKA或Erk激活的Fyn激酶途径在神经毒性信号传导中的作用,而更多的神经保护功能似乎是由PrPC的胞外片段介导的,其螯合淀粉样蛋白低聚物,并可能抑制其扩散和毒性。但是,尚未探究在rpAD患者的大脑中发现的prion蛋白寡聚体的生理相关性。
形成AD的过程中,脑组织经历了许多系统性变化,包括神经纤维tau缠结的发展,β-淀粉样蛋白老年斑,突触损伤和细胞骨架机械失调。细胞骨架在神经元的生长和功能中起着至关重要的作用。
神经元细胞质中的有效转运系统,细胞器的细胞内组织以及一定程度的信号转导主要是由神经元中的微管系统来协调的。该微管系统与动力蛋白,驱动蛋白,血影蛋白,原质和光谱原质的结合起作用。
神经元还依靠更短暂的肌动蛋白系统与相关蛋白(如整合素,cofilin和formin)协同作用来建立树突棘,延伸神经突并实现神经元间连接。各种细胞骨架异常也与阿尔茨海默氏病有关。AD中的突触毒性归因于Rho相关蛋白激酶(ROCK)故障,cofilin-actin机制的功能失调,以及drebrin / Ca2+ / F-actin控制的微管动力学改变。也有报道称淀粉样蛋白-β改变海马神经元的树突形态。在疾病形成过程中,微管/驱动蛋白介导的轴突囊泡运输也受到影响,这是由于tau过度磷酸化后与微管细丝脱离引起的。
Drummond等描述了与rpAD和spAD中的与淀粉样斑块差异相关的细胞骨架蛋白,发现rpAD患者的皮质淀粉样斑块中POTE锚蛋白域家族成员E,微管蛋白聚合促进蛋白和微管蛋白alpha-4A链的表达增加,这鼓励了rpAD大脑中细胞骨架蛋白的进一步研究。
据报道,PrPC还与细胞骨架成分相互作用,包括cofilin,actin和微管蛋白,从而抑制了微管的组装。在本研究中,我们旨在鉴定与rpAD患者大脑中与HDPs相互作用的细胞骨架蛋白,从而深入了解rpAD中HDPs的病理生理相关性。
先前已描述了多种PrP构象异构体与动物和人类中可传播的海绵状病毒疾病有关。我们最近发现了与rpAD相关的高密度PrP构象体(HDP)的存在。在本篇文章中,我们旨在通过分离HDP复合物,鉴定HDP相互作用因子以及下游蛋白质组学分析来加深我们对这些发现的理解。
在我们的研究中,我们发现与sCJD相比, rpAD特异性HDP相互作用因子更少。如先前报道,与rpAD相比,sCJD组织表现出更宽的PrP/ PrPSC低聚体谱。sCJD病理学中PrP/ PrPSc寡聚体的多样性更大,可能是sCJD PrP寡聚体相对多样的相互作用基因组的潜在原因。rpAD样品的HDP相互作用体与spAD或对照患者组织之间没有重叠,从而证明了rpAD中存在着某些特异性发生的PrP亚型。
rpAD和sCJD数据集共有的相互作用体指出了在两种疾病实体中均存在共同的PrP寡聚体。与rpAD中的HDP相互作用的蛋白质包括CaMKII亚基(KCC2B,KCC2D),EPDR1,DIRA2,G2L2和1433S。除G2L2蛋白外,所有这些相互作用因子都是rPAD和sCJD中HDP相互作用的一部分。CaMKII除了调节神经元内的钙离子外,还负责在树突棘的发育过程中将肌动蛋白重组成束。结合GTP的Di-Ras2是一种RasGTP酶,因其参与确定细胞的形态发生而闻名。
据报道,G2L2在肌动蛋白-微管蛋白的通讯和连通性中发挥作用。蛋白质14–3-3 sigma是一种具有许多已知相互作用的蛋白质,参与p53,蛋白激酶C和AKT/mTOR信号传导。文献中有强有力的证据表明14–3-3亚型与各种神经退行性疾病有关,尤其是在病毒性痴呆和阿尔茨海默氏病中,其中14–3-3亚型与PrPSc和Aβ斑块有关并用作生物标志物。下文讨论了G2L2与PrP低聚物的新型相互作用的生理结果。
肌动蛋白和微管蛋白的相互连接和通讯是细胞运输系统、形态发生、修复和许多其他相关的正常功能所必需的。同样,生长停滞特异性(GAS)蛋白和类GAS样(GASL)蛋白家族在连接肌动蛋白丝和微管蛋白丝中起着作用。据报道,G2L2蛋白的突变会增加患阿尔茨海默氏病的风险。Stroud和同事提供了GAS和GASL的一个相关模型,其中GASL蛋白G2L1和G2L2通过与末端结合蛋白1(EB-1)相连来控制微管的稳定性。
在我们的研究中,我们发现rpAD队列中HDP-G2L2相互作用与G2L2和EB-1结合之间呈负相关。rPAD患者额叶皮质特异性观察到的肌动蛋白-微管蛋白共定位纤维缩短可解释为G2L2/EB-1/微管蛋白系统紊乱的结果。图5c说明了HDPs如何与细胞骨架系统相互作用的可能机制。HDFS的蛋白质组数据也显示出rpAD患者比spAD和对照组患者有更广泛的细胞骨架崩解。rpAD HDFs中微管蛋白水平的降低表明细胞骨架系统受到了更大的损害,这与先前描述的情况相符。
微管完整性降低是与rpAD相关的不同于spAD的各种病理性级联的迹象,据报道,PrPC通过与微管蛋白直接相互作用来抑制微管的合成。rpAD中唯一确定的PrP寡聚体可能与导致微管损伤程度更高的微管蛋白隔离有关。rpAD中的低微管蛋白HDF水平伴随着MAPT水平的降低以及MAP1和MAP 2水平的升高。
在我们的研究中,快速进展被定义为认知衰退和生存时间相比,结果显示rpAD患者(n=55)脑脊液中p-tau/tau的比值与spAD患者(n=257)相比显著降低(n=257),rpAD患者(n=55)脑脊液中p-tau/tau比值显著低于spAD患者(n=257)。当p-tau分子构象改变并进行齐聚,最终导致tau缠结的形成。rpAD患者脑脊液中p-tau/tau水平的上述差异表明rpAD队列中的MAPT寡聚体将会减少;然而,正如在全球蛋白质组数据中看到的那样,MAP 1和MAP 2的皮质表达在rpAD和spAD之间没有区别。HDF MAP水平升高可能是自身相互作用的结果,也可能是与微管蛋白、肌动蛋白和其他调节因子(如激酶)更强的相互作用所致。MAP隔离也与rpAD皮质微管完整性的丧失有关。
除了微管系统的故障,神经元还会遭受各种其他退化事件的影响。考虑到神经元的大小和复杂性,一个强大的细胞内运输系统显然是必要的,以维持细胞体和其远端神经突起之间的关键连接,以供应各种类型的神经元货物,如细胞器、小泡、细胞信号分子、RNA分子、神经递质、受体和粘附分子。
肌动蛋白引导的微管生长在神经元的结构稳定性中也起着关键作用,包括基于动蛋白的轴突分化和极化,MAP辅助的轴突生长,最后是树突棘的形态动力学。sCJD HDFs中较高水平的细胞骨架蛋白表明CJD的病理过程涉及一套不同的机制。许多先前的研究报道了微管蛋白和PrP之间的相互作用。我们认为,在我们研究的sCJD高密度组分中发现的较高水平的细胞骨架蛋白(微管蛋白亚型和MAP)与它们相互作用的相对较高的HDPs水平相关。
结果表明,如共聚焦显微镜和蛋白质组学分析所示,高密度的PrP低聚物参与了rpAD特有的额叶皮层的细胞骨架损伤。HDP与G2L2的竞争性结合导致G2L2/EB-1/微管蛋白相互作用的中断,从而导致更大程度的崩解和对细胞骨架系统的损害。这些rpAD特异的细胞骨架改变可以促进rpAD患者的疾病进展。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言