唐本忠院士/李莹教授BM:聚集诱导发光材料通过削弱病原菌抗氧化能力或诱导巨噬细胞炎性反应来提升靶向MRSA感染的光动力治疗效果
2024-05-08 BioMed科技 BioMed科技 发表于上海
根据AIE类光敏分子具有高效的活性氧产生潜力,以及光敏剂与细菌结合的作用机制设计合成了三个携带正电荷的D-π-A类光敏分子,分别命名为TI,TBI,以及TTI。
细菌耐药性正使得传统抗菌药物逐渐失效,由超级细菌比如耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)引起的感染正严重威胁着人类健康及公共卫生安全,新型抗菌策略的探索和开发变得愈发重要。基于光敏剂产生活性氧这一特性的光动力疗法是一种新型的且具有优秀潜力的抗菌策略。由于活性氧可以通过对多种细菌结构产生不可逆的氧化损伤进而杀死细菌,因此目前的研究普遍认为光动力治疗效果主要取决于与细菌结合后,光敏剂在相对应波长光辐射下产生活性氧的效率。然而,由于不同光敏剂与细菌结合位点不同,活性氧寿命又相对较短,再加之细菌自身又可以产生多种酶及活性物质来抵御外源的氧化损伤,以活性氧为媒介的抗菌效果存在很大的不确定性。因此,探明光敏剂活性氧产生能力与抗菌功能之间的关系,并以此提升光动力疗效成为一道亟待解决的问题。

近期,唐本忠院士团队在前期工作基础上(Adv. Sci. 2021, 2001750;Angew. Chem. Int. Edit. 2022, 202212386;Adv. Healthc. Mater. 2023, 2300045等),根据AIE类光敏分子具有高效的活性氧产生潜力,以及光敏剂与细菌结合的作用机制设计合成了三个携带正电荷的D-π-A类光敏分子,分别命名为TI,TBI,以及TTI。通过检测这些分子的光动力学活性发现,TI,TBI,和TTI具有相近的活性氧产生能力,其中TTI最强,TBI次之,TI最弱(图1)。
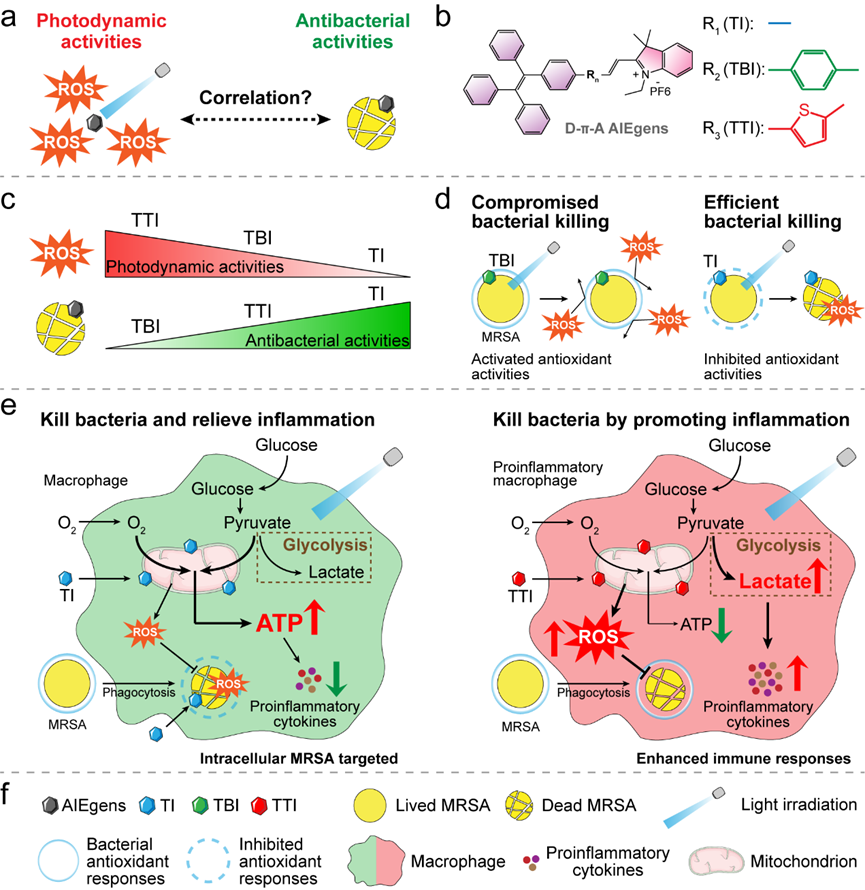
图1、AIE分子通过削弱病原菌抗氧化能力或诱导巨噬细胞炎性反应来提升靶向MRSA感染的光动力治疗效果示意图。
然而,有意思的是,在确定三个分子均能快速穿透MRSA细胞膜并与细菌DNA结合后,作者发现光动力活性最弱的分子TI竟然表现出了最强的抗菌效果。相反,具有较强活性氧产生能力的TBI则没有对细菌活性产生任何显著影响。更重要的是,通过对标记有DCFH的菌体进行连续荧光监测后发现,TI,TBI,和TTI均可以在光照后迅速诱导细菌内相似程度的活性氧累积。这些结果表明,光敏分子的抗菌功能并不与光动力学性能直接相关联。为了了解光敏剂如何杀死细菌,作者进一步关注了细菌在分子连续作用下的生理活动改变,结果发现,与细菌DNA结合的TI和TTI从多个方面影响了其代谢。尤其是分子TI,即使在没有光照的情况下,1 μM浓度的TI依旧可以通过显著抑制MRSA金黄色色素(Staphyloxanthin)及生物被膜的产生来严重削弱细菌的抗氧化功能,最终导致了细菌对活性氧的敏感性提升,使其更易被光力学治疗所清除(图2)。
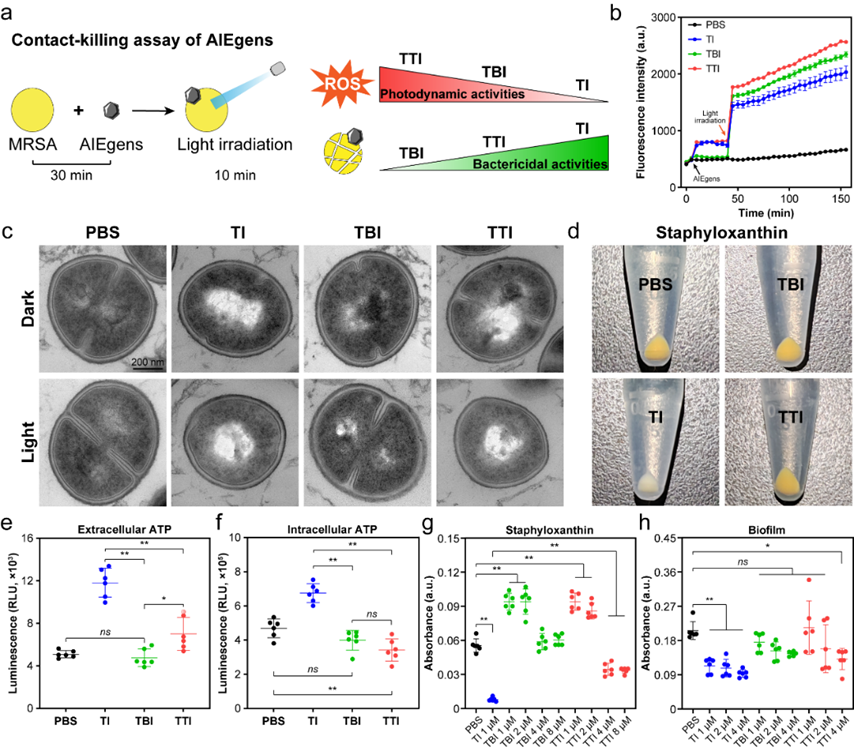
图2、AIE分子抑制MRSA抗氧化功能以增强其对光动力治疗的敏感性。
MRSA造成的感染难以治疗的另一个原因是,当细菌被宿主免疫细胞吞噬后,其可以通过多种途径来干扰和破坏正常的免疫清除,最后病原体得以在宿主细胞内持留并复制,产生反复感染。为了寻找解决这种问题的途径,作者在分子设计上引入了靶向线粒体的吲哚基团。线粒体不仅是宿主免疫细胞的主要供能器官,还能响应细菌感染,调节自噬,溶酶体酸化,炎症等免疫进程,并产生线粒体活性氧(mtROS)来直接杀死细菌。为了了解合成的三种AIE分子是否可以通过改变宿主巨噬细胞线粒体活性来削弱胞内菌感染,作者首先通过多种方法验证了分子们的高生物相容性,随后通过细菌细胞互作模型发现,TI和TTI显著降低了细胞内MRSA的细菌载量(图3)。与直接抗菌结果相一致的是,即使TBI在光照下诱导了宿主细胞内大量的活性氧累积,其没有对胞内菌生存产生影响。这再一次说明,光敏分子的抗菌功能并不与光动力学性能直接相关联。
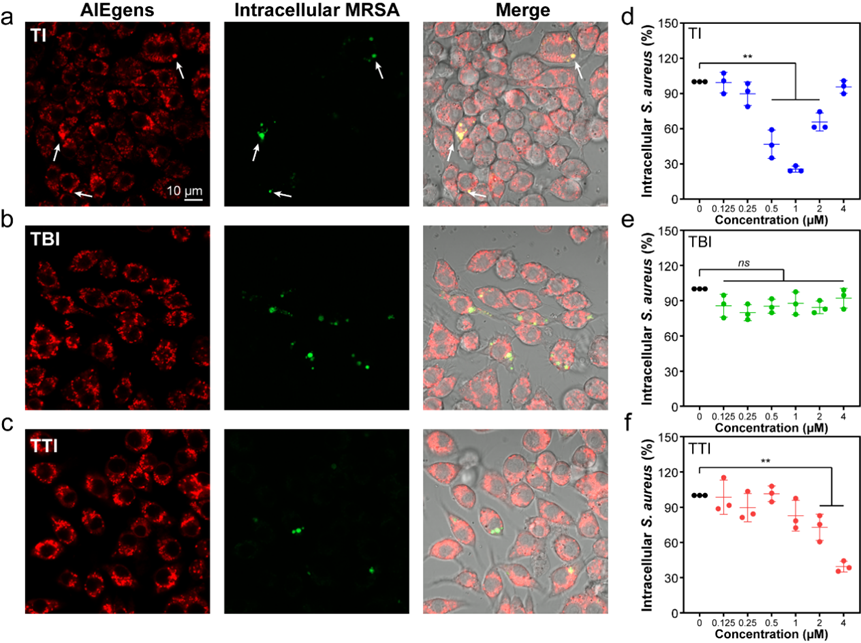
图3、AIE分子抑制细胞内MRSA菌生存。
尽管TI和TTI均抑制了胞内菌存活,其作用机制却不甚相同。通过共聚焦法进行观察,发现只有分子TI可以同时结合细胞内MRSA及细胞线粒体,而TBI与TTI则只能结合宿主细胞线粒体。一方面,与细胞内MRSA结合的TI也可能通过抑制Staphyloxanthin生成来使得细菌更易被宿主细胞的氧化应激清除。另一方面,无法与胞内菌结合的TTI依旧减少了胞内菌数量,说明TTI可能通过调节线粒体活性来增强了抗菌免疫反应。为了进一步阐明抗胞内菌机制,作者表征了三种分子作用下,宿主细胞ATP产生,线粒体膜电位变化,线粒体自噬发生,mtROS表达,线粒体耗氧及糖酵解速率,结果发现TI可以一定程度上提升线粒基础及压力状态下的耗氧及ATP产生,同时显著增强线粒体自噬来加速感染期间受损线粒体的清除,最终促进宿主从感染中恢复。相反,TTI抑制了线粒体活性来大幅提升线粒体活性氧的产生,同时增强巨噬细胞的糖酵解速率来促进炎性反应,进而抑制细胞内MRSA的存活。相比TI与TTI,TBI对多个免疫反应进程都没有产生显著影响。
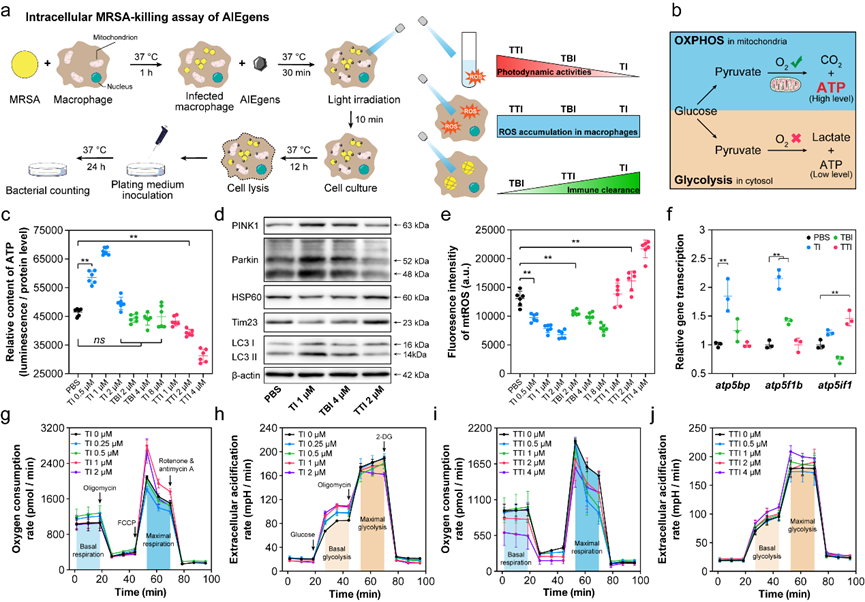
图4、AIE分子调控巨噬细胞线粒体活性及免疫反应。
最后,作者还利用皮肤感染模型验证了分子TI与TTI抗MRSA感染的体内活性。TI与TTI不仅在感染后第5天就相比空白对照组及TBI处理组减少了90%的细菌,还显著加速了伤口愈合。更重要的是,基于对线粒体活性的调节,TI在感染第7天显著降低了炎症反应强度以进一步加速组织修复。相反,由于TTI对糖酵解的增强,即使其加速降低了细菌载量,伤口仍存在较强的炎性反应。而与体外结果相一致的是,相比于空白对照组,TBI处理并没有促进病原体的清除及伤口愈合。综上所述,即使光敏分子同时具有病原体结合能力及优异的光动力学效应,其抗菌功能仍然无法得到保证。相反,削弱病原菌抗氧化功能或者增强宿主细胞的免疫反应则有助于提升针对多重耐药细菌感染的光动力学疗法。
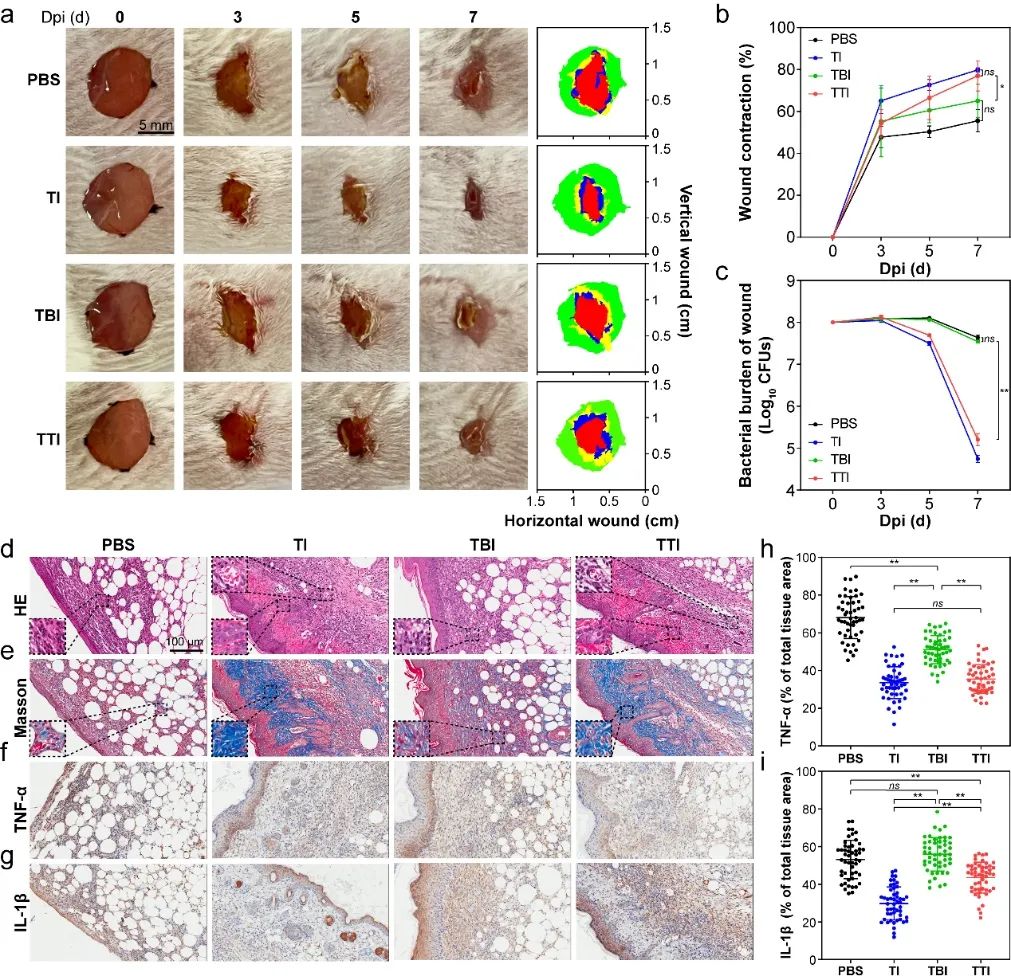
图5、AIE分子促进感染创口细菌清除及组织修复。
广州医科大学李莹教授、香港中文大学(深圳)唐本忠院士为该论文的共同通讯作者,博士后吴逸璠、李建高为本论文的共同第一作者。本研究受国家重点研发计划、国家自然科学基金、深圳市科技创新委员会、深圳市功能性聚集体材料重点实验室等项目资助。
原文链接:
https://www.sciencedirect.com/science/article/pii/S0142961224001170?via%3Dihub
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#MRSA# #光动力治疗# #巨噬细胞炎性反应#
44