Nat. Cell Biol.:揭示蛋白LYP与CSK脱离如何干扰免疫系统
2012-04-14 towersimper 生物谷
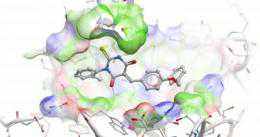
化学物LTV-1阻断突变形式的LYP蛋白在人免疫细胞中发挥作用,从而为治疗自身免疫疾病提供一种潜在性的新方法。图片来自桑福德-伯纳姆医学研究所(Sanford-Burnham Medical Research Institute)研究员Lutz Tautz博士。 自身免疫疾病,如I型糖尿病和类风湿性关节炎,是由于免疫系统过度活跃而攻击和破坏健康组织造成的。已知蛋白LYP的一种突变形式参与多种自身

化学物LTV-1阻断突变形式的LYP蛋白在人免疫细胞中发挥作用,从而为治疗自身免疫疾病提供一种潜在性的新方法。图片来自桑福德-伯纳姆医学研究所(Sanford-Burnham Medical Research Institute)研究员Lutz Tautz博士。
自身免疫疾病,如I型糖尿病和类风湿性关节炎,是由于免疫系统过度活跃而攻击和破坏健康组织造成的。已知蛋白LYP的一种突变形式参与多种自身免疫疾病,但是与之相关的精确分子途径人们一直不清楚。如今,根据2012年3月18日发表在《自然-化学生物学》期刊上的一篇论文,来自美国桑福德-伯纳姆医学研究所(Sanford-Burnham Medical Research Institute)的研究人员展示一种错误形式的LYP如何能够破坏免疫系统。在此过程中,他们也发现一种潜在的治疗自身免疫疾病的新方法:利用一种化学物来抑制这种发生突变的蛋白。
T细胞和自身免疫疾病
在白人群体中,一种突变形式的LYP(lymphoid tyrosine phosphatase,淋巴酪氨酸磷酸酶)蛋白是第三种最为常见的产生I型糖尿病的单基因突变。对类风湿性关节炎而言,它排名第二。
研究人员早就知道LYP和另一种蛋白CSK(C-terminal Src kinase,羧基端Src激酶)一起协同工作来阻止免疫系统中破坏性T细胞被激活。因为T细胞不受控制的激活是很多自身免疫疾病的一个典型特征,所以让LYP和CSK合适地发挥作用被认为是能够对T细胞激活形成一种制约。
尽管正常的LYP蛋白能够结合CSK,但是与疾病相关联的发生突变的LYP却不能如此。在这项新研究中,桑福德-伯纳姆医学研究所研究员Lutz Tautz博士领导的一个国际性的科学家小组发现正常的LYP能够从CSK上脱离下来,而且矛盾的是,这种脱离居然更好地让LYP抑制激活T细胞的信号。这些发现能够解释为什么突变形式的LYP要比正常的LYP更善于抑制T细胞激活。
“一种破坏T细胞信号传导的蛋白如何导致自身免疫疾病仍然是一个谜”,Tauz说,“在一种简单的自身免疫模型中,人们得到的结果可能与实际情形完全相反。”
Tautz说,一种可能的解释就是,突变形式的LYP减弱调节性T细胞的作用,因为这类T细胞控制着导致自身免疫疾病产生的其他类型T细胞。
“鉴于调节性T细胞原本起着抑制信号传导的作用,如果它们在人们体内不那么活跃的话,那么它们可能不能够恰当地做好它们应当做的工作”,Tautz说。
有助于开发出新的治疗方法
在他们的研究中,研究人员也筛选了5万种化合物,结果发现它们当中的33种能够特异性地影响LYP活性。一种被称作LTV-1的化合物阻断突变形式的LYP在人T细胞中发挥作用。事实上,在生理条件下,LTV-1是迄今为止人们报道的最为强效的LYP抑制剂。
Tautz说,他计划接下来继续对LTV-1进行改造,部分上通过对它进行化学修饰以便使得它成为一种更加有效的药物。然而,在小鼠身上进行测试可能存在问题,这是因为最近另一项研究表明含有对应LYP突变的小鼠一点儿也不会生病。
开发治疗自身免疫疾病的新方法将惠及上百万人。总体而言,自身免疫疾病单在美国就影响着2500万多人。根据美国卫生与人力资源服务部的数据,自身免疫疾病是导致患者死亡和残疾的一个主要原因。(生物谷:towersimper编译)

doi:10.1038/nchembio.916
PMC:
PMID:
LYP inhibits T-cell activation when dissociated from CSK
Torkel Vang, Wallace H Liu, Laurence Delacroix, Shuangding Wu, Stefan Vasile, Russell Dahl, Li Yang, Lucia Musumeci, Dana Francis, Johannes Landskron, Kjetil Tasken, Michel L Tremblay, Benedicte A Lie, Rebecca Page, Tomas Mustelin, Souad Rahmouni, Robert C Rickert & Lutz Tautz
Lymphoid tyrosine phosphatase (LYP) and C-terminal Src kinase (CSK) are negative regulators of signaling mediated through the T-cell antigen receptor (TCR) and are thought to act in a cooperative manner when forming a complex. Here we studied the spatiotemporal dynamics of the LYP–CSK complex in T cells. We demonstrate that dissociation of this complex is necessary for recruitment of LYP to the plasma membrane, where it downmodulates TCR signaling. Development of a potent and selective chemical probe of LYP confirmed that LYP inhibits T-cell activation when removed from CSK. Our findings may explain the reduced TCR-mediated signaling associated with a single-nucleotide polymorphism that confers increased risk for certain autoimmune diseases, including type 1 diabetes and rheumatoid arthritis, and results in expression of a mutant LYP that is unable to bind CSK. Our compound also represents a starting point for the development of a LYP-based treatment of autoimmunity.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#Cell#
107
#Nat#
67
#CEL#
66
#Csk#
74
#Bio#
101
#Biol#
85