备受关注的疫苗管理法草案迎来三审,国内疫苗产业能否“回春”?
自去年长生生物“假疫苗”事件引发舆论争议之后,公众对于疫苗管理制度问题十分关注,《疫苗管理法》也应运而生。
6月25日,十三届全国人大常委会第十一次会议6月25日-29日在北京举行,备受关注的疫苗管理法草案也将提请三审。
作为疫苗管理领域的专门立法,草案三审稿将加大对疫苗违法行为的处罚力度,提高罚款额度,增加处罚种类。
同时补充规定一些违法行为的法律责任:违反本法规定,构成犯罪的,依法从重追究刑事责任;对生产、销售的疫苗属于假药、劣药等违法行为,加大对责任单位及责任人员的罚款处罚力度;对有眼中违法行为的责任人员,增加规定行政拘留。
此前疫苗领域最权威的文件是2005年颁布实施、2016年修订的第668号国务院令——《疫苗流通与预防接种管理条例》,即将诞生的《疫苗管理法》也将成为疫苗领域的最全一步法律,将全面加强疫苗从研发、生产、流通和使用全链条的监管,提升监管水平,保障产品质量、推动整个疫苗行业不断进步。
长生生物91亿元罚款遭强制执行
长生生物“假疫苗”事件虽然只是个案,但却留给市场太多反思。
2018年7月15日,国家药品监督管理局的一纸通告,揭开长生生物疫苗造假内幕。通告显示,长生生物在冻干人用狂犬病疫苗生产过程中存在记录造假等严重违反《药品生产质量管理规范》行为。
根据检查结果,国家药监局责成吉林省食品药品监督管理局收回长生生物相关《药品GMP证书》。自此,*ST长生股价跌入漫漫熊途。
2019年6月19日,*ST长生再次发布公告称,全资子公司长生生物因不能清偿到期债务,且明显缺乏清偿能力,广东省疾控中心、交行吉林省分行、长春市南湖实业集团、长春宏日新能源有限责任公司等分别向长春市中院申请对长生生物破产清算,长春市中院决定对上述申请进行审查。
狂犬疫苗事关人民身体健康与生命安全,监管曾对此保持“零容忍”的态势。监管部门认为自2014年1月至2018年7月生产的所有涉案产品(共计748批)均为劣药,长生生物因此遭吉林省食药监局罚没共计91亿元。
*ST长生发布2018年半年报显示,截至报告期末,归属于上市公司股东的净资产为37.45亿元,已经资不抵“罚”。
中国证监会专门为此修订退市制度,退市新规规定:上市公司存在涉及国家安全、公共安全、生态安全、生产安全和公众健康安全等领域的重大违法行为的,将启动强制退市程序。因此,退市新规一度被解读成“为长生生物量身定做”。
诸多问题仍待商榷
对于即将到来的草案三审,有专家认为,疫苗异常反应如何进行监测、处理和补偿等问题,仍值得重点关注。
疫苗不良反应分为两种:一种是由合格的疫苗在实施规范接种过程中或接种后造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应;另一种则是疫苗本身存在质量问题。
在4月20日的草案二审中,扩大了异常反应补偿范围,明确实施接种过程中或者实施接种后出现受种者死亡、严重残疾、器官组织损伤等损害,属于预防接种异常反应或者不能排除的,应当给予补偿。
这替代了一审稿中“实行无过错原则”的提法,也是异常反应补偿制度首次在国家层面提出。但二审审议中,全国人大常委会组成人员认为,异常反应判定原则、补偿标准、各级政府补偿责任等问题,还有待三审稿中明确。
沈阳药科大学国际食品药品政策与法律研究中心主任杨悦此前接受界面新闻采访时表示,草案二审稿虽然明确了异常反应补偿的方向,但仍需进一步完善细化相关制度。她建议,借鉴美国、日本等国的经验,制定我国的《免疫规划疫苗损害补偿表》。
“目前补偿费用是根据省级财政出具,各省收入、生活水平不同,造成补偿标准不统一也很正常。比如说中西部地区卫生财政经费比较少,很难保证异常反应补偿与全国其他城市一致。”南开大学法学院副院长宋华琳认为,国家层面应统一明确补偿范围,包括接种疫苗种类、不良反应症状。他指出,补偿费用涉及到财力、经费来源等问题,比较复杂,不过从国外经验看,这项标准也应该进行全国统一。
实际上,“疫苗安全问题”是否引进惩罚性赔偿的争论由来已久。
有学者认为,为确保惩罚性赔偿金的制裁和遏止功能,不宜在全国统一规定赔偿金额,因各地发展水平不同,如果影响规定惩罚性赔偿金的最高数额,则惩罚性赔偿对某些地区的某些人很难起到制裁和遏制作用。
但也有学者指出,惩罚性赔偿金的数额应有一个明确的限制,否则在国内司法权受各种因素严重干扰的情况下,容易出现随意确定赔偿金等司法不公平现象。
作为《疫苗管理法(征求意见稿)》起草参与者、复旦大学法学院副教授杜仪方认为,国外有很多是通过基金、保险来承担药品的补偿和救济,想疫苗这种尤其具备风险的产品,如果一味地出事就要求企业来承担责任,将会加大企业责任的负担,从而减少其研发的动力。
国内疫苗产业现状分析
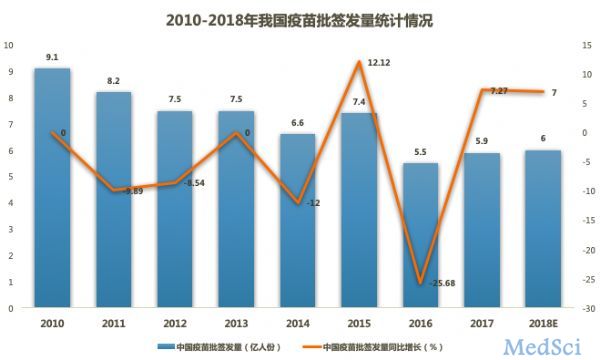
其实,近年来我国疫苗批签发量呈下滑趋势。
据前瞻产业研究院发布的《中国疫苗行业深度调研与投资战略规划分析报告》显示,2010-2017年,中国疫苗批签发量增速波动较大,整体呈现下滑趋势。
可以看出,2017年中国疫苗批签发量为5.9亿人份,较上年有所增加,2018年前三季度,我国疫苗批签发量总计4.27亿人份,9月份增幅明显,行业出现回暖的趋势。预计2018年我国疫苗批签发量将达6亿人份。
按缴费主体分,我国疫苗主要分为一类疫苗和二类疫苗。其中,一类疫苗是指政府免费向公民提供,公民应当依照政府的规定受种的疫苗。二类疫苗指由公民自费并且自愿受种的其他疫苗,费用由接种人员自行承担,接种率相对较低。
目前,在我国疫苗行业中,二类疫苗占主导。2013-2017年,年复合增长率达到4.9%,一类疫苗仅为1.1%。按这样的发展趋势来看,2017年后,二类疫苗仍将快速增长,到2022年,市场规模有望达到59.4亿元,复合增长率将达到26.2% 。
虽然长春长生生物科技有限公司再现疫苗问题,狂犬病疫苗造假,给整个行业带来了严重的负面影响。
但随着行业的回暖,规模将逐渐扩大,产品升级换代(灭活疫苗代替减毒活疫苗、多价多联苗代替单苗)将成为疫苗接种的主旋律。重大流行疾病疫苗研发,癌症疫苗和治疗性疫苗因为巨大的市场潜力,将受到国内企业更多重视,并积极进行有关探索。
(本文综编自:界面新闻、东方财富、前瞻产业研究院)
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#疫苗管理#
67
#疫苗管理法#
64