指南更新:首款口服SERD类药物elacestrant经FDA批准后,火速纳入乳腺癌NCCN(2023.V2)指南!
2023-08-30 e路新干线 e路新干线 发表于上海
2023年1月27日,FDA根据EMERALD研究结果批准首个口服选择性雌激素受体降解剂elacestrant用于既往内分泌治疗后进展的ER阳性、HER2阴性、雌激素受体α基因突变晚期乳腺癌患者。

2023.V2-2023.2.7
乳腺癌
NCCN指南
2023年2月7日,乳腺癌NCCN指南更新至2023.V2,此次更新内容不多,更新依据主要为:2023年1月27日,FDA根据EMERALD研究结果批准首个口服选择性雌激素受体降解剂(SERD)elacestrant用于既往内分泌治疗后进展的ER阳性、HER2阴性、雌激素受体α基因(ESR1)突变晚期乳腺癌患者。详细更新内容如下:
01 主要更新内容
晚期乳腺癌系统治疗:
HER2阴性及绝经后/绝经前接受卵巢切除或抑制
-
其他推荐方案:“一线及后续治疗”修改为“一线和/或后续治疗”
-
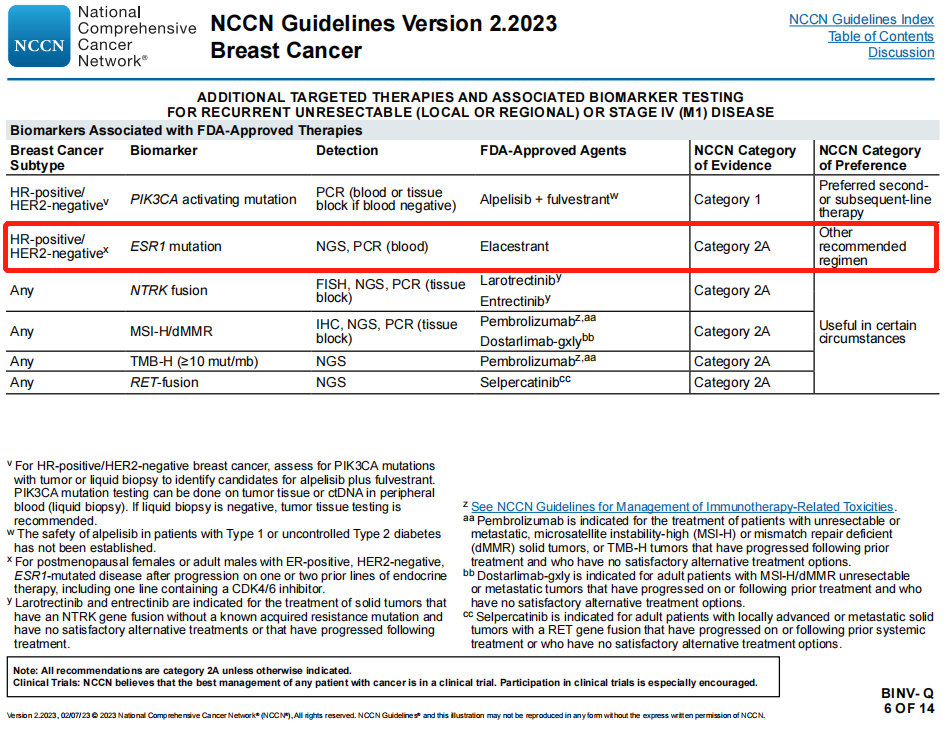
其他推荐方案:“一线和/或后续治疗”方案新增“- 对于ESR1突变肿瘤,见BINV-Q(6)

FDA已批准疗法相关生物学标志物
-
新增“FDA批准的口服SERD药物elacestrant作为其他推荐方案的2A类证据治疗HR阳性、HER2阴性、ESR1突变晚期乳腺癌”
02 EMERALD 研究
EMERALD研究1, 2是一项随机、开放、多中心、Ⅲ期试验。研究共纳入477例既往接受CDK4/6抑制剂治疗的HR阳性转移性乳腺癌患者(包含228例ESR1突变患者),允许既往接受过一线化疗。患者随机接受elacestrant 或内分泌单药治疗。主要终点是所有人群的PFS和ESR1突变人群的PFS。研究达到双主要终点。
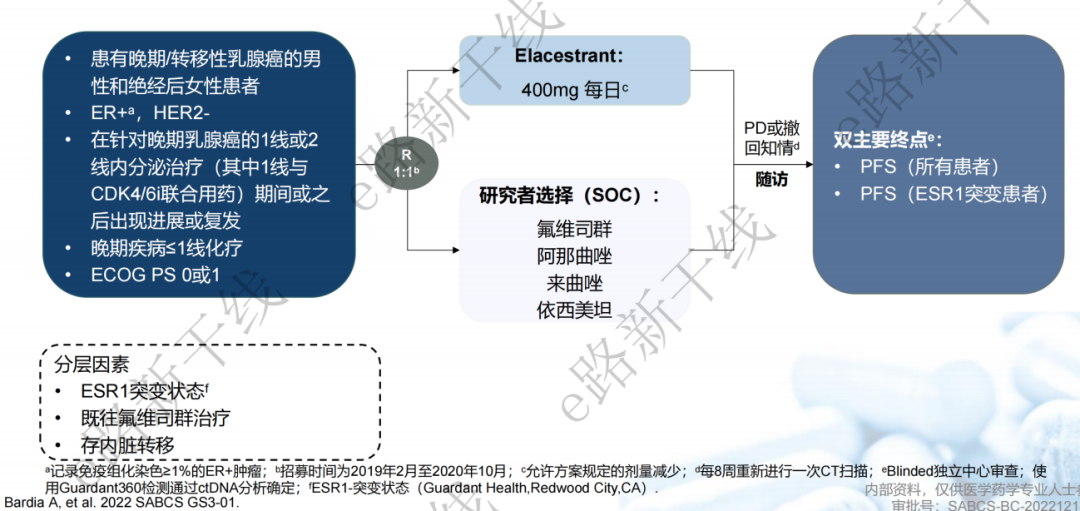
图1:EMERALD研究设计
所有人群及ESR1突变人群中,elacestrant组的PFS均显著优于SOC组(HR=0.70 ,95% CI: 0.55-0.88,双侧P值=0.0018)、(HR=0.55 ,95% CI: 0.39-0.77,双侧P值=0.0005)。
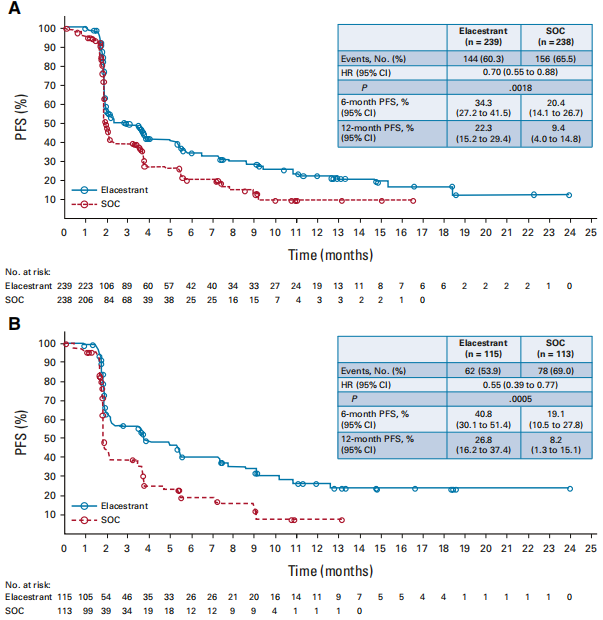
图2:所有人群的PFS(A)和ESR1突变人群的PFS(B)
03 总结
口服SERD靶向药的研发道路可谓是布满荆棘,2022年,许多口服SERD靶向药研究遇到阻碍,但相信elacestrant经FDA获批上市同时纳入NCCN指南给了大家一针强心剂,表明在ER阳性乳腺癌治疗领域仍有新的有效靶向疗法的可能性。
elacestrant此次纳入NCCN指南将填补目前ER阳性、HER2阴性、ESR1突变晚期乳腺癌后线治疗的空缺,同时也为CDK4/6抑制剂耐药患者提供了一种安全有效的治疗方式,进一步丰富了内分泌耐药乳腺癌患者的诊疗格局。
参考文献:
1. Bardia A, et al. 2022 SABCS GS3-01.
2. Bidard FC, et al. J Clin Oncol. 2022 Oct 1;40(28):3246-3256.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











