读书报告 | 靶向DLL3和CD3+T细胞的双特异性Tarlatamab治疗复发性小细胞肺癌的I期临床研究
2023-10-27 iCombo iCombo 发表于上海
DeLLphi-300研究是一项国际多中心、开放标签的I期临床研究,旨在评估双特异性T细胞衔接蛋白Tarlatamab用于复发或难治性小细胞肺癌的安全性、耐受性以及疗效。
导读
DeLLphi-300研究(NCT03319940)是一项国际多中心、开放标签的I期临床研究,旨在评估双特异性T细胞衔接蛋白Tarlatamab用于复发或难治性小细胞肺癌(SCLC)的安全性、耐受性以及疗效。这是Tarlatamab的首次人体试验。
研究设计:入组了剂量探索队列(包括73例患者,0.003-100mg )和剂量扩展队列(34例患者,100mg),这些患者既往接受过中位治疗线数为2的治疗,其中49.5%患者接受过抗PD-1/L1 抑制剂治疗。主要终点是安全性,次要终点包括修改后的RECIST 1.1的抗肿瘤活性、总生存期和药代动力学。
研究结果:截至2022年7月19日,97名患者(90.7%)发生任何级别的治疗相关不良事件,33名患者(30.8%)发生3级不良事件。一名患者(1%)患有5级肺炎。细胞因子释放综合征是最常见的治疗相关不良事件,发生在56名患者(52%)中,其中1名患者(1%)发生3级不良事件。未达到最大耐受剂量。
客观缓解率ORR为23.4%,包括2例完全缓解CR和23例部分缓解PR。中位缓解持续时间DOR为12.3个月,疾病控制率DCR为51.4%。中位无进展生存期PFS和总生存期OS分别为3.7个月和13.2个月。探索性分析表明,选择增加DLL3表达可以增加临床益处。
结论:在接受过多线治疗的SCLC患者中,tarlatamab 表现出可控的安全性和令人鼓舞的反应持久性(J Clin Oncol.2023;41(16):2893-2903. doi:10.1200/JCO.22.02823)。
背景
小细胞肺癌(SCLC)是一种难治、预后差的肺癌亚型,约占肺癌的15%,其特征是快速生长和早期扩散,绝大多数(>70%)患者在诊断时已经处于IV期或广泛期(ES)。ES-SCLC 3年生存率为6%。
ES-SCLC的标准一线化疗方案为铂类(卡铂或顺铂)联合依托泊苷。但无进展生存期(PFS)低于6个月,总生存期(OS)在8-10个月左右。
在化疗基础上联合免疫治疗atezolizumab或durvalumab,随后单用检查点抑制剂作为SCLC的一线维持治疗,可使死亡风险降低约30%。
对于大多数复发的SCLC患者,可用的治疗方法有限。拓扑替康是全球使用最广泛的二线治疗药物,其疗效有限且安全性较差。
Lurbinectedin于2020年成为20多年来FDA第一个批准用于二线治疗的药物,基于35%的客观缓解率(ORR)获得批准;然而,一项随机研究未能证明OS获益。
没有药物被专门批准用于复发性SCLC的三线治疗。
双特异性T细胞衔接蛋白(BiTE)是近几年广受关注的一类双特异性抗体类型,它利用两端将两种不同细胞连接在一起,使他们之间产生相互作用。如果其中一端与T细胞表面的受体(如CD3或CD28)结合,另一端连接肿瘤细胞,则有助于将T细胞募集到肿瘤细胞附近,从而杀伤肿瘤细胞。
Notch信号通路是SCLC中神经内分泌分化的调节因子。δ样典型Notch配体3( DLL3)在高达85%的SCLC细胞表面异常表达,在正常组织中表达极少。体外SCLC模型表明DLL3在促进肿瘤生长、迁移和侵袭中的作用。
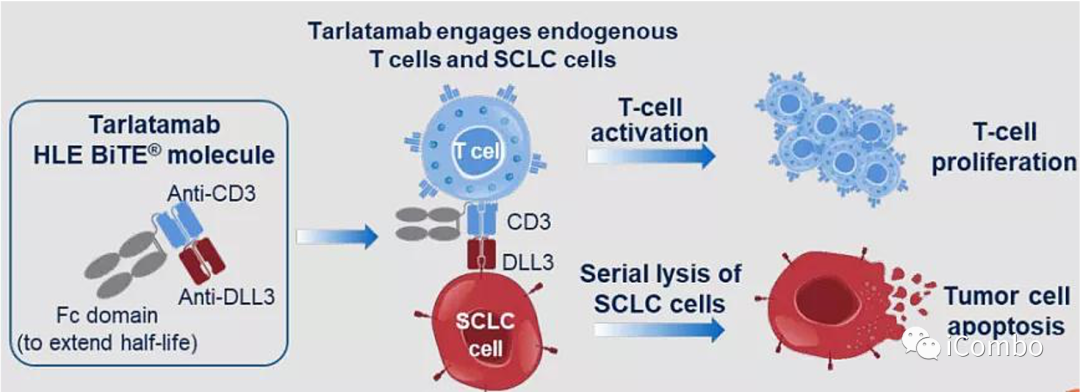
Tarlatamab是一种半衰期延长的双特异性T细胞衔接蛋白(BiTE),可结合癌细胞上的DLL3和T细胞上的CD3,将T细胞募集到小细胞肺癌细胞附近,激活T细胞杀伤肿瘤细胞,促进肿瘤的消退。
方法
这是一项国际多中心、开放标签I期临床研究(登记号:NCT03319940),旨在评估Tarlatamab(AMG757)用于复发或难治性SCLC安全性、耐受性以及疗效。
该研究入组了剂量探索队列(73例患者,0.003-100mg)和剂量扩展队列(34例患者,100mg),这些患者既往接受过中位治疗线数为2的治疗,其中49.5%患者接受过抗PD-1/L1抑制剂治疗。
纳入标准主要为:年龄在 18 岁或以上、接受≥1线含铂化疗(如果符合标准治疗适应症,包含PD-L1抑制剂)后出现疾病进展/复发、ECOG:0~2、至少有两个可测量病灶(根据修订的实体瘤疗效评估标准(RECIST)1.1 版定义),以及治疗后临床和放射学稳定的脑转移瘤(如果存在)。
关键排除标准:未经治疗的脑转移以及先前免疫治疗期间严重或复发的免疫介导的不良事件(AE)或输注相关反应。
主要终点是安全性和耐受性以及确定最大耐受剂量(MTD),
次要终点包括抗肿瘤活性、总存活率和药代动力学。
这项研究招募了107名患者,数据收集和分析一直持续到2022年7月19日。
安全性指标
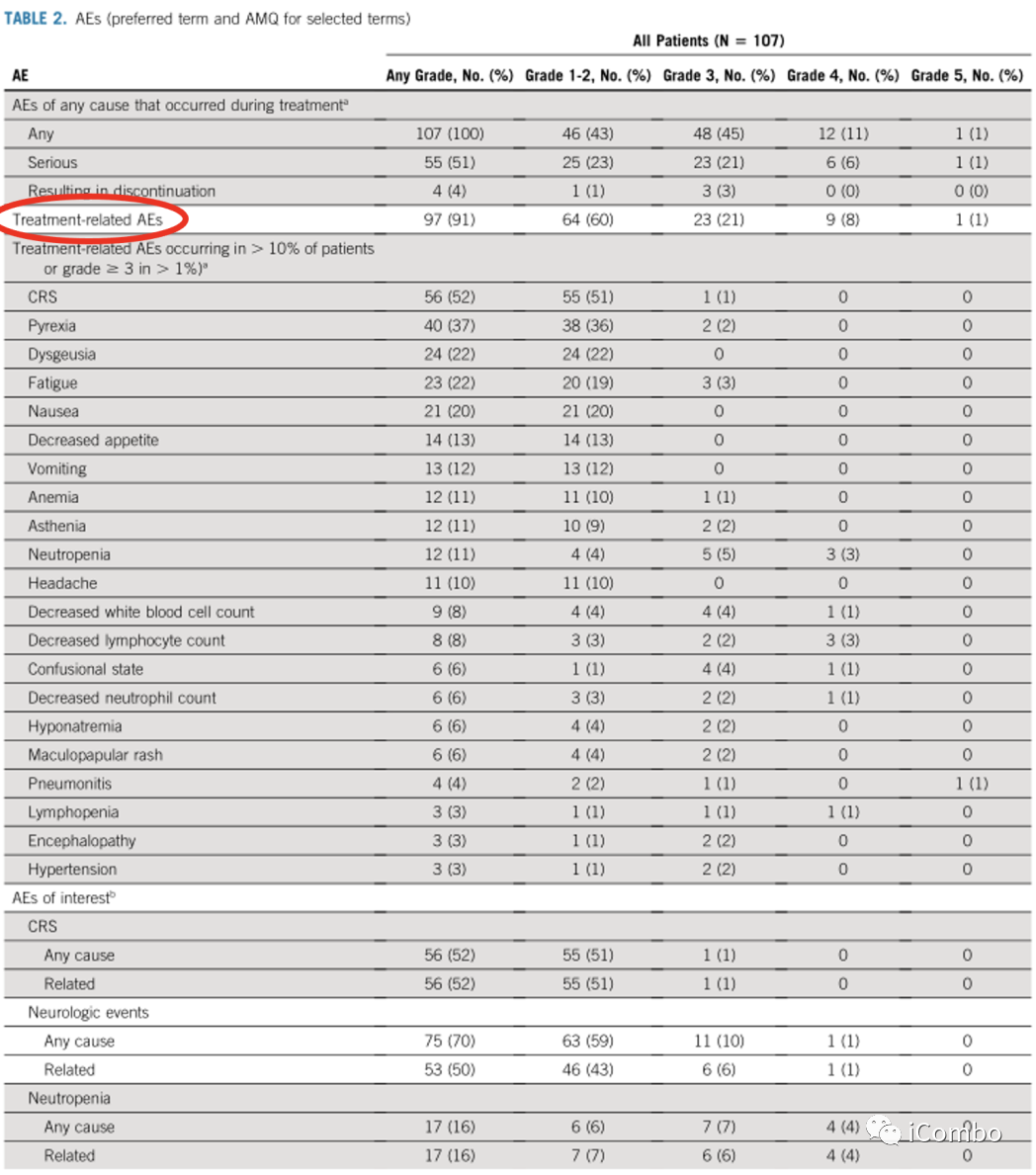
在所有剂量中(N=107),仅4名(3.7%)患者停药。
任意级别治疗相关不良事件(TRAE)发生率为 90.7%,≥3级 TRAE 发生率为30.8%;最常见的 TRAE 为细胞因子释放综合征(CRS),(CRS)AEs大多为1级,且发生在第1周期,在后续周期中很少复发,一般都是可控的。未发生4/5级CRS AEs。
治疗相关神经系统事件(NEs)也主要为1级,味觉障碍(29.0%)、头痛(19.6%)和头晕(10.3%) 最常见。
有效性指标
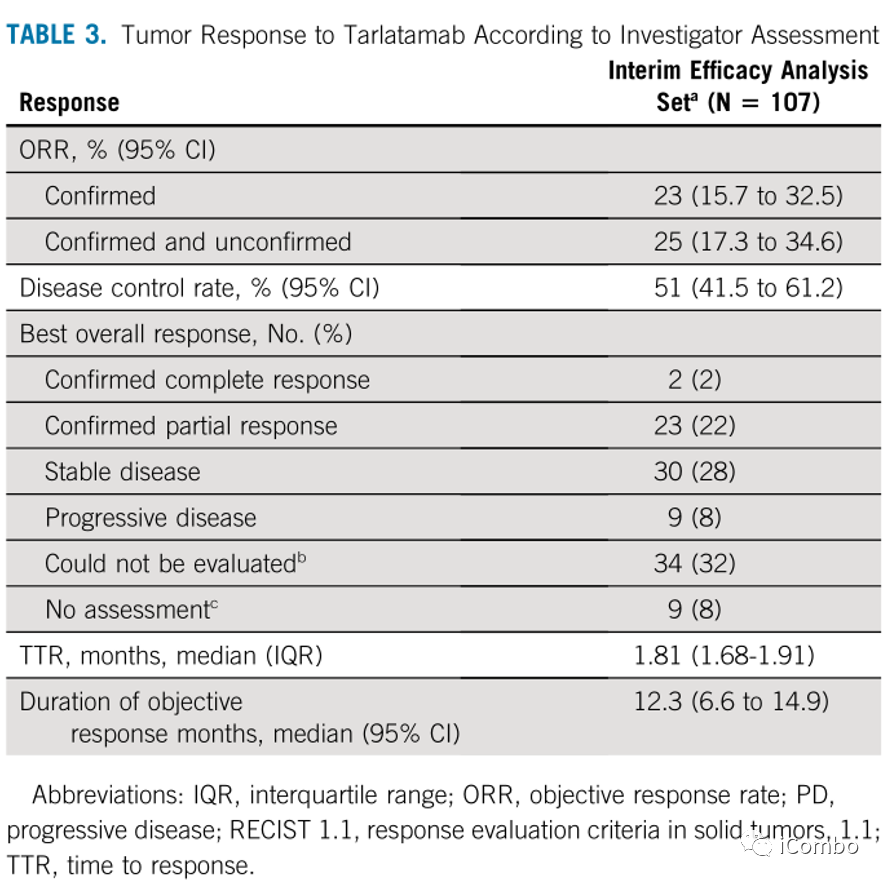
研究者基于改良RECISTv1.1评估药物的抗肿瘤活性,包括2例完全缓解CR和 23 例部分缓解PR。
确认患者的客观缓解率ORR 为 23.4%(95% CI,15.7 至 32.5)
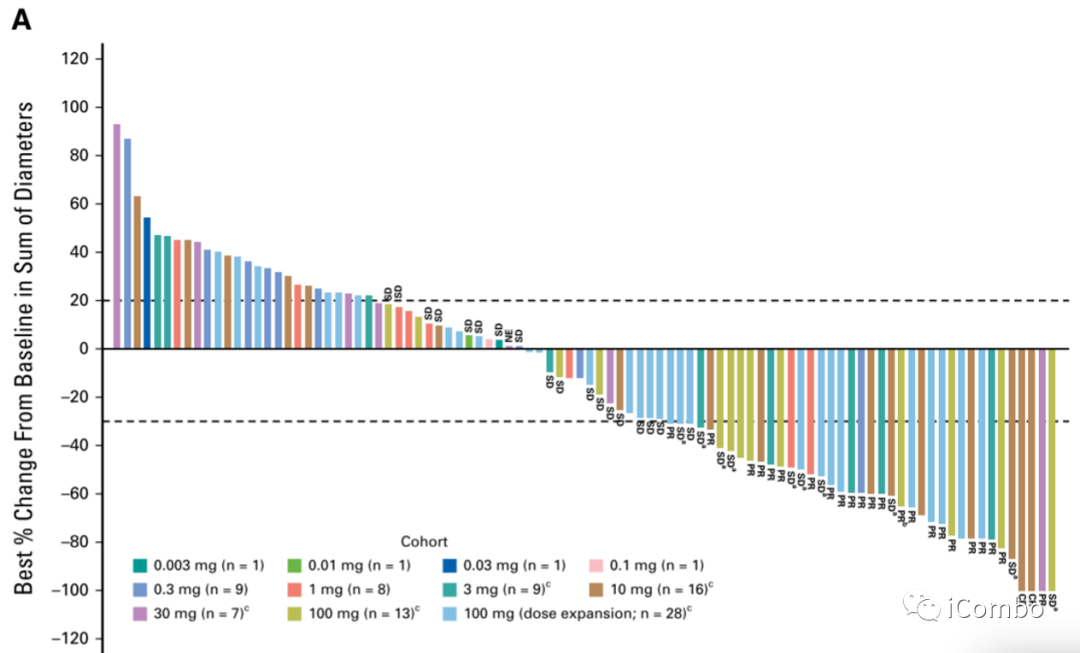
对 tarlatamab 的反应。(A)94 名患者的肿瘤负荷相对于基线的最佳百分比变化(由所有目标病灶的最长直径之和定义),这些患者的数据截止日期为首次给药日期后至少9周,并且可获得基线后肿瘤数据。100mg 扩展队列中的一名确诊患者缺少用于病变测量的直径总和,因此未包含在图中。这些队列中使用了阶梯给药。CR,完全缓解;NE,不可评估;PR,部分缓解;SD,疾病稳定。
图A显示了不同剂量的临床活性,可以看到在许多剂量水平上都能看到抗肿瘤活性, 一般在 3 mg 及以上剂量时观察到较高的反应率。39 名患者 (36.4%)靶病灶缩小≥30%。
疾病控制率DCR为51.4(95% CI,41.5至61.2)。
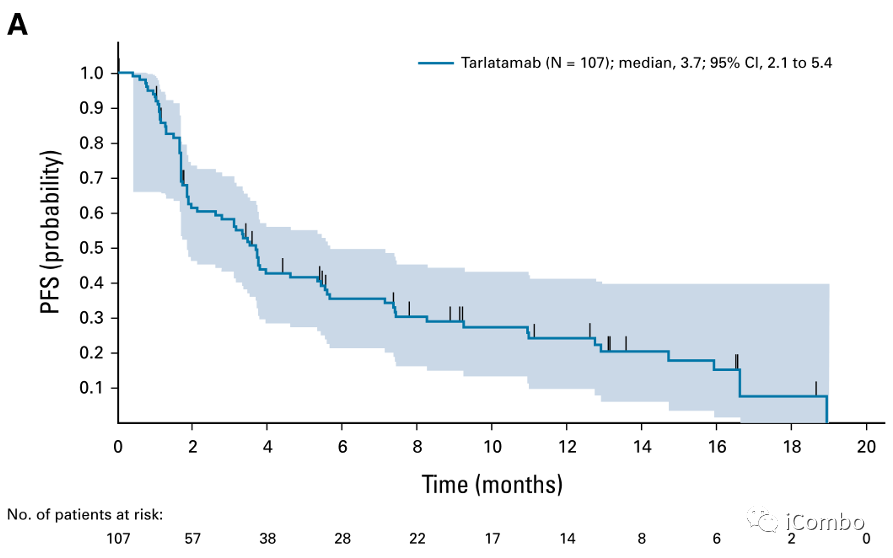
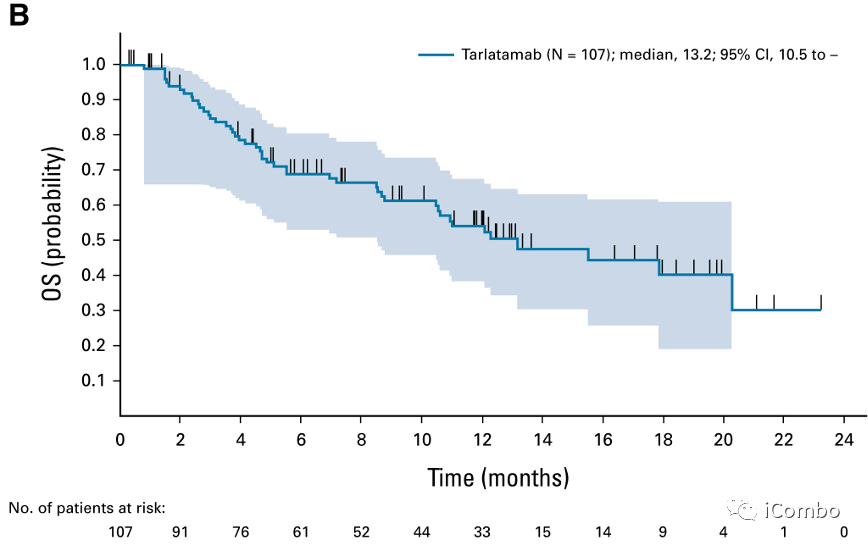
Tarlatamab对 SCLC 患者的疗效。(A)数据截止日期为首次给药日期后至少 9 周的患者(N=107)的PFS Kaplan-Meier 曲线。(B)数据截止日期为首次给药日期后至少 9 周的患者的 OS Kaplan-Meier 曲线(N=107)。PFS,无进展生存期;OS,总生存期;SCLC,小细胞肺癌。
中位 PFS 为 3.7 个月(95% CI,2.1 至 5.4)
中位 OS 为 13.2 个月(95% CI,10.5 至 NE)
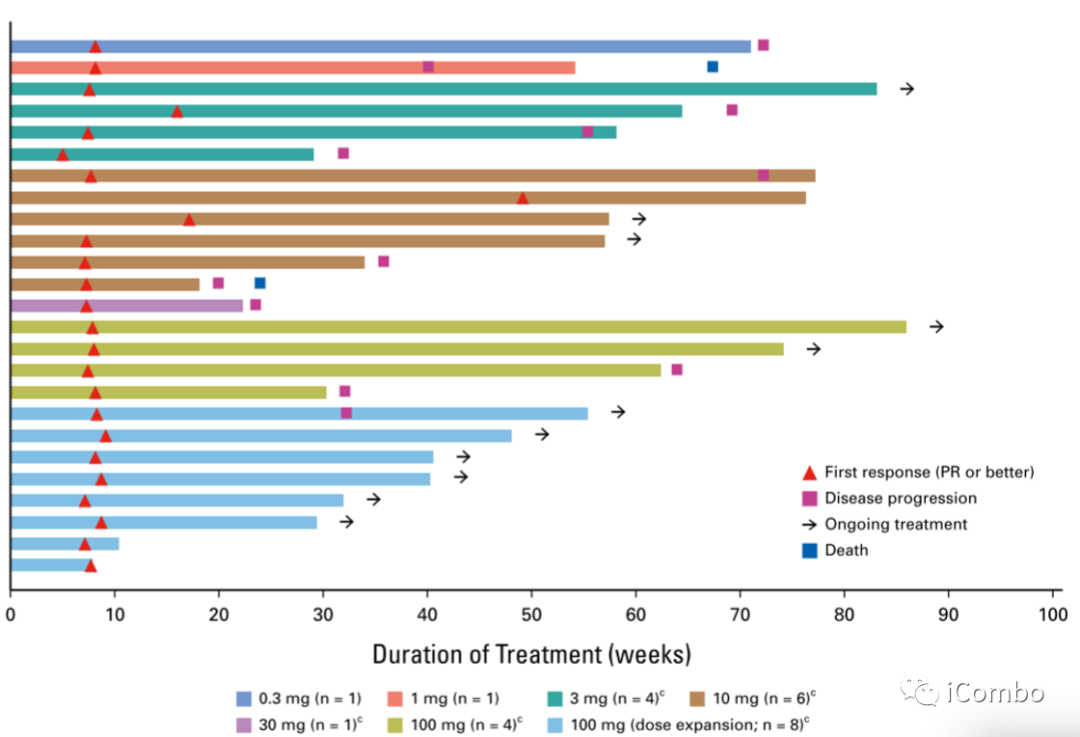
根据所有已确认缓解的患者(n=25)的tarlatamab 剂量,TTR、治疗持续时间和截至数据截止日期的患者状态。TTR,响应时间。
Tarlatamab在既往接受过治疗的SCLC患者中可提供持久缓解,已确认的缓解者中,中位至首次缓解时间为 1.8 个月(范围为 1.2-7.4)。
中位缓解持续时间DOR 为 12.3 个月(95% CI,6.6 至 14.9)
结论
这项I期研究评价了Tarlatamab单药治疗复发性/难治性SCLC患者的效果,在既往经多线治疗的SCLC患者中,Tarlatamab在广泛的靶剂量范围内显示出良好的抗肿瘤活性和缓解持续时间,且安全性可控。
尽管中位 PFS(3.7 个月)相对较短,但中位OS(13.2 个月)与目前可用于复发性SCLC的其他疗法相比表现良好。
该文章为tarlatamab作为复发性/难治性SCLC患者治疗选择的潜力提供了重要见解。这一I期研究的结果为在后期研究中进一步评估这种有前途的治疗方法铺平了道路。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








