专题笔谈:急性失代偿性心力衰竭患者低钠血症的处理
2022-09-29 中国医学论坛报今日循环 中国医学论坛报今日循环
AVP受体拮抗剂:AVP受体拮抗剂作用于肾集合管的水通道蛋白,直接促进自由水排泄。多个临床研究证明了AVP受体拮抗剂对ADHF合并低钠血症患者的有效性。
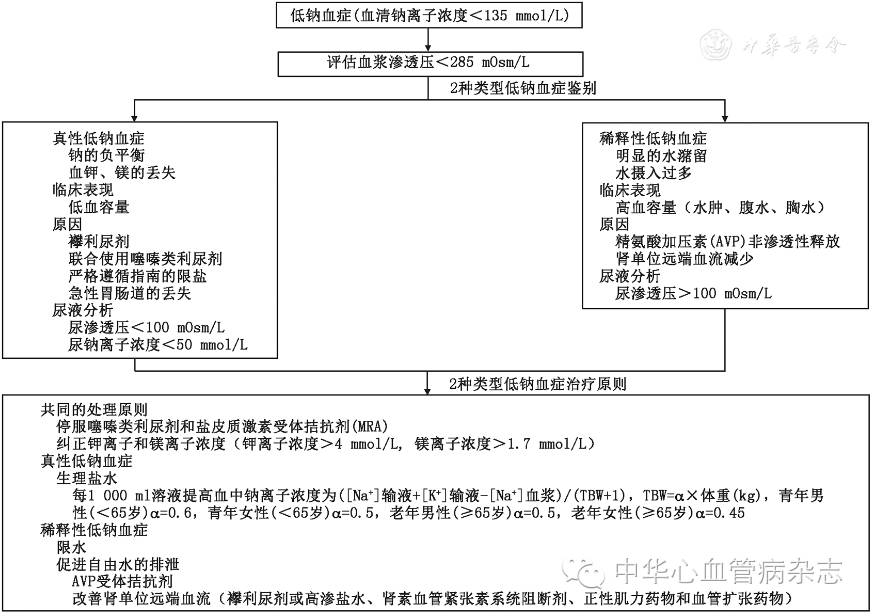
临床上将血浆钠离子的浓度低于135 mmol/L定义为低钠血症[1],是心力衰竭(心衰)患者较为常见的电解质紊乱。20%~30%的急性失代偿性心衰(acute decompensated heart failure,ADHF)患者可发生低钠血症[2],使得ADHF的治疗更为棘手。研究证实低钠血症是ADHF和慢性心衰患者预后不良的独立危险因素[2],可延长住院时间,增加病死率。心衰患者的低钠血症从病理生理的角度可分为2类,真性低钠血症和稀释性低钠血症,排钠利尿剂的广泛应用,给二者的鉴别诊断带来了困难。临床医师首先需要鉴别出这2种类型的低钠血症,然后以病理生理学为基础,采取不同的处理方案才能改善预后。本文着重阐述心衰患者低钠血症发生机制和治疗方法。
一、ADHF患者低钠血症的病理生理机制
稀释性低钠血症(高容量性低钠血症)是ADHF的常见类型,多数为机体不能排除足量的水,容量负荷增加,血液稀释所致,不是真正的缺钠[3]。精氨酸血管加压素(AVP)非渗透性释放增加和肾单位远端血流减少是导致ADHF患者水潴留的主要原因[4]。
AVP非渗透性分泌增加:AVP又称抗利尿激素(ADH),是一种多肽激素,作用在肾脏远曲小管和集合管细胞膜上的V2受体(AVPR2),可活化水通道蛋白2,增加集合管水的再吸收,大剂量时作用在肝脏细胞、集合管、直小血管上的V1a受体(AVPR1a),造成肝脏尿素合成增多,肾髓质渗透压上升,集合管水的重吸收增加。血液渗透压上升,可刺激视上丘渗透压感受器,促进AVP的合成,自由水再吸收增加。研究表明,心衰患者血浆中AVP的浓度升高[5,6,7],同时在充血性心衰小鼠动物模型中,肾单位集合管上皮的水通道蛋白表达明显上调[8],这将提高ADHF患者肾集合管水的通透性,可能与ADHF患者自由水重吸收的增强及稀释性低钠血症有关。ADHF患者有效血容量的降低,激活了左心房、主动脉弓、颈动脉窦压力感受器,交感神经系统及血管紧张素Ⅱ,导致了非渗透性AVP分泌增加,同时也提高了渗透性AVP分泌的敏感性。ADHF患者血浆AVP水平随着渗透负荷增加而明显上升[9],这是由于AVP渗透性释放的增加与血清渗透压的微小变化呈直线相关[10],但AVP非渗透性释放呈指数级增加[11]。除此之外,ADHF引发的肝肾功能不全,导致AVP降解障碍,进一步增加AVP。
远端肾单位肾小管血流减少:正常肾脏可将尿液的渗透压稀释到30~60 mOsm/L,明显低于正常血浆渗透压[12]。尿液的稀释主要依靠肾单位远端的远曲小管和集合管。在肾单位的远曲小管和集合管处,排除自由水的同时通过噻嗪敏感的钠/氯转运蛋白和醛固酮敏感的钠通道(ENaCS)将原尿中的钠离子重吸收[13]。如果肾单位远端肾小管血流减少,ENaCS重吸收钠的功能将减弱[14]。如果过多的钠离子潴留在肾小管液中,自由水的排泄则会受到限制。因此,肾脏排除体内多余的自由水,一方面依靠肾远曲小管和集合管的充足血流,另一方面抑制AVP释放,降低肾远曲小管和集合管对水的通透性。
真性低钠血症(缺钠性低钠血症、低血容量性低钠血症)的发生较为少见,对于严格按指南限盐饮食的慢性心衰患者,在急性失代偿期,大剂量襻利尿剂使用(125~500 mg,每日2次)容易造成钠负平衡,导致真性低钠血症。常见以下几种情况:(1)襻利尿剂导致的低钠血症。
ADHERE[15]研究表明,88%的ADHF患者服用襻利尿剂,而对于没有容量负荷增加的心衰患者,70%服用襻利尿剂作为维持治疗。襻利尿剂通过抑制髓襻升支粗段Na+,K+–2Cl–共同转运载体,不但抑制了尿液的稀释过程,而且使得髓质的高渗无法维持,抑制了肾对尿液的浓缩过程,从而排出大量低渗尿,所以利尿排钠作用强大。但是随着容量负荷的耗竭和神经内分泌激素的激活及肾血流的减少,襻利尿剂的效果逐渐减弱。最终,肾小球滤过率和肾远端血流减少激活了AVP,进一步加重低钠血症。(2)其他利尿剂导致的低钠血症。盐皮质激素受体拮抗剂(MRA)是治疗射血分数保留的心衰(HFrEF)的基石[16],出现襻利尿剂抵抗时,噻嗪类利尿剂常作为一线用药。噻嗪类利尿剂和醛固酮受体拮抗剂作用在远曲小管和集合管的钠泵(ENAC)和钠/氯转运蛋白,干扰钠重吸收,甚至在没有明显低血容量时发生低钠血症。(3)血钾及镁的缺失加重低钠血症。襻利尿剂和噻嗪类利尿剂均可引起ADHF患者钾镁丢失,体内缺钾会影响钠的重吸收,助力低钠血症发生。重吸收进入肾小管壁细胞内的钠离子可通过钠钾ATP酶主动转运至组织间液,而镁是钠钾ATP酶发挥作用的关键离子,因此低镁血症也可加重细胞外钠的耗竭。(4)非尿钠丢失增加。心衰患者肝脏、胃肠道淤血,胃肠道功能下降可导致腹泻、腹水引起钠吸收受限。同时,ADHF可引发腹水、胸水、心包积液等多浆膜腔积液,第三间隙体液丢失常伴随钠丢失,加重低钠血症。
二、ADHF患者低钠血症的处理(图1)
图1 急性失代偿性心力衰竭患者治疗流程
要处理ADHF患者低钠血症,首先必须分清是真性低钠血症还是稀释性低钠血症。胃肠道或第三间隙液的大量丢失病史,低血容量临床表现,近期大剂量或联合的利尿剂治疗,常提示真性低钠血症。另外,可通过输注24 h等渗盐水来鉴别,真性低钠血症患者血钠会逐渐正常,而稀释性低钠血症由于自由水不能清除,低渗尿产生受阻,低钠反而会更严重。
1.真性低钠血症的处理:
单纯的真性低钠血症可通过输注盐水纠正。高张盐水纠正真性低钠血症的速度比等张盐水快,并且输注的液体总量较少。对于轻度真性低钠血症,每天提高钠离子的最大浓度不应该超过5 mmol/L,对于重度真性低钠血症,血浆中钠离子浓度<125 mmol/L,若有低钠血症的临床表现,钠离子的纠正速度可以达到每天10 mmol/L[17],24 h钠离子的纠正速度超过10 mmol/L时容易引起脑桥脱髓鞘病变,应该注意避免。同时,在纠正低钠血症过程中,应考虑镁钾的补充。补钾有助于加快缓解低钠血症[18]。每日血浆钠离子浓度的提高可以通过公式[19]获得,即([Na+]输液+[K+]输液–[Na+]血浆)/(TBW+1),[Na+]为钠离子浓度(mmol/L),[K+]为钾离子浓度(mmol/L),TBW为体液总量,TBW=α×体重(kg),青年男性(年龄<65岁)α=0.6,青年女性(年龄<65岁)α=0.5,老年男性(年龄≥65岁)α=0.5,老年女性(年龄≥65岁)α=0.45。例如一个体重62 kg,年龄50岁的女性患者血浆钠离子浓度为130 mmol/L,血浆钾离子浓度为3.5 mmol/L,由于患者每日服用呋塞米120 mg并且体格检查未见容量负荷增多的体征,初步诊断为真性低钠血症,补充液体为0.9%的氯化钠注射液(钠离子浓度为154 mmol/L)和10%氯化钾注射液(但通常临床补钾时钾离子浓度最高为40 mmol/L),则每天血浆钠离子浓度提高2 mmol/L[(154+40–130) mmol/L]/ (0.5×62+1)],但是如果不补充钾离子,则每天血浆钠离子浓度仅提高0.75 mmol/L[(154–130 mmol/L)/(0.5×62+1)]。
2.稀释性低钠血症的处理:
治疗ADHF患者稀释性低钠血症的关键是促进自由水的排除和改善远端肾单位的血供。
襻利尿剂联合高渗盐水:髓襻类高效利尿药通过抑制髓襻升支粗段钠离子的重吸收,抑制尿液的稀释过程,并且使髓质高渗无法维持,抑制了肾对尿液的浓缩过程,从而排出大量自由水。因此髓襻类利尿药是ADHF合并稀释性低钠血症和容量负荷增加患者的一线用药。几个小型研究表明,襻利尿剂合并高渗盐水的使用可更有效改善ADHF合并稀释性低钠血症患者的容量负荷,对ADHF患者的肾功能起到保护作用,重要的是可以降低ADHF患者血浆中肾素、炎性介质和B型利钠肽的水平[20,21]。
AVP受体拮抗剂:AVP受体拮抗剂作用于肾集合管的水通道蛋白,直接促进自由水排泄。多个临床研究证明了AVP受体拮抗剂对ADHF合并低钠血症患者的有效性[22,23,24,25]。目前口服的V2受体拮抗剂有托伐普坦和沙他伐坦,静脉应用的有盐酸考尼伐坦。EVEREST研究入选了4 133例ADHF患者,发现与安慰剂治疗组比较,托伐普坦治疗组的心衰患者全因死亡率及再入院率并没有明显改善,但是亚组分析发现,托伐普坦可明显改善ADHF合并低钠血症(钠离子浓度<130 mmol/L)患者的再入院率和心血管死亡率[25]。
限水:对于稀释性低钠血症的ADHF患者,指南明确规则限制水的摄入[26],每日应<1 000 ml,但是患者长期依从性较差。有研究表明,对于ADHF合并轻度低钠血症患者,严格限水可改善患者的生活质量[27]。
肾素血管紧张素系统阻断剂:肾素血管紧张素系统阻断剂可改善肾血流,同时降低近端肾小管对钠离子的重吸收。因此,对于ADHF合并低钠血症的患者,可应用肾素血管紧张素系统阻断剂,而且在不合并肾功能不全的情况下,应逐渐上调剂量,尽量到达指南推荐的目标剂量。
正性肌力和血管扩张药:从病理生理学的角度来看,提高心衰患者有效循环血量可减少非渗透性AVP释放、改善肾血流,利于纠正稀释性低钠血症。根据Frank–Starling定律,ADHF患者的心输出量对心脏前负荷的改变已经非常不敏感,只有通过正性肌力药物对心肌直接刺激及通过血管扩张药减少后负荷,才能提高ADHF患者的心输出量。但是正性肌力药物可增加心衰患者的病死率,降低后负荷可能是增加ADHF患者有效循环量的最佳选择。然而,临床实践中ADHF患者动脉压偏低也限制了血管扩张药的使用。研究表明,应用硝普钠、肼苯哒嗪和硝酸盐可改善ADHF患者预后[28]。
总之,ADHF低钠血症的病理生理机制非常复杂,临床处理首先需要根据详细的病史、体格检查以及实验室结果来综合鉴别稀释性低钠血症和真性低钠血症,这一点非常重要。以病理生理学为基础的治疗策略,可提高治疗的有效性,并且有效避免药物的不良反应。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言