缺氧真的是导致癌细胞不断肆虐的元凶?
2017-04-25 生物谷 生物谷
1955年,研究者Thomlinson等人在对来自肺癌患者的肿瘤组织进行研究时首次提出肿瘤缺氧的观点,随后科学家们经过60多年临床和实验证实,缺氧状态是多种实体瘤中广泛存在的一种特质,而且缺氧这种特征与肿瘤的增殖、分化、血管生成、能量代谢以及癌症的耐药性发生、患者预后较差密切相关。 很多研究人员认为缺氧是癌细胞不断得以繁衍的一个关键因素,而且缺氧还会让肿瘤细胞的恶性程度不断增加,近日

1955年,研究者Thomlinson等人在对来自肺癌患者的肿瘤组织进行研究时首次提出肿瘤缺氧的观点,随后科学家们经过60多年临床和实验证实,缺氧状态是多种实体瘤中广泛存在的一种特质,而且缺氧这种特征与肿瘤的增殖、分化、血管生成、能量代谢以及癌症的耐药性发生、患者预后较差密切相关。
很多研究人员认为缺氧是癌细胞不断得以繁衍的一个关键因素,而且缺氧还会让肿瘤细胞的恶性程度不断增加,近日,刊登在国际著名杂志Science上的一篇研究报告就发表了哈佛医学院的最新研究发现,文章中,研究者提出了缺氧与肿瘤细胞行为之间的最新关联性;那么缺氧是否真的会让癌细胞不断肆虐?是否真的会促进癌症不断恶化呢?本文中小编就对相关研究报道进行了整理,分享给各位!
【1】Cell Metabol:癌细胞如何在缺氧环境下继续疯狂生长
doi:10.1016/j.cmet.2013.11.022
近日,来自俄亥俄州立大学的研究人员通过研究揭示了一种新型的分子路径,该分子路径可以使得癌细胞在氧气含量较低(缺氧状况)的肿瘤组织中依然存活生 长,这对于开发逆转缺氧相关路径从而来抑制肿瘤生长的新型制剂提供了新的思路,相关研究成果刊登于国际著名杂志Cell Metabolism上。
文章中,研究者揭示了癌细胞如何使用氨基酸-谷氨酰胺,其是一种在血液中常见的游离氨基酸;低于正常氧气含量水平时,健康的细胞会大量使用谷氨酰胺来产生能量,其中有很少量的谷氨酰胺转化成为脂肪酸和脂质。
但当氧气含量在生长中的肿瘤中下降时,缺氧状况就会激活一种名为HIF1的基因,从而开启一种路径,这种路径并不会将谷氨酰胺转化成能量,而会合成 细胞增殖所需的脂质;Nicholas Denko博士指出,谷氨酰胺的代谢是抗癌疗法的一个新型靶点,肿瘤细胞需要谷氨酰胺来生长,因此我们必须尽快鉴别出阻断谷氨酰胺代谢的药物从而抑制肿瘤 生长;然而完全阻断谷氨酰胺代谢的药物往往会带来有害的副作用,因为谷氨酰胺也是一种重要的神经递质。

【2】PNAS:缺氧诱导因子介导乳腺癌细胞RhoA-ROCK1表达
doi:10.1073/pnas.1321510111
近日,约翰霍普金斯大学生物学家发现,肿瘤细胞处于低氧条件下,足以引发分子事件链,将乳腺癌细胞从“僵化”状态转化到移动和入侵状态。相关研究论文发表在PNAS杂志上,强调了缺氧诱导因子在促进乳腺癌转移的重要性。
高水平RhoA和ROCK1通过赋予癌细胞移动能力恶化乳腺癌患者治疗结果,但触发他们生成的机制是一个谜,Gregg Semenza表示:我们现在知道,当乳腺癌细胞暴露在低氧条件下时,这些蛋白生成急剧增加。
为了要移动,癌细胞必须改变其内部结构,Semenza说,然后,细胞形成尾足以及细胞的“手”出现,使细胞“抓住”外表面,进行移动。蛋白RhoA和ROCK1已知是这些结构形成的核心。此外,编码RhoA和ROCK1的基因以高水平在转移性乳腺癌细胞中被打开。
在一些情况下,这些蛋白水平的增加可以追溯到控制蛋白质的基因发生了错误。Semenza说,他和他的团队搜寻引发他们高水平的另一个原因。研究表明,低氧条件下,缺氧诱导因子提高RhoA和ROCK1的生成。
【3】Cancer Res:癌细胞缺氧导致癌症生长和转移机制
doi: 10.1158/0008-5472.CAN-11-3666
当缺氧时,肿瘤似乎应当缩小。然而,大量研究已证实肿瘤缺氧,即肿瘤部分区域含有极低浓度的氧气,的确与更加侵袭性的肿瘤行为和更差的预后相关联。这似乎表明肿瘤不会屈服于缺氧,相反肿瘤过量增加血液供应,因而经常会导致缺氧,从而给肿瘤发送生长和转移的信号以便寻找新的氧气源。比如,缺氧性膀胱癌可能转移到肺部,而这经常是致命性的。
在一项刊登在Cancer Research期刊上的最新研究中,美国科罗拉多大学癌症中心研究人员在详细地描述了这些缺氧条件导致侵袭性癌症产生的机制。
【4】Cancer Cell:揭秘缺氧引发肿瘤变得恶性的分子机制
doi:10.1016/j.ccell.2016.07.004
肿瘤之所以难以治疗,其中一个主要的原因就是肿瘤细胞会不断适应其所处的不良环境,缺氧就是其中一种不良环境,其会削弱肿瘤的功能,但相反,恶性肿瘤细胞往往能够进行补偿过程并且驱动后期更加恶性疾病行为的发生。近日,刊登于国际杂志Cancer Cell上的一项研究报告中,来自宾夕法尼亚大学威斯达研究所(Wistar Institute)的科学家通过研究鉴别出了一种新型机制,该机制可以在缺氧肿瘤组织中选择性地发挥作用,从而帮助肿瘤细胞在缺氧状态下继续生长增殖。
文章中研究者发现,这种通路的激活可以导致神经胶质瘤患者疾病预后较差,因此该通路或可作为研究者开发新型癌症疗法的新靶点。研究者Altieri说道,缺氧是恶性肿瘤生长几乎非常普遍的一个标志,然而截止到目前为止,研究者并未找到引发肿瘤在缺氧状态下出现恶性病变行为的通路。这项研究中研究者就发现了一种新型通路,其不仅可以让肿瘤细胞生存,而且还能够让肿瘤细胞在缺氧状况下继续分裂;从本质上来讲,这或许可以帮助阐明为何肿瘤细胞在恶劣环境下依然能够继续生长分裂。
doi:10.1038/ncomms6582
当缺乏氧气(缺氧)时,健康细胞成长受到限制。但令人惊奇的是,缺氧是恶性肿瘤的特征。在Nature Communications杂志上发表的新研究中,研究人员揭示了癌细胞症如何成功规避缺氧生长抑制。
人们早已知道,PHD蛋白质(脯氨酰羟化酶域蛋白)在缺氧调控过中起到关键作用。它们控制低氧诱导的转录因子(HIFs)的稳定性,HIFs支配细胞适应缺乏氧。
现在研究发现一种特殊的PHD蛋白质PHD3还控制了表皮生长因子受体(EGFR)。在健康的细胞中,PHD3通过刺激表皮生长因子受体进入到癌细胞内部,响应应激如氧气不足。

doi:10.1172/JCI66715
近日,北卡罗莱纳大学研究人员已经发现,调节血液中氧气水平的转录因子在皮肤癌黑色素瘤的蔓延也发挥了重要作用。
研究发表在4月8日的Journal of Clinical Investigation杂志上,研究小组发现黑色素瘤转移与一对转录因子HIF1和HIF2有关。在黑色素瘤中,HIF1和HIF2过度表达。
在健康的细胞中,HIF1和HIF2协助调节缺氧状态,造成血液中的氧气含量偏低。缺氧已经被证实与几类肿瘤发生与转移相关,团队已经发现它可以促进黑色素通过淋巴系统蔓延从皮肤转移到体内其他部位。
被诊断出患有早期黑色素瘤的患者有很高的存活率,但一旦肿瘤扩散到整个身体的其他部位,其预后显著恶化。使用体外系统和小鼠模型,研究人员抑制黑色素瘤的HIF1、HIF2表达。虽然转录因子的失活并没有减少初始肿瘤的生长,但它确实能减少黑色素瘤在体内的扩散速率。
doi:10.1038/nature19081
在一项新的研究中,来自比利时天主教鲁汶大学等机构的研究人员作出一项主要的结论:肿瘤细胞中的氧气缺乏改变它们的基因表达,因而导致癌症生长。这一发现是影响深远的,这是因为它证实维持肿瘤中合适的氧气供应抑制这些所谓的“表观遗传异常(epigenetic aberration)”。这一认识可能最终导致人们开发出新的靶向血管或这些表观遗传异常的抗癌药物。相关研究结果于2016年8月17日在线发表在Nature期刊上,论文标题为“Tumour hypoxia causes DNA hypermethylation by reducing TET activity”。论文通信作者为来自天主教鲁汶大学的Diether Lambrechts教授和Bernard Thienpont博士。
一般而言,癌症发生已得到很好的理解:由于偶然性或致癌因子,单个细胞的DNA发生突变,随后这种异常的细胞发生快速地增殖。这些基因突变破坏正常的细胞功能,但是有利于癌细胞生长和存活。但是除了这些基因变化外,肿瘤细胞也在表观遗传上存在差异:它们不得不处理基因如何表达而不是这些基因本身。

【8】PNAS:“杀不死”的癌症干细胞 低氧环境下竟然还能存活!
doi:10.1073/pnas.1602883113
近日,来自美国约翰斯霍普金斯大学的研究人员利用人类乳腺癌细胞和小鼠模型研究了癌症干细胞究竟如何在低氧情况下生存。一直以来,癌症干细胞的增殖都被看作是癌症治疗的主要障碍。
这项新研究表明低氧条件能够通过胚胎干细胞与乳腺癌干细胞之间相同的生化反应链促进细胞生长,对该过程进行深入了解能够帮助科学家们找到攻克癌症干细胞增殖的新路径。
研究人员表示,目前仍然有许多未知问题需要解答,但是他们已经知道低氧环境能够成为癌症干细胞增殖的温床,这为乳腺癌治疗提供了一些可能的药物靶点。
相关研究结果发表在国际学术期刊PNAS上。
科学家们很早就了解到低氧环境能够影响肿瘤生长,但是对于晚期肿瘤来说,其中可能存在一种矛盾:侵袭性肿瘤中存在一些低氧区域,在这些区域内癌细胞会因缺氧而死亡,然而患有侵袭性癌症的病人病情往往最差。这项新研究表明低氧环境其实能够促进一些癌症干细胞进行扩增,并且其中的机制与胚胎干细胞使用的机制相同。
doi: 10.1126/scitranslmed.aaa1260
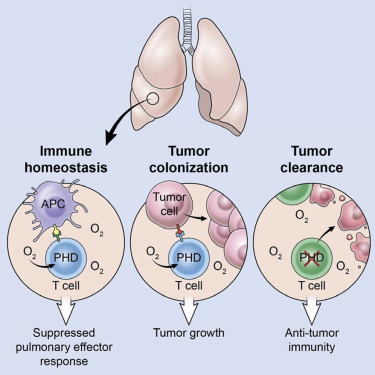
东北大学新英格兰炎症与组织保护研究所和匹兹堡大学的一项研究表明更多的氧气吸入可能促进免疫细胞攻击癌症。这一振奋人心的研究结果发表在3月4日的Science Translational Medicine杂志上。
肿瘤的生长非常迅速,其速度超过了他们的血液供应。这会造成低氧环境,进一步刺激癌细胞生成腺苷,并促使其附近的T细胞和自然杀伤细胞进入休眠状态。大量的研究试图阻断腺苷效应,并以此开发药物。本研究小组则从氧气供应角度来思考这个问题。
研究人员让患有肺癌的小鼠接受补氧疗法(40-60%浓度的氧气来治疗疾病)。他们发现,外加的氧气能改变肿瘤环境,因此免疫细胞能进入内部来行使免疫作用。而且高氧气组中的肿瘤缩小更为明显,当研究人员结合氧和注射额外的抗肿瘤T细胞时,这一效果尤其明显。

【10】Mol Cancer Res:缺氧如何诱导肿瘤细胞入血管转移
doi:10.1158/1541-7786.MCR-11-0498
SDF-1/CXCR4信号轴已被证实与乳腺癌转移有着密切联系。相比较于其在某些器官特异性肿瘤细胞归巢转移和定居中的作用,其在血管内特别是在缺氧的环境下是如何发挥作用的仍然知之甚少。
最初,研究发现趋化因子SDF-1及其受体CXCR4存在于浸润性导管癌标本组织的微血管中。近来,为了阐明肿瘤血管内皮细胞中SDF-1/CXCR4信号轴在肿瘤细胞入血管中的作用,研究人员选用人脐静脉内皮细胞和真皮微血管内皮细胞(HUVEC和HDMEC),研究了体外培养的HUVEC、HDMEC以及乳腺癌细胞(MDA/MB-231和MCF7)中CXCR4的活化情况。
缺氧可以导致血管内皮细胞的增殖、迁移和管形成。科学家观察在缺氧环境下SDF-1和CXCR4在血管内皮细胞是上调的。缺氧诱导肿瘤细胞与血管内皮细胞的粘附,刺激肿瘤细胞跨内皮迁移。缺氧对肿瘤细胞的影响依赖于其缺氧诱导因子(HIF)的活性。
众所周知,氧气对于人体细胞的生存和运作都是必需的。不过,癌细胞却是个例外,它们即便在缺氧的情况下仍可快速生长。有时,肿瘤的快速生长超过了血管新生的速度,使得某些距离血管较远的癌细胞无法得到充分的氧气供应,处于“窒息”状态。这时,癌细胞通过对基因表达进行“宏观调控”,关闭了大部分耗氧的生物过程,只留下那些维持存活必需的部分。
缺氧诱导因子(HIF)在这里发挥了重要作用。每当处于缺氧环境中时,癌细胞中的HIF就被激活表达,并通过发挥其转录调节因子的作用,降低乃至关闭线粒体中的耗氧过程,尤其是氧化磷酸化,从而使得糖酵解成为癌细胞主要的能量产生方式。然而,对于癌细胞线粒体之外的耗氧过程在缺氧环境下的调控,科学界至今未能给出答案。
不过,就在最近,来自纽约大学等机构的研究人员通过对乳腺癌细胞的研究终于对这一问题给出了解释。他们新发现了蛋白酪氨酸磷酸酶1B(PTP1B)作用于乳腺癌细胞的一个信号通路,它可以在缺氧条件下关闭非线粒体内的耗氧过程,从而使得癌细胞得以继续存活和生长。这一重要发现发表于最新一期的Nature子刊《Nature Cell Biology》上。(生物谷Bioon.com)
本文系生物谷原创编译整理,欢迎个人转发,网站转载请注明来源“生物谷”,商业授权请联系我们 。更多资讯请下载生物谷 app.
生物谷更多精彩盘点!敬请期待!













#癌细胞#
84
#致癌#
66