Sci Adv:真不怪T细胞不积极!中国科学家发现癌细胞竟会主动降解MHC-1类分子,难怪T细胞识别不出癌细胞
2020-07-28 奇点糕 奇点网
癌细胞有很多小花招可以逃避免疫系统的追杀,比如我们已经很熟悉的免疫检查点。
癌细胞有很多小花招可以逃避免疫系统的追杀,比如我们已经很熟悉的免疫检查点。
不过从临床研究结果来看,靶向PD-1/L1或CTLA-4的免疫检查点抑制剂虽然能够改善部分患者的生存,但是并不是所有患者都能产生响应。
显然,背后还有更多的免疫机制等着我们探索。
近期,天津医科大学科学家在《自然进展》杂志上发表了新研究结果。他们发现,癌细胞竟然能够通过一种蛋白SND1“劫持”主要组织相容性复合物1类分子(MHC-1),并迫使它们进入降解程序。这使得CD8+T细胞识别癌细胞的能力下降,并最终让癌细胞逃离免疫系统的追杀。
在包括黑色素瘤、肺癌、乳腺癌、肾癌、前列腺癌和膀胱癌在内的多种实体瘤中,约有20%-60%的肿瘤免疫逃逸是由MHC-1缺陷、CD8+T细胞识别能力下降导致的,具体的机制则根据癌种各有不同。
今天介绍这项研究中提到的SND1是一种新的癌蛋白,几乎在所有的肿瘤中都能检测到它的高表达。SND1是一种哺乳动物中普遍存在的保守蛋白,具有多种生理功能,此前研究显示SND1能够调节癌细胞的分化和迁移,还与上皮-间质转化有关,但是SND1具体对肿瘤发生有什么样的影响还不清楚。
为了研究SND1在肿瘤增殖中的作用,研究者们首先是对癌细胞做了纯化分析,鉴定出了一批与SND1作用相关的蛋白,其中包括一组与内质网(ER)有关的蛋白,比如人白细胞抗原-A(HLA-A)、VCP、SEC61A、核糖体蛋白L7a(RPL7A)等等。
众所周知,HLA-A是人类MHC-1的一部分,而MHC-1分子又是抗原递呈的关键,所以HLA-A与SND1的关系很快引起了研究者的注意。
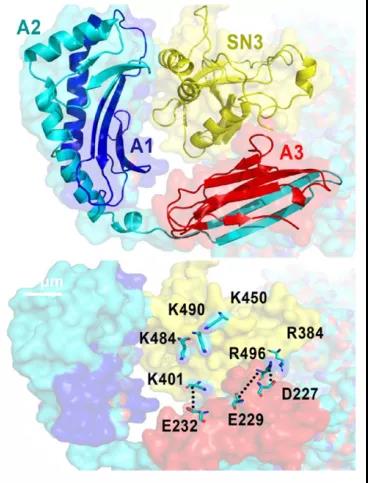
根据结构模拟,二者相互作用界面处于SND1的SN3区域和HLA-A的A1与A3之间,这说明SND1能够与未成熟的HLA-A之间发生相互作用。也就是说,在HLA-A刚刚被生产出来,还没有组成MHC-1完全体的时候,SND1就已经可以对它做些什么了。
那么SND1到底做了什么呢?
考虑到HLA-A在内质网合成并成熟,研究者首先猜测SND1和HLA-A的作用也发生在内质网上,而且前文也提到SND1与很多ER蛋白相关。通过免疫分析,研究者发现SND1正是一种通过结合SEC61A固定在内质网膜上的蛋白,可以在HLA-A一合成完毕就开始“抓捕”。
敲除SND1后,可以观察到癌细胞表面HLA-A的水平增加,而SND1过表达细胞中HLA-A的水平降低了。不过虽然蛋白水平变化,但是mRNA的水平是没有明显改变的,综合前面的发现,研究者猜测SND1可能并非阻止HLA-A的合成,而是诱导了HLA-A的降解。
正常情况下,蛋白也可以从内质网转移到细胞质中进行泛素化,进而开启内质网相关降解(ERAD)过程,而SND1正是强行将HLA-A导入ERAD使其降解。
研究者在小鼠中继续实验,分别在黑色素瘤和结肠腺癌细胞中敲除了SND1,结果SND1缺失肿瘤明显要比对照的正常肿瘤生长得更慢,肿瘤的大小和重量也更小。分析结果显示,SND1缺失的肿瘤中CD8+T细胞的数量也更多,不过PD-1阳性T细胞的比例没有差异。
这表示,SND1的缺失可以促进抗原提呈、增加CD8+T细胞浸润、增强抗肿瘤免疫力。
研究者还筛选了TIMER数据库和PrognoScan数据库中的相关数据,结果显示SND1表达确实与黑色素瘤和结肠腺癌中T细胞浸润呈负相关,而且SND1表达会显着影响黑色素瘤和大肠癌的预后。
从这些结果来看,SND1或许是增强免疫应答和抑制肿瘤生长的一个潜在治疗靶点。
原始出处:Yuan Wang, Xinting Wang, Xiaoteng Cui1, et al. Oncoprotein SND1 hijacks nascent MHC-I heavy chain to ER-associated degradation, leading to impaired CD8+ T cell response in tumor. Science Advances. 29 May 2020
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#科学家发现#
69
#MHC#
70
ok
0
#癌细胞#
65
#中国科学家#
110
#中国科学#
75