Cell Stem Cell:无限供应:对抗癌症的可再生T细胞
2019-01-20 佚名 中国生物技术网
近日,美国加州大学洛杉矶分校(UCLA)的一项研究首次展示了一种诱导多能干细胞培育出能杀死肿瘤细胞的T细胞技术,它可以产生体内的任一一种细胞类型,并且可以在实验室中无限生长。
近日,美国加州大学洛杉矶分校(UCLA)的一项研究首次展示了一种诱导多能干细胞培育出能杀死肿瘤细胞的T细胞技术,它可以产生体内的任一一种细胞类型,并且可以在实验室中无限生长。
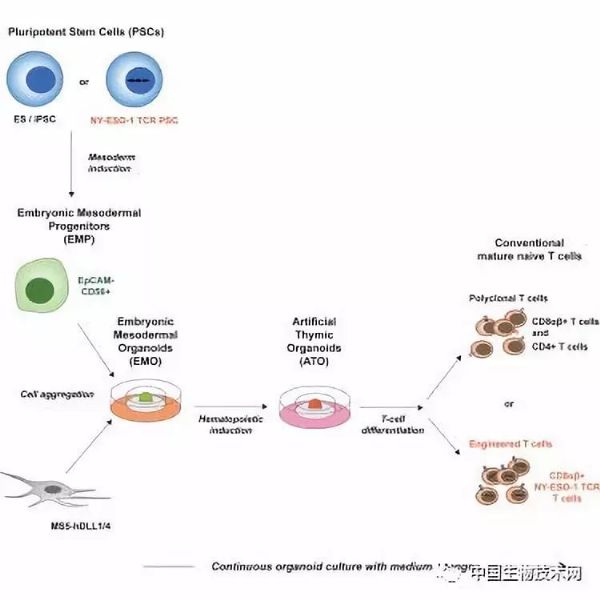
这项技术使用称为人工胸腺类器官的结构,该结构通过模拟胸腺的环境工作。胸腺是一种T细胞从血液干细胞中产生的器官,但也具有消灭癌细胞的潜力。利用UCLA的技术从自我更新的多能干细胞中创造它们的能力,可能会带来癌症免疫治疗的新方法,并可能促进针对艾滋病毒感染和自身免疫疾病T细胞疗法的进一步研究。这项技术最有前景的方面之一是它可以与基因编辑技术相结合,从而创造出几乎无限的T细胞供应,能用于大量的患者,而无需使用患者自己的T细胞。
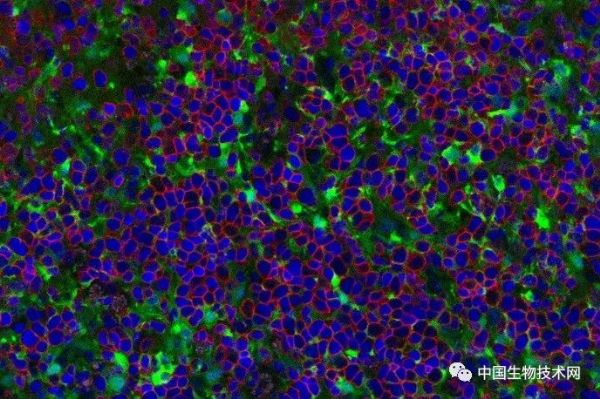
部分人类胸腺器官显示由人类胚胎干细胞产生的T细胞(红色轮廓)图片来源: UCLA
这项研究1月17日发表在《Cell Stem Cell》上,由Eli和Edythe再生医学和干细胞研究中心的联合负责人,儿科学、病理学和实验室医学教授Gay Crooks博士领导。
T细胞疗法,包括CAR-T细胞疗法,已经显示出治疗某些类型癌症的巨大潜力。目前的方法涉及从患者收集T细胞,用能帮助他们识别和破坏癌细胞的受体对T细胞进行基因工程改造,然后再将这些细胞注回患者体内。但工程化的T细胞并不总能很好地发挥作用,且治疗费用昂贵,因为它是针对每位患者量身定制的,而且一些癌症患者体内的T细胞数量不足以接受治疗。
图片来源:《Cell Stem Cell》
因此,一种不依赖于从患者体内收集T细胞而产生T细胞的技术是朝着使T细胞疗法更易于获得、更经济以及更有效的方向迈出的重要一步。
Crooks说:“令人兴奋的是我们能从多能干细胞开始。我希望未来将它与基因编辑工具结合起来,创造出更容易为患者所用的'现成'T细胞疗法。”
其他研究人员在尝试使用将多能干细胞与支持细胞层结合的方法生成T细胞方面仅取得了部分成功。但在之前的研究中产生的T细胞尚未成熟,无法成为功能完整的T细胞。
Crooks及其团队过去证明,人工胸腺类器官的3D结构允许成熟T细胞从成年血液干细胞中发育,并猜测它们也支持从多能干细胞中产生成熟的T细胞。
Crooks说:“人工胸腺类器官的3D结构似乎能为T细胞发育成熟提供必要的支持信号和环境。”
研究表明,人工胸腺类器官可以从目前用于研究的两种多能干细胞中有效地发育为成熟的T细胞:胚胎干细胞(源自捐献的胚胎)和诱导多能干细胞(通过重新编程成人皮肤或血细胞恢复到胚胎状态)。
研究人员们还证明,他们可以通过遗传工程改造多能干细胞来表达靶向癌症的T细胞受体,并使用人工胸腺类器官生成能够靶向并杀死小鼠肿瘤细胞的T细胞。
Crook实验室的助理项目科学家,该研究的共同第一作者Amélie Montel-Hagen说:“一旦我们通过基因编辑创造出能在人工胸腺类器官中产生肿瘤特异性T细胞的多能干细胞系,我们就可以无限扩展这些干细胞系。拥有能够对抗多种癌症的无限量的T细胞供应将成为癌症治疗的转折点。”

Gay Crooks、Amélie Montel-Hagen和Christopher Seet
目前,UCLA的科学家们面临的另一个挑战是,使用人工胸腺类器官创造的T细胞表面带有额外的分子,这些分子并不匹配每一位患者。Montel-Hagen说,这些额外的分子可能导致病人的身体排斥移植的细胞。
该研究的共同第一作者、UCLA液肿瘤系的临床讲师Christopher Seet博士说:“我们下一步的工作是创造出具有抗癌受体的T细胞,同时这些T细胞上没有导致排异反应的分子,这对于通用T细胞疗法的发展是非常重要的一步。”
原始出处:Amélie Montel-Hagen, Christopher S.Seet, Suwen Li, et al. Organoid-Induced Differentiation of Conventional T Cells from Human Pluripotent Stem Cells. Cell Stem Cell. 17 January 2019
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CEL#
54
#stem cell#
62
#Cell#
105
学习了,谢谢作者分享!
92
#STEM#
60