Nat Rev Clin Oncol: 晚期胃肠间质瘤的治疗新策略
2022-03-23 生物医学科研之家 网络
在这篇综述中,作者讨论了GIST的分子亚型、当前治疗方法的发展,还强调了新兴的治疗方法,这些方法可能通过基于不同GIST分子亚型生物学特征的新策略来克服临床挑战。
背景:
胃肠道间质瘤(GIST)是最常见的肉瘤形式,在20世纪90年代首次被认为是一种独特的病理实体,晚期患者由于缺乏有效的药物治疗,预后非常差。KIT突变作为GIST的第一个和最普遍的驱动因素的发现,以及随后开发的第一个KIT酪氨酸激酶抑制剂(TKI)伊马替尼,彻底改变了这种疾病患者的治疗。通过分子诊断测试,我们现在可以在99%的GIST患者中识别驱动突变,并且已经开发出治疗许多(但不是所有)这种疾病的分子亚型的疗法。
目前,FDA批准了7种治疗晚期GIST的药物(伊马替尼、舒尼替、瑞戈非尼、利普替尼、阿伐替尼、拉罗特替尼和恩特替尼),均为TKIs。尽管这些药物对治疗某些GIST亚型非常有效,但仍存在挑战,需要新的治疗方法。
简介:
2022年2月30日,来自美国俄勒冈健康与科学大学波特兰VA医疗保健系统和奈特癌症研究所的Michael C. Heinrich教授课题组在Nat RevClin Oncol(IF: 66.7)杂志上发表题为“New treatment strategies for advanced-stage gastrointestinal stromal tumours”的综述[1]。在这篇综述中,作者讨论了GIST的分子亚型和当前治疗方法的发展,以及它们的治疗局限性。还强调了新兴的治疗方法,这些方法可能通过基于不同GIST分子亚型生物学特征的新策略来克服临床挑战。

主要结果:
GIST的生物学。
胃肠道间质瘤可发生在整个胃肠道,最常发生在胃(60 65%)和小肠(20 35%);然而,它们的具体分子分布和生物学可以在不同的解剖部位。不同的GIST分子亚型被广泛地定义为单个驱动改变。三种主要的分子亚型KIT突变体、PDGFRA突变体或SDH缺失型占所有胃肠道间质瘤的近95%。其他各种罕见的分子驱动占了剩余的GIST病例,只有大约1%的GIST缺乏一个已知的驱动。
分子表型。
KIT-突变型GIST。1998年,KIT突变是首个在胃肠道间质瘤中发现的驱动突变。这些功能获得突变发生在大约70%的胃肠道间质瘤中,仅在蛋白质的少数位置发现——膜-近端细胞外域(涉及外显子8或9的突变),胞内近膜结构域(由外显子11编码)或激酶结构域(外显子13或17),并通过破坏RTK的自抑制区域引起组成的、配体独立的激酶活性。最常见的KIT原代突变影响近膜结构域; KIT 11外显子中的点突变或indel(插入和/或缺失)驱动60%的胃肠道间质瘤。KIT外显子11突变的胃肠道间质瘤可发生在整个胃肠道,从食道到直肠,但几乎所有发生在近端胃的病例都有可能发生。
PDGFRA-突变型GIST。PDGFRA是一种与KIT在功能和结构上高度同源的RTK。因此,PDGFRA突变在所有胃肠道间质瘤中发生约15%,与KIT中的突变相似;然而,两者之间的区别具有重要的治疗意义。与KIT突变一样,在胃肠道间质瘤中,PDGFRA突变是功能的获得,破坏了RTK的自抑制区域,从而导致了配体无关的激活。
SDH-缺失型GIST。缺乏SDH的GIST是第三大分子亚群,约占所有胃肠道间质瘤的9%。与大多数其他胃肠道间质瘤相比,这些肿瘤具有独特的临床和病理特征,它们通常发生在年轻人,几乎完全起源于胃(特别是发生在远端胃),通常具有上皮样而非梭形细胞形态,并经常引起淋巴结转移。
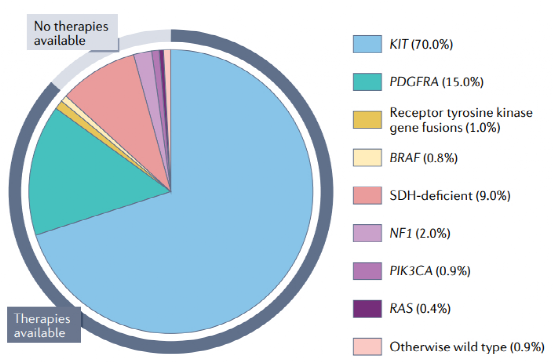
图1:GIST细胞分子亚型综述
细胞的起源。
大多数胃肠道间质瘤起源于Cajal间质细胞(ICCs)的转化,位于胃肠道壁,起着蠕动收缩起搏器的作用。至少已经确定了四种不同类型的ICC,包括肌肠内ICC (ICC-my)、肌内ICC (ICC-im)、粘膜下丛ICC (ICC-smp)和深层粘膜丛ICC (ICC-dmp)。
值得注意的是,这些ICC类在肠道中的分布各不相同。例如,胃只包含ICC-MY和ICC-IM,而大肠包含这些类以及ICC-SMP。小肠则缺乏ICC-IM和ICC-SMP,而含有ICC-MY和ICC-DMP。四种ICC亚型均表达KIT,但只有ICC-my和ICC-im可以通过KIT突变转化。对于某些GIST亚型,已经提出了不同来源的细胞。2005年,我们在胃肠道中发现了一种具有CD34+PDGFRA+免疫表型的ICC样细胞。此外,在罕见的生殖系PDGFRA突变家族中观察到端粒细胞增生,类似于在生殖系KIT突变个体中发生的ICC增生。
病理生物学。
在胃肠道间质瘤中,RTK-激活突变导致配体非依赖性激酶激活,并通过下游增殖和生存通路增加信号通路,包括PI3K-AKT、JAK-STAT和RAS-RAF MEK-ERK (MAPK)级联。很少情况下,这些通路中涉及其他效应因子的突变,包括PI3K、BRAF或RAS蛋白,或它们的调节因子,如NF1(一种GTPase激活蛋白,使RAS失活),也可以驱动致癌信号。SDH-缺失型 GIST是一种分子亚型,它似乎偏离了典型的RTK信号驱动的肿瘤发生机制。任何SDH基因的功能突变导致SDH活性的丧失,导致其底物琥珀酸盐的积累和延胡索酸盐产量的减少。

图2:GIST信号通路,药物靶点和目前的全身疗法
使用伊马替尼的经验教训。
在2000年之前,没有有效的药物治疗可用于晚期GIST患者。胃肠道间质瘤对通常用于治疗其他肉瘤的化疗药物具有最小的敏感性。历史上,胃肠道间质瘤也被认为对体外放射治疗有耐药性。尽管,最近的研究,包括一个单一的前瞻性II期试验,已经表明放射治疗可以在选定的患者中提供姑息性疾病稳定。
在本世纪初,已知的唯一有效的GIST治疗方法是手术,即以治疗为目的,对局限性疾病患者或对晚期GIST患者通过姑息选择性转移瘤切除术。1998年GIST中激活KIT突变的发现,导致了KIT抑制剂可能对这种疾病的治疗有效的假设。大约在这个时候,伊马替尼被确定为一种有效的KIT TKI,具有对抗KIT突变形式的活性,并且已经进行了广泛的治疗慢性髓系白血病患者的临床试验。
因此,伊马替尼在几个II期研究和随后的几个大型队列国际随机III期试验中被评价为一种治疗GIST的药物。在这些研究中,伊马替尼诱导的临床获益率(完全缓解、部分缓解或持久稳定疾病)为70-84%,中位无进展生存期(PFS)为20个月。
伊马替尼的成功对GIST治疗、药物开发和研究有重大影响。最终,由于伊马替尼的局限性,特别是与主要(内在)或次要(获得性)耐药性相关的局限性,所有目前批准的系统性GIST治疗方法(均为TKIs)的开发都受到了启发。这些局限性也为考虑新的治疗方法提供了一个视角。
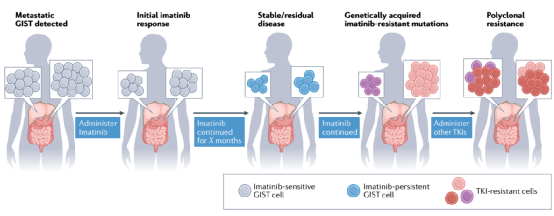
图3:TKI治疗期间GIST反应的典型模式及演变
治疗GIST的新策略。
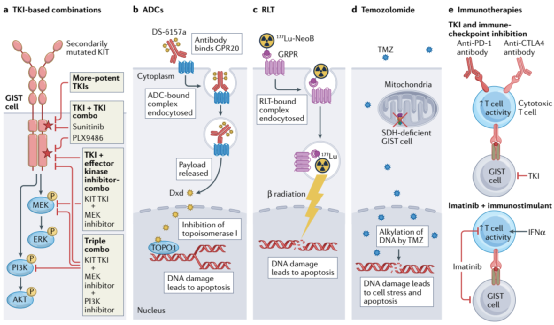
既往GIST治疗方法的局限性为开发新的治疗策略提供了创新的机会,包括那些利用TKIs的治疗策略,包括新开发的和目前可用的,以及在GIST治疗领域全新的方法。重要的是,尽管这不是一种新策略,但开发新的KIT和/或PDGFRA抑制剂,当作为单一药物使用时,能够控制更广泛的耐药性突变,仍然与GIST的临床相关性非常大。目前,至少有两种新型KIT TKIs作为单药进入晚期GIST患者的临床试验:THE-630 (NCT05160168)和NB003(正式名称为AZD3229; NCT04936178)。这两种药剂在体外对所有已报道的继发性KIT突变都有有效的活性(可能例外的涉及密码子816的某些突变)。这种活性谱理论上可以克服KIT突变型GIST患者的多克隆耐药性,该患者在之前的多个产品线的KIT TKIs治疗后进展。如果在这一患有晚期多药耐药疾病的人群中发现有希望的临床活性,更多的研究可能会在早期治疗系列中测试新药物,它们可能会取代目前的标准治疗TKIs。然而,额外的复合突变最终将导致临床耐药性,即使是对这些新药物,类似于观察到的最新一代EGFR和ABL1抑制剂。
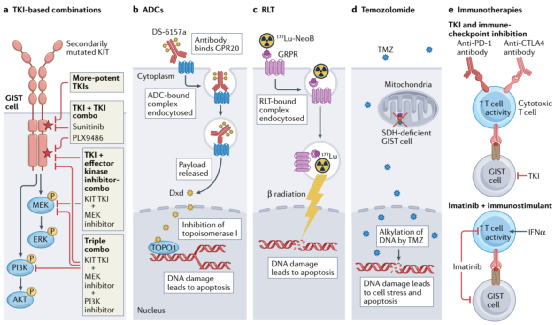
图4:利用GIST生物学不同元素的新治疗方法
使用TKIs的联合治疗。
目前的KIT TKIs缺乏对所有相关耐药性突变的活性,这限制了它们作为单一药物的有效性。然而,每种制剂对不同的KIT变体有独特的活性谱;因此,联合治疗是克服胃肠道间质瘤多克隆耐药和/或耐药细胞挑战的一种方法。不同的KIT-TKIs组合已经在体外和一些临床研究中进行了研究。在一项I期研究中,Serrano等人研究了一种交替使用舒尼替尼和regorafenib的新策略,以克服以前至少接受过伊马替尼、舒尼替尼和regorafenib治疗的患者中涉及不同继发性KIT突变的多克隆耐药性。不幸的是,这种方法没有成功,可能是由于两种TKIs的重叠毒性(胃肠道和手脚皮肤反应),以及难以设计出可耐受和有效的给药方案,尽管也可能是因为患者都有以前接触过的肿瘤,因此可能对这两种药物都产生了耐药性。最近,bezuclastinib(以前称为CGT9486和PLX9486)是一种I型抑制剂,对KIT外显子17和18(激活环)耐药突变具有有效的活性,当与舒尼替尼联合使用时,表现出良好的耐受性和临床活性。一种II型抑制剂,对晚期TKI-难治性GIST患者的KIT外显子13和14耐药突变具有有效活性。
结论和展望:
在过去的5年里,我们已经能够在99%的患者中确定致癌驱动事件的GIST,但是我们针对所有驱动突变的能力已经落后了。然而,在过去的几年里,除了KIT之外,已经产生了针对GIST驱动因素的新策略,为大约80-90%的晚期GIST患者提供了有效的治疗。
然而,目前TKI治疗的局限性对长期疾病控制提出了挑战,一些GIST亚型天生对这些药物不敏感。因此,将需要替代方法来更好地管理晚期GIST,随着新疗法的出现,最佳的治疗方法将需要不断完善。
原文链接:https://www.nature.com/articles/s41571-022-00606-4.
参考文献:
[1] Klug LR, Khosroyani HM, Kent JD, Heinrich MC. New treatment strategies for advanced-stage gastrointestinal stromal tumours. Nat Rev Clin Oncol. 2022 Feb 25. doi: 10.1038/s41571-022-00606-4. Epub ahead of print. PMID: 35217782.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Oncol#
64
#Nat#
0
#治疗新策略#
91
有帮助
90
#间质瘤#
72
#新策略#
72
学习
81
有帮助
77