在未实现之前,很多梦想都仿佛是不可实现的。 —— 曼德拉
阿基米德说:给我一个支点,我可以撬起整个地球!
科学家说:给我一个“空隙”,我就能在癌症靶点分子上扎下一个“楔子”,抑制住癌细胞的活性!
癌基因KRAS所编码的蛋白,也是癌症治疗的靶点。可惜的是,KRAS蛋白太光滑,根本找不到“空隙”,一直难以设计出有效的药物!
No Zuo No Die。得意忘形的KRAS发生G12C突变之后,无意中提供了一个锚点,让不可能成为了可能。
今年,美国FDA接受了Mirati Therapeutics 递交的KRAS靶向药Adagrasib的上市申请。KRAS靶向药是怎么设计出来的?到底能干什么?市场又有多大?希望这篇文章能讲清楚。
1、KRAS:“无法靶向”的驱动基因突变
癌细胞里有很多基因突变,这些突变一般可以分成两类:一类突变是“驱动基因突变”,另一类是“乘客基因突变”。
顾名思义,“驱动基因突变”驱动了细胞的癌化,所以突变基因所编码的蛋白,也就成为癌症靶向治疗的靶点;而 “乘客基因突变”只是搭了便车,碰巧发生在癌细胞中,这类突变对细胞癌化没有重要影响,也就不是治疗癌症的靶标。
这个不难理解,比如说“酒驾”,查的就是司机,不是乘客。
KRAS是一个很重要的基因,在很多癌症里都有突变。有多普遍呢?大约15%的癌症患者身上都有KRAS突变[1]。
KRAS突变就属于“驱动基因突变”,本可以作为靶向治疗的目标,但长期以来,靶向KRAS突变都是“不可实现的梦想”。
为什么会这样?
一般设计小分子抑制剂药物的时候,都要在靶点分子的结构里找到一个“空隙”,设计出来的药物分子就像是一个“楔子”,插入这个“空隙”后,能够稳定地结合在靶点分子上,并导致靶点分子的结构变形,影响其功能。可以这么说,药物设计就是一个“见缝插针”的活。
但是KRAS这个靶点是个不一样的烟火:表面太“光滑”了!找不到“空隙”,不管是针还是牙签,都插不进去。
所以,在很长时间里,设计新药的科学家简直都是KRAS的嘲笑对象,仿佛在说:“就喜欢你看不惯我却又干不掉我的样子!”
2、KRAS G12C:突变让 “不可能” 成为可能
有人喜欢凡尔赛,有人喜欢得瑟。
KRAS也喜欢得瑟。KRAS的得瑟,就是产生各种突变。但是,言多必失,得瑟太多了,总会露出马脚!
在KRAS常见的突变中,G12C突变比较特殊:在第12号氨基酸的位置,原来的甘氨酸(Gly)变成了Cys,这是一个半胱氨酸残基。在药物设计中,有一种不可逆抑制剂,可以与靶点分子上半胱氨酸上的巯基(-SH)形成共价键,让抑制剂紧紧地吸附在靶点分子上。
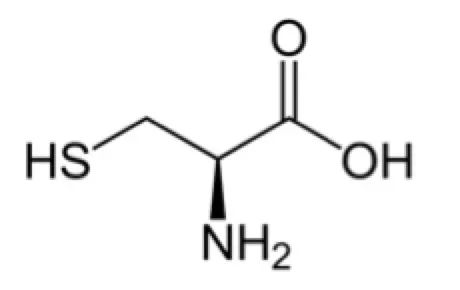
图:半胱氨酸
而KRAS产生的这样一个G12C突变,等于是突然给药物分子变出一个锚点!本来不好针对KRAS设计药物的,现在就有机会了!
对KRAS来说,这就是“不作死,就不会死” !
KRAS要保持致癌的活性,就需要能量分子GTP。KRAS不停地消耗GTP,癌细胞就不停地生长。有了G12C,就可以设计一个不可逆的抑制剂作为“楔子”,插到KRAS里,让它卡顿在一种失活的状态,无法再继续消耗GTP。
这听上去有道理,但是真正可行吗?
我们可以来了解一下一个靶向KRAS G12C的抑制剂Adagrasib (MRTX849)。
无图无真相,Adagrasib与KRAS G12C共价结合的晶体结构图,已经被拍照了[2]。
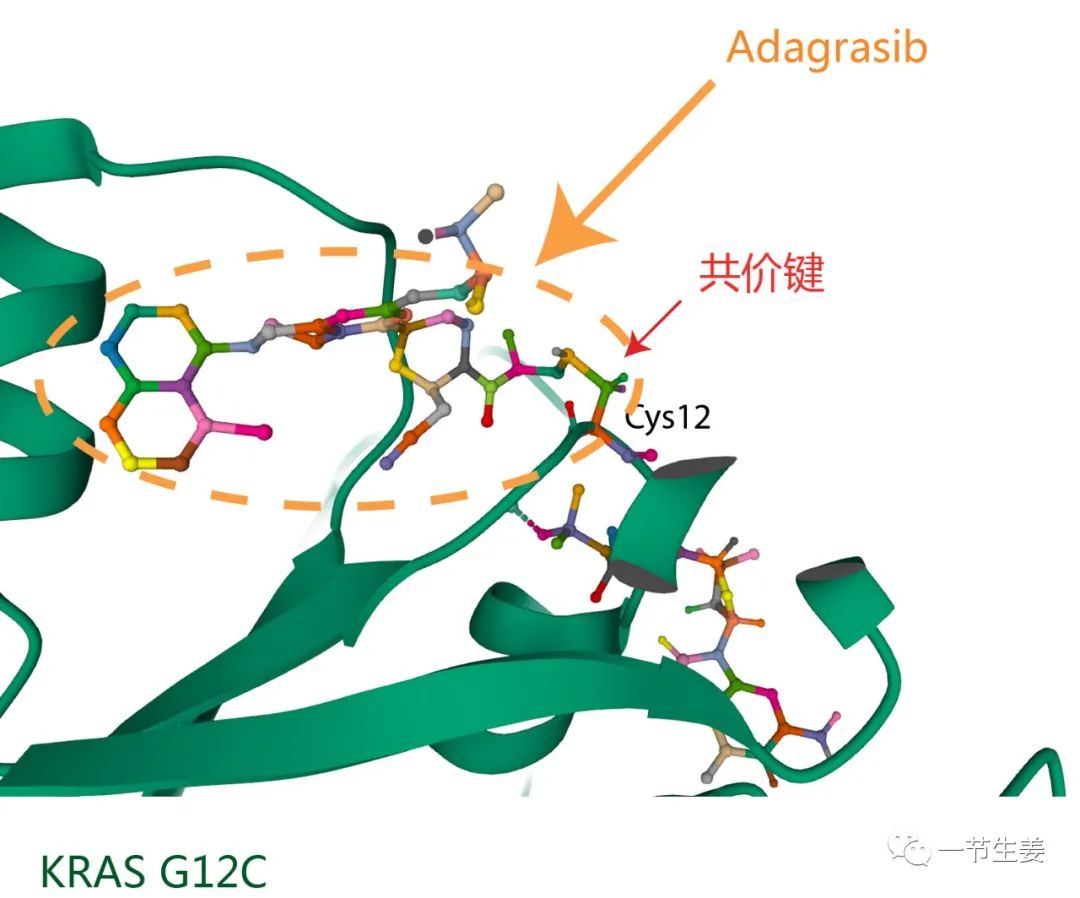 图:晶体结构学的研究证实,Adagrasib牢牢地与KRAS G12C结合为一体,共价结合的位点,就是KRAS突变后出现的Cys12 (PDB :6UT0)。
图:晶体结构学的研究证实,Adagrasib牢牢地与KRAS G12C结合为一体,共价结合的位点,就是KRAS突变后出现的Cys12 (PDB :6UT0)。
你可能想问:有了Cys12这样一个锚点,能让Adagrasib的结合力增加多少呢?答案是1000倍以上!如果KRAS没有出现G12C突变,那么Adagrasib的抑制活性基本就忽略不计了。
动物试验中也发现,在26个有KRAS G12C突变的肿瘤模型中,17个都显示了明显的抗癌效果,使用Adagrasib治疗之后,这17种肿瘤都能缩小30%以上,有的肿瘤甚至缩小了90%以上[3]。这说明,对于存在KRAS G12C突变的癌细胞,Adagrasib都有着较普遍的抗癌活性。
3、Adagrasib 的临床效果
总体上,有3.5%的癌症患者携带KRAS G12C突变。在不同的癌种,非小细胞肺癌(13.8%)、阑尾癌 (3.3%)、结直肠癌中(3.2%)、小肠癌(3.1%)中出现得比较多[4]。非小细胞肺癌和结直肠癌中是两种比较高发的癌症,Adagrasib的临床试验也主要是在这两种癌症患者中开展。
在临床1期和2期的临床试验中,总共51个非小细胞肺癌患者接受了Adagrasib治疗,客观缓解率达到45%,另外有51%的患者病情稳定,疾病控制率达到了96%,只有1个患者病情出现进展。在23个出现部分缓解的患者中,19个患者保持着良好的治疗效果,病情没有反复。
参加临床试验的患者,都是晚期患者,而且之前已经接受过很多种治疗,有92%的患者使用过PD-1/PD-L1 抗体。其中一个有脑转移的患者,之前已经接受过化疗、K药(PD-1抗体)、放疗等治疗,但病情还是恶化了。在接受Adagrasib治疗之后,病情出现部分缓解,肿瘤的大小缩小了67%。
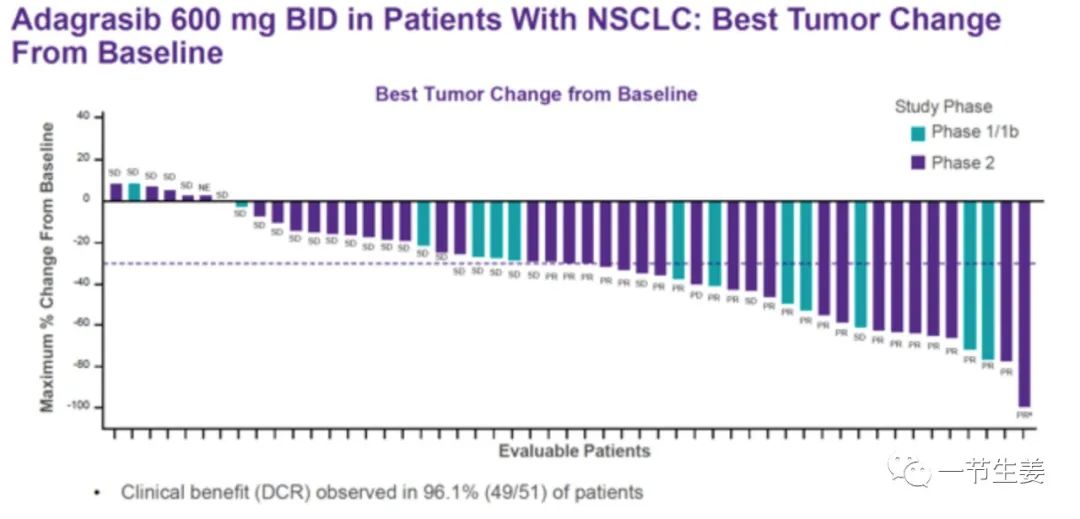
临床研究中还发现,如果患者同时还有STK11突变,Adagrasib治疗效果会更好。对于没有突变的STK11野生型患者,缓解率只有34%,但是对于有STK11突变的患者,缓解率提高到了64%。
4、不是一个人在战斗:Adagrasib 所面临的竞争
既然KRAS露出了破绽,提供了G12C这样一个锚点,众多的药企绝对不会袖手旁观,错失一个难得的良机。在众多的KRAS G12C抑制剂里,Adagrasib最大的竞争对手,是sotorasib (AMG510)。这个来自Amgen的新药,因为临床进展迅速,在2021年5月已经获得了FDA的加速批准,用于二线治疗局部晚期或转移的非小细胞肺癌。当然,必须是有KRAS G12C突变的患者才能使用。
支持sotorasib获批的数据,是来自CodeBreaK100临床研究,这是一个多中心、单臂的临床试验,通过对参加试验的124名患者进行的评估,表明sotorasib治疗的客观缓解率为36%,缓解持续时间中位数为10个月。
如果直接比较客观缓解率,那么Adagrasib的数据看着更好一些(45% vs.36%)。当然,需要指出的是,直接比较来自不同试验所获得的数据,是不太可靠的,因为患者的情况可能大不一样。根据在2019年WCLC大会上公布的数据,sotorasib在早期的临床试验中,ORR曾经达到了48%!FDA批准的sotorasib剂量为960mg,如果仅看使用这个治疗剂量的13名患者,当时有7名患者获得了部分缓解,ORR甚至达到了54%!
所以,对于Adagrasib来说,关键的是在进一步的临床试验中,ORR是否还能保住45%!
除了以上两款进展得比较快的抑制剂,目前其他企业也有在研先导化合物,有的进入了临床,也有的在1期临床试验中显示出安全性问题而终止[5]。
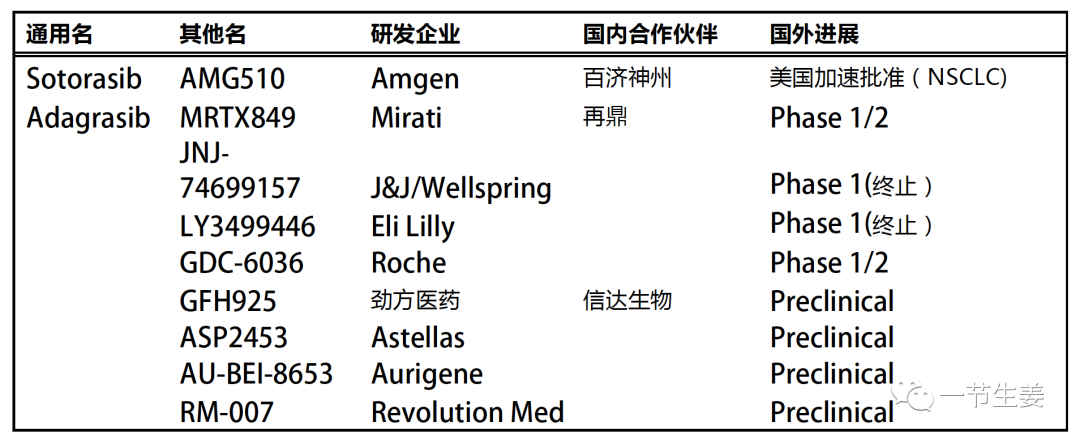
表:目前的KRAS G12C抑制剂
这些都是小分子抑制剂,它们也面临着其他类型药物的竞争,比如siRNA, mRNA 疫苗,下游分子(如SHP2)抑制剂等等。
5、联合用药,效果更好
为了将ORR进一步提高,Adagrasib也在探索联合治疗的临床方案,比如与afatinib (EGFR抑制剂),TNO155b (SHP2 抑制剂), palbociclib (CDK4/6抑制剂)等进行联合治疗。
在对结直肠的治疗中,Adagrasib联合治疗的效果看着很不错。对于晚期结直肠癌,在2011年,美国FDA就已经批准了EGFR单克隆抗体Cetuximab,与化疗联用,作为一线治疗方案,但患者如果有KRAS突变,则不能使用Cetuximab。这是因为在激活癌细胞活性的信号传导通路上,EGFR在上游,KRAS在下游,如果下游的KRAS突变导致信号通路的激活,即便控制住了上游的EGFR,还是不能掐断信号,在这种情况下Cetuximab的效果就不行。对于这样的患者,目前的一线标准治疗为化疗。
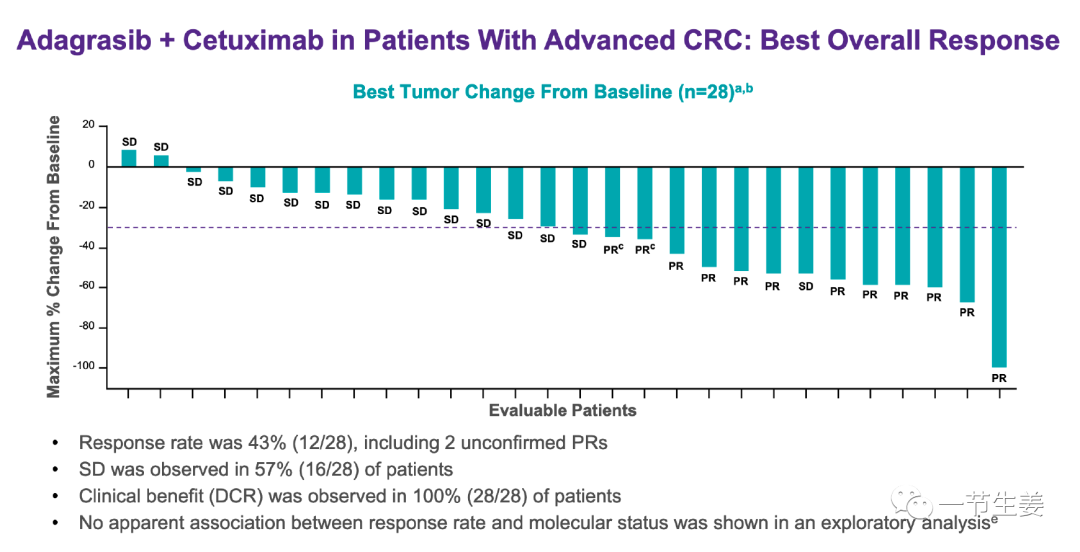
在此前的临床试验中,对于有KRAS G12C的晚期结直肠患者,在接受Adagrasib单药治疗后,ORR为22%,这比在非小细胞肺癌中的数字要低。但是,在去年召开的ESMO2021大会上,公布了Adagrasib联合Cetuximab二线治疗晚期结直肠的临床数据:ORR达到43%,SD(疾病稳定率)为57%,整体上疾病控制率为100%。这些患者本来无法使用Cetuximab进行治疗,但是现在Adagrasib与Cetuximab联用之后,显示出了协同效应,治疗效果大大提高了!
当然,目前的试验规模比较小,总共只有28个患者,目前Adagrasib+Cetuximab联合治疗与化疗头对头的3期临床试验正在准备之中,将作为关键性临床试验,验证Adagrasib在结直肠癌中的治疗效果。
6、Adagrasib 的市场有多大?
KRAS G12C 突变不仅仅局限于非小细胞肺癌和结直肠癌。今年1月21日,Mirati Therapeutics公司宣布,adagrasib在胰腺导管腺癌和其他胃肠道(GI)癌症中进行的临床试验也获得不错的结果,携带KRAS G12C突变的患者(二线后)在接受adagrasib治疗后,患者的客观缓解率(ORR)为41%,疾病控制率(DCR)达到了100%。
在去年年初的时候,Evaluate Pharma曾经做过预测:预计到2026年,adagrasib的年销售额将达到17.4亿美元。同时,sotorasib的销售额会达到15.1亿美元。
需要指出的是,对于KRAS这样一个曾经认为是“不可实现“的靶点,梦想不应该是15亿美元的年销售额,而应该是出现真正有效的治疗性药物。
疗效才是王道,而销售额,只是实现梦想后的后果和回报。
参考文献:
1. Zehir A, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nature medicine. 2017;23(6):703-13. Epub 2017/05/08. doi:10.1038/nm.4333. PubMed PMID: 28481359.
2. Fell JB, et al. Identification of the clinical development candidate MRTX849, a covalent KRASG12C inhibitor for the treatment of cancer. Journal of medicinal chemistry. 2020;63(13):6679-93.
3. Hallin J, et al. The KRASG12C inhibitor MRTX849 provides insight toward therapeutic susceptibility of KRAS-mutant cancers in mouse models and patients. Cancer discovery.2020;10(1):54-71.
4. Nassar AH, et al. Distribution of KRASG12C Somatic Mutations across Race, Sex, and Cancer Type. New England Journal of Medicine. 2021;384(2):185-7. doi: 10.1056/NEJMc2030638.
5. Dunnett-Kane V, et al. Mechanisms of Resistance to KRASG12C Inhibitors. Cancers.2021;13(1):151.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














加油吧
98
#KRAS#
134
生动形象有趣,容易理解
94
期待进入中国
93