安斯泰来首个Claudin18.2抗体Zolbetuximab治疗cldn18.2阳性胃腺癌或胃食管交界处腺癌三期临床成功
2022-11-18 MedSci原创 MedSci原创
2022年11月16日,安斯泰来(“Astellas”)宣布了3期SPOTLIGHT临床试验的积极顶线结果,该试验评估了Claudin18.2抗体zolbetuximab与mF
2022年11月16日,安斯泰来(“Astellas”)宣布了3期SPOTLIGHT临床试验的积极顶线结果,该试验评估了Claudin18.2抗体zolbetuximab与mFOLFOX6(一种包括奥沙利铂、亚叶酸钙和氟尿嘧啶的药物联合方案)联用的有效性和安全性。SPOTLIGHT试验招募了566名cldn18.2阳性、her2阴性、局部晚期不可切除或转移性胃腺癌或胃食管交界处(GEJ)腺癌患者。这也是首个靶向Claudin18.2的药物在注册临床中的积极结果。

Zolbetuximab(claudiximab)是一种first-in-class的嵌合单克隆免疫球蛋白G1抗体,与Claudin 18.2(CLDN18)高特异性识别和结合,而不与其它CLDNs交叉结合,通过抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)介导肿瘤细胞死亡。Claudin 18.2是一种胃特异性膜蛋白,被认为是胃癌和其他各类实体瘤的潜在治疗靶点。约50%的胃癌患者存在这一突变。
CLDN18.2最初被发现能持续、稳定地高表达于多种胃癌组织,但随后研究表明,其也能在乳腺癌、结肠癌、肝癌、头颈癌、支气管癌以及非小细胞肺癌等多种原发恶性肿瘤中异常激活和过度表达,尤其好发于消化系统恶性肿瘤,包括胃癌(70%),胰腺癌(50%),食管癌(30%)等。
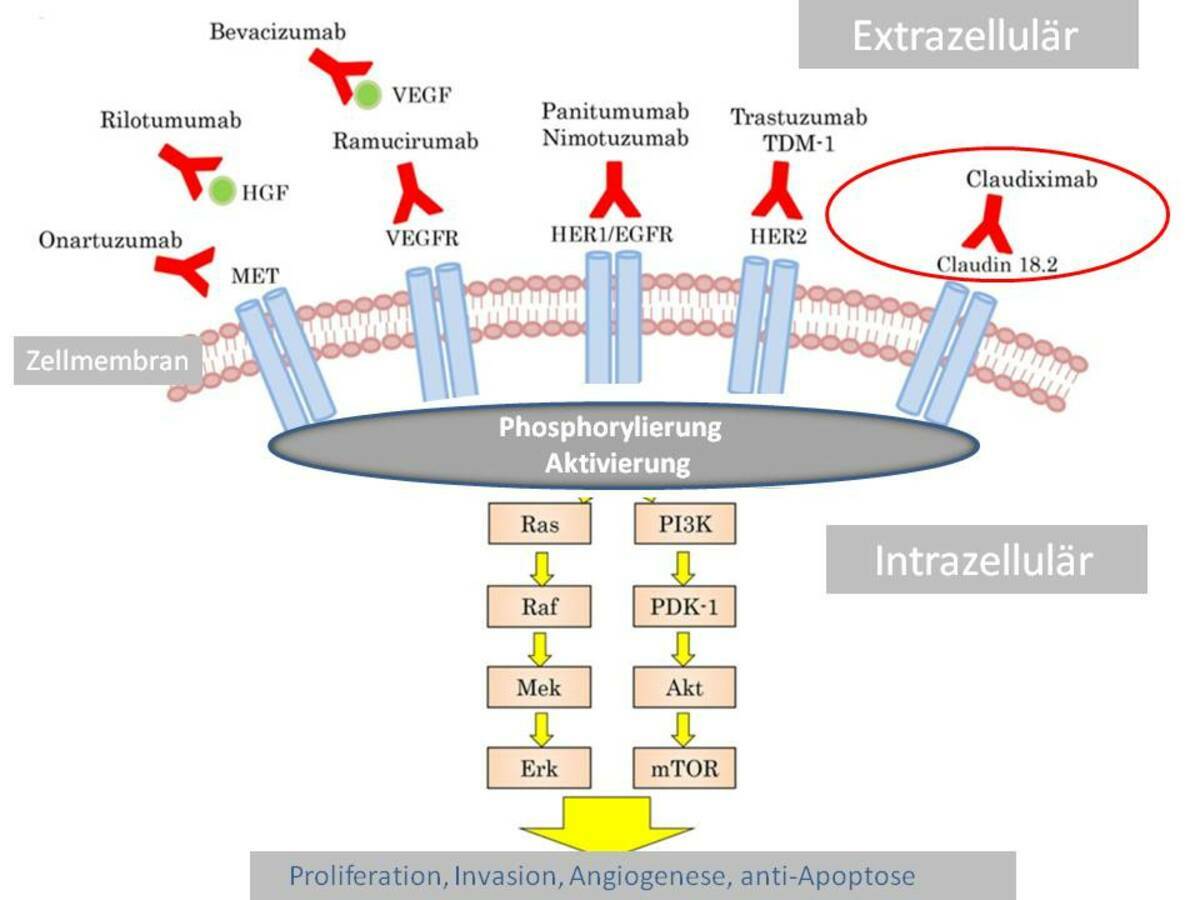
在这个代号为SPOTLIGHT的三期临床中(NCT03504397),共入组566例CLDN18.2+/HER2-的局部晚期不可切除或转移性的胃癌或胃食管交界处癌(GEJ)患者,试验组使用Zolbetuximab+mFOLFOX6、对照组使用安慰剂+mFOLFOX6。主要临床终点PFS和次要临床终点OS都达到显著性,不良反应主要是恶心、呕吐、食欲不振等胃肠道反应。
研究达到了其主要终点,即与安慰剂+mFOLFOX6相比,zolbetuximab+mFOLFOX6治疗的患者的无进展生存期(PFS)具有统计学意义;此外,该研究还满足了次要终点,即与安慰剂+ mFOLFOX6相比,zolbetuximab + mFOLFOX6治疗的患者的总生存期(OS)具有统计学意义。在zolbetuximab联合mFOLFOX6治疗的患者中,最常见的治疗紧急不良事件是恶心、呕吐和食欲减退。详细的结果将在未来召开的科学大会上公布。
Zolbetuximab有两项II期临床试验,分别是ILUSTRO和FAST研究。
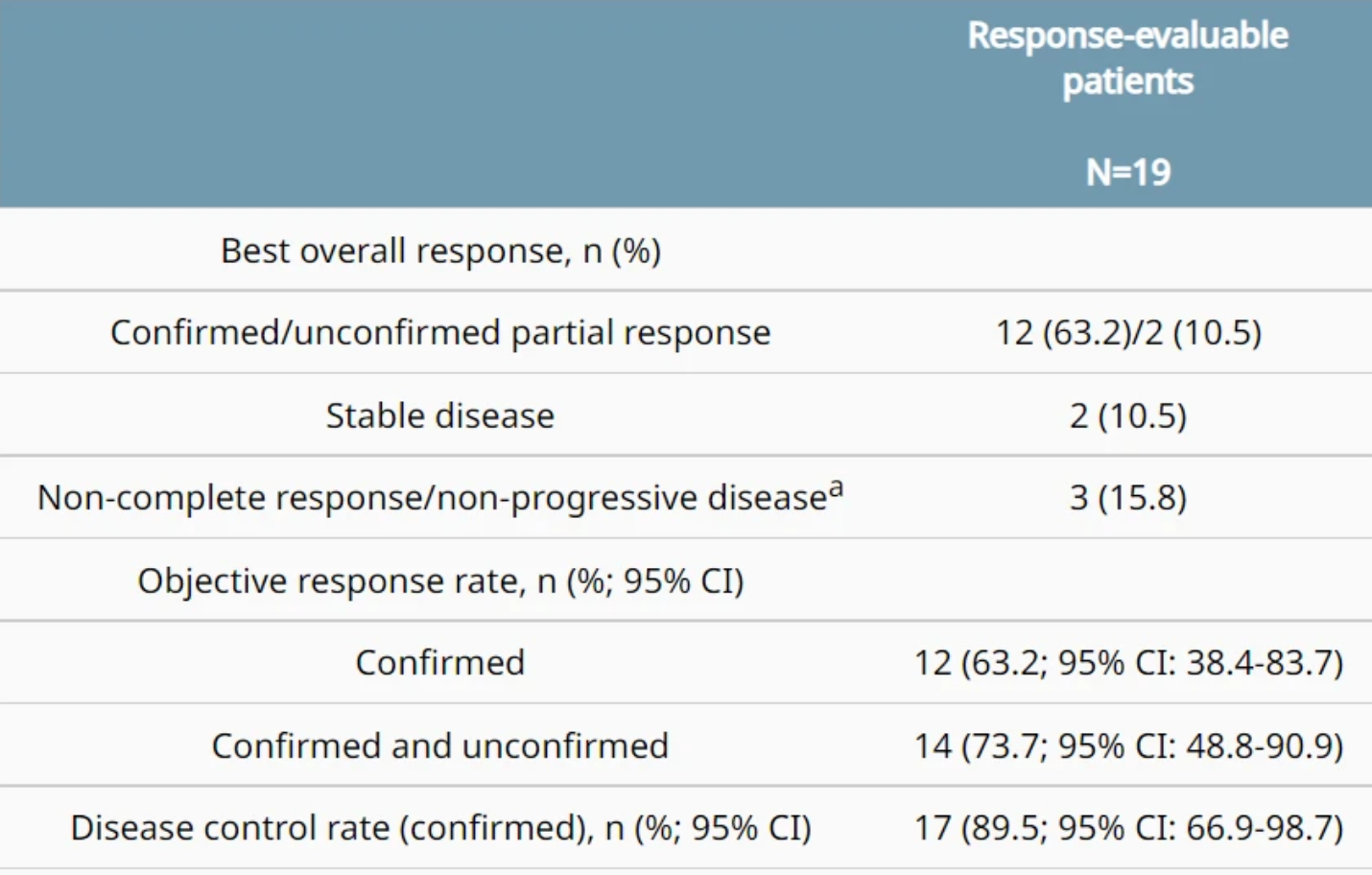
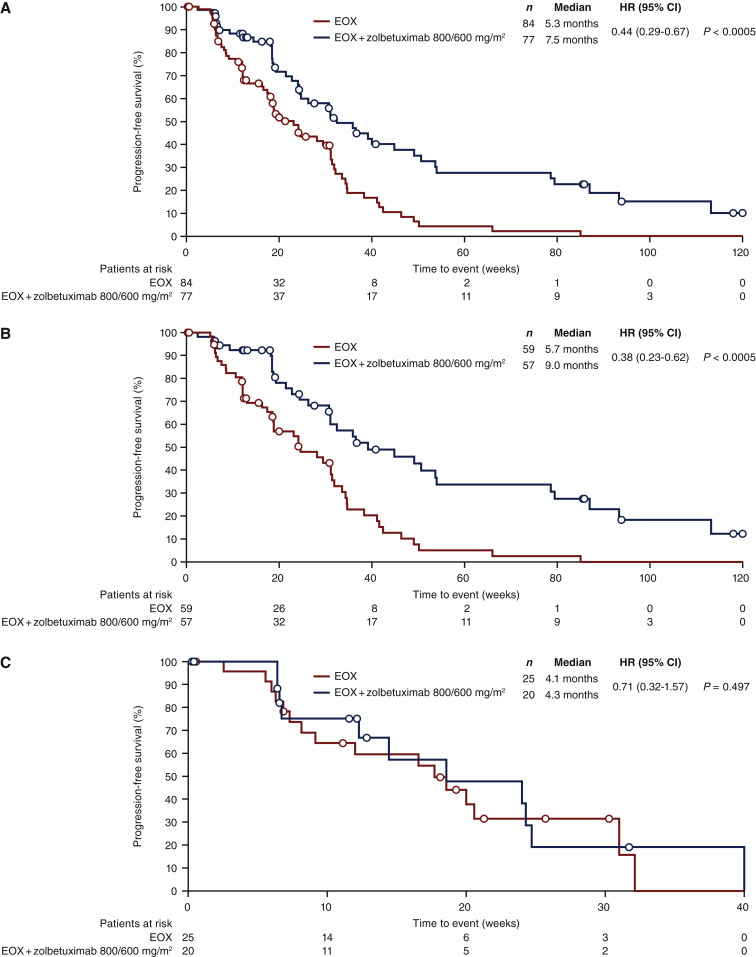
FAST结果去年发表在《肿瘤学年鉴》(Annals of Oncology)上。FAST研究纳入了晚期胃/胃食管交界处癌和食管腺癌患者(年龄≥18岁)中到强Claudin 18.2表达≥40%的肿瘤细胞。患者接受一线表表柔比星+奥沙利铂+卡培他滨(EOX,第1组,n=84)每3周一次(Q3W),或Zolbetuximab+EOX(负荷剂量,800 mg/m2,然后600 mg/m2 Q3W)(第2组,n=77)。入组开始后加入第3组(探索性)(Zolbetuximab+EOX 1000 mg/m2 Q3W,n=85)。主要终点是无进展生存期(PFS),总生存期(OS)是次要终点。
结果显示:在整个患者群体中,Zolbetuximab联合EOX组的中位PFS为7.5个月(n=77),而单独EOX组为5.3个月(n=84;心率,0.44;95%可信区间0.29-0.67;P<0.0005)。在Claudin 18.2阳性细胞占70%或以上的患者中,中位PFS分别为9.0个月(n=57)和5.7个月(n=59)(HR为0.38;95%可信区间0.23-0.62;P<0.0005)。在Claudin 18.2阳性肿瘤细胞占40%~69%的患者中,中位PFS分别为4.3个月(n=20)和4.1个月(n=20)(HR为0.71;95%CI,0.32-1.57;P=0.497)。

在整个患者群体中,Zolbetuximab联合EOX组的中位OS为13.0个月,而单独EOX组为8.3个月(HR,0.55;95%可信区间0.39-0.77;P<0.0005)。Claudin 18.2阳性细胞占70%以上的患者,中位生存期分别为16.5个月和8.9个月(HR,0.50;95%CI,0.33-0.74;P<0.0005)。Claudin 18.2阳性肿瘤细胞占40%~69%,中位生存期分别为8.3个月和7.4个月(HR为0.78;95%可信区间0.40-1.49;P=0.401)。
每次独立评估的客观有效率(ORR)是Zolbetuximab联合EOX组为39%,而单独用EOX组为25%。根据研究者的评估,ORR分别为37.7%和26.2%。根据独立评估,疾病控制率分别为83.1%和76.2%,根据研究者评估,疾病控制率分别为83.1%和81%。
在安全性方面,Zolbetuximab联合EOX组96.1%的患者观察到任何级别的不良反应(AEs),而EOX组为100%。其中,3级及以上不良事件分别占70.1%和64.3%。两组中最常见的不良反应包括恶心、呕吐、中性粒细胞减少和贫血。值得注意的是,接受Zolbetuximab并接受全胃切除术或部分胃切除术的患者(n=8/21)的呕吐发生率低于未接受胃切除术的患者(n=44/56)。
不过,有关Claudin18.2靶点药物竞争十分激烈,见:半年内国产6款Claudin18.2创新药物获批临床,全球在研进入热潮
参考资料:
半年内国产6款Claudin18.2创新药物获批临床,全球在研进入热潮
https://www.astellas.com/en/news/26821
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#安斯泰来#首个#Claudin18.2#抗体#Zolbetuximab#治疗cldn18.2阳性#胃腺癌#或#胃食管交界处腺癌#三期临床成功
105