Cell:有内鬼!终止交易!淋巴结竟成癌症帮凶
2022-05-31 生命科学前沿 生命科学前沿
这项研究成果为我们揭示了淋巴结在介导肿瘤免疫逃逸中的新机制,为临床肿瘤治疗,特别是靶向淋巴结中的抗原特异性Treg细胞或增强原位癌中NK细胞的免疫监视作用提供理论依据。
肿瘤转移是导致癌症患者死亡的主要原因。在临床上,淋巴转移是评估肿瘤患者预后情况的重要指标[1]。
淋巴结是体内免疫细胞激活的重要场所,包括了抗原递呈细胞(APCs)与T细胞之间的相互作用,生发中心的形成及B细胞的抗体应答等。在肿瘤与免疫系统相互博弈的过程中,肿瘤会不断发生适应性突变,从而逃逸宿主免疫系统的监视,其中就包括肿瘤能够进化出“驯化”机体免疫的能力,使得免疫细胞成为促进肿瘤发生发展的帮凶。然而,肿瘤细胞是否利用淋巴结来介导肿瘤的远端转移是个亟待解决的科学问题。
近日,由Stanford大学Edgar G. Engleman团队在Cell期刊发表题为“Lymph node colonization induces tumor-immune tolerance to promote distant metastasis”的重要成果[2]。他们发现,原位肿瘤细胞在免疫微环境中的干扰素(IFNs)刺激下,能够诱导肿瘤细胞发生表观重塑,并上调MHC-I及PD-L1等干扰素诱导基因(ISGs)表达,从而逃逸NK细胞免疫监视,发生淋巴结转移。淋巴转移的肿瘤细胞诱导T细胞耗竭和抗原特异性Treg细胞分化,形成免疫耐受系统,进一步促进肿瘤的远端转移。

论文首页截图
首先,研究人员提出科学问题问题:免疫细胞是否介导肿瘤的淋巴转移?为了揭示这一可能的现象,首先就是需要获得淋巴转移的工具细胞株。研究人员利用B16-F0细胞系进行连续9次体内淋巴转移灶筛选,获得了不同程度的黑色素瘤转移株(LN细胞株)。并通过体内荷瘤发现LN细胞株更具有淋巴转移及肺转移的潜能。
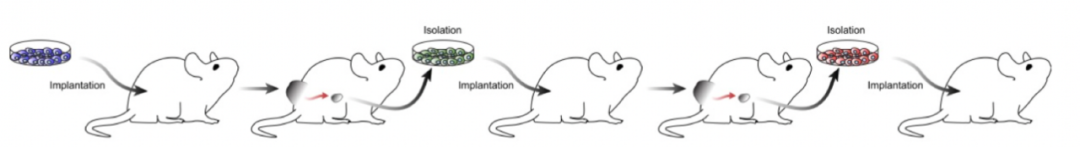
构建淋巴转移细胞系
进一步,研究人员进行了RNA-seq及ATAC-seq分析发现,LN细胞株相比于原始细胞株上调了ISGs相关基因的表达,尤其是Cd274 (PDL-1)及B2m(MHC-I)在内的ISGs基因的转录组水平及染色质的可及性。并且通过功能缺失实验发现,敲除IFNR-STAT1信号通路、MHC-I、PD-L1均能够抑制肿瘤的淋巴转移。这说明了细胞内的ISGs信号的激活对肿瘤的淋巴转移是必须的。
由于NK细胞能够杀伤MHC-I低表达的肿瘤细胞,而高表达MHC-I能够逃逸NK细胞的杀伤作用。的确,LN细胞株相比原始细胞株显著抵御NK细胞的杀伤作用,且抗体阻断NK细胞能够促进淋巴转移的发生。
研究人员进一步提出问题:肿瘤淋巴转移是否影响淋巴结内的免疫组分?通过流式细胞术及scRNA-seq分析发现,LN细胞株相较于原始细胞株显著抑制淋巴结内T细胞的比例,促进T细胞耗竭及Treg细胞的量和效应功能。因此,淋巴结内的肿瘤耐受微环境很可能促成了肿瘤的远端转移。
接着,研究人员利用先天淋巴结缺陷的Lta敲除小鼠,发现淋巴结缺失抑制了肿瘤的肺转移。而分选、过继存在肿瘤淋巴转移的淋巴结白细胞能够促进肺转移的发生。这些结果说明,淋巴转移的肿瘤细胞能够驯化白细胞促进肿瘤的免疫逃逸及远端转移。
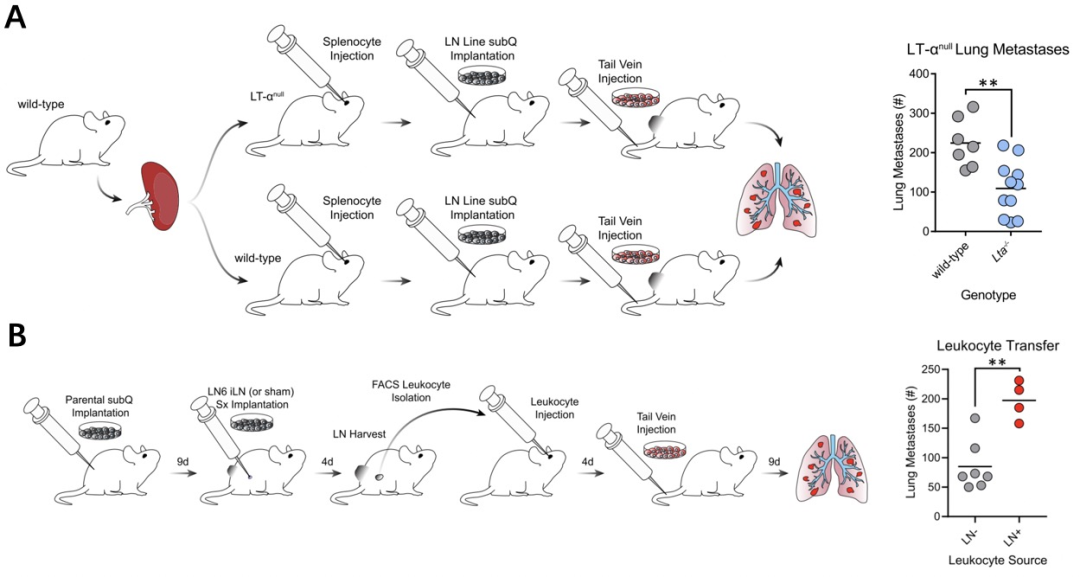
肿瘤淋巴转移促进了肿瘤肺转移
最后,研究人员发现肿瘤的淋巴浸润能够上调Treg细胞及TGF-β的表达,而阻断TGF-β或删除Treg细胞能够抑制肿瘤发生肺转移。并且,研究人员利用过表达OVA抗原的肿瘤细胞株发现,淋巴转移的LN细胞株显著增加了抗原特异性的Treg细胞。综合这些结果,淋巴转移的肿瘤细胞通过诱导淋巴内的肿瘤抗原特异性Treg细胞介导肿瘤发生“转移耐受”,继而引起肿瘤的远端转移。
这项研究成果为我们揭示了淋巴结在介导肿瘤免疫逃逸中的新机制,为临床肿瘤治疗,特别是靶向淋巴结中的抗原特异性Treg细胞或增强原位癌中NK细胞的免疫监视作用提供理论依据。

文章模式图
参考文献:
[1] S.P. Leong, M. Zuber, R.L. Ferris, Y. Kitagawa, R. Cabanas, C. Levenback, M. Faries, and S. Saha, Impact of nodal status and tumor burden in sentinel lymph nodes on the clinical outcomes of cancer patients. J Surg Oncol 103 (2011) 518-30.
[2] N.E. Reticker-Flynn, W. Zhang, J.A. Belk, P.A. Basto, N.K. Escalante, G.O.W. Pilarowski, A. Bejnood, M.M. Martins, J.A. Kenkel, I.L. Linde, S. Bagchi, R. Yuan, S. Chang, M.H. Spitzer, Y. Carmi, J. Cheng, L.L. Tolentino, O. Choi, N. Wu, C.S. Kong, A.J. Gentles, J.B. Sunwoo, A.T. Satpathy, S.K. Plevritis, and E.G. Engleman, Lymph node colonization induces tumor-immune tolerance to promote distant metastasis. Cell (2022).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Cell#
102
#CEL#
77
#淋巴结#
130