T细胞中的免疫检查点受体信号通路
2022-09-06 小药说药 小药说药
免疫信号网络在免疫检查点受体中的作用是一个令人兴奋的研究领域,然而我们对免疫检查点信号通路的了解依然有限,信号整合是信号复合物精细调节和激活的结果。
在肿瘤免疫治疗的成功推动下,对负调节淋巴细胞功能的受体的研究正在迅速发展。人们的研究普遍集中在从功能角度表征这些免疫检查点受体,而对这些受体的信号传导机制的研究较少。目前的研究已经证明,一些受体的细胞外部分充当激活配体的诱饵受体,而大多数情况下,其胞质尾部的酪氨酸磷酸化驱动关键的抑制信号。这种负信号由一些关键信号转导子介导,如酪氨酸磷酸酶、肌醇磷酸酶和二酰甘油激酶,这使得它们能够抵消TCR介导的激活。这些信号通路的特征对于开发新的免疫疗法,克服目前免疫检查点抑制剂的不足非常重要。
T细胞信号机制主要促进识别抗原呈递细胞(APC)上非自身抗原T淋巴细胞的快速扩增、分化和效应反应。这种非比寻常的辨别能力来自激活和抑制信号的细胞内整合。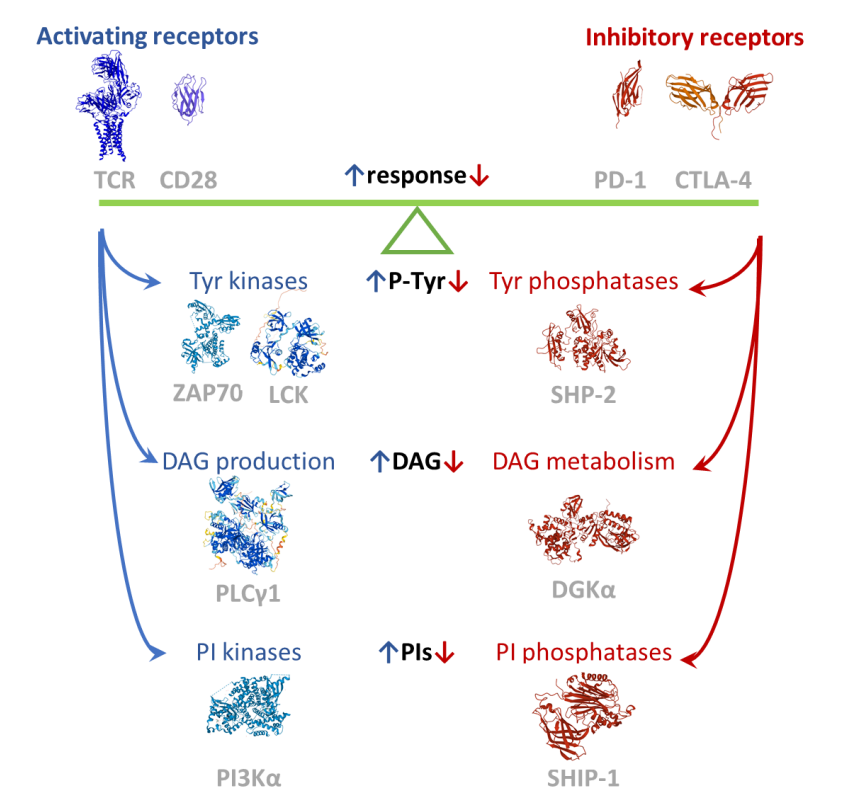
第一个激活信号由识别与主要组织相容性复合体(MHC)结合抗原的T细胞受体(TCR)传递。激活的TCR触发信号体的组装,主要成分包括酪氨酸激酶(如Lck和Zap70)、骨架(如Lat、SLP76和Themis)以及磷脂酶Cγ1(PLC γ1),另外也包括酪氨酸磷酸酶和E3泛素连接酶,如SHP1如Cbl。
T细胞第二个激活信号由CD28等共刺激受体提供。CD28增强TCR驱动的酪氨酸磷酸化,并与磷脂酰肌醇3激酶(PI3K)和Grb2募集一起作用,分别触发Akt-mTor和Ras-MAPK途径。
淋巴细胞功能最具特征的负性调节受体是PD-1和CTLA-4,它们代表了T细胞抑制性受体的范例。两者均持续抑制TCR诱导的细胞因子分泌和增殖,以及对葡萄糖的摄取和代谢。这些抑制性受体的细胞质尾部带有基于酪氨酸的抑制基序(ITIM),具有共同的序列特征:(S/I/V/L)xYxx(I/V/L);以及基于酪氨酸的开关基序(ITSM),它们具有共同的序列特征:TxYxx(V/I)。
当受体被激活后,两个基序都被Src家族激酶(SFK)磷酸化,并在调节免疫系统中发挥重要作用。ITIM通过招募磷酸酶,如含有SH2结构域的蛋白酪氨酸磷酸酶1和2(SHP-1和SHP-2)以及含有SH2的肌醇5′-磷酸酶1、2(SHIP-1和CHIP-2)来负性调节细胞活化,从而对信号传导产生负性影响。ITSM可以通过招募诸如信号淋巴细胞激活分子(SLAM)相关蛋白(SAP)等适配器来传递阳性或阴性信号。
PD-1(CD279)受体是I型跨膜糖蛋白,属于CD28受体超家族成员。但与CD28不同,它在细胞表面是单体。在结构上,PD-1由细胞外免疫球蛋白可变结构域、跨膜结构域和负责信号和骨架分子结合的细胞质尾部组成。PD-1的细胞质尾部包含两个酪氨酸基序,一个ITIM(VDY223GEL)和一个ITSM(TEY248ATI)。两个结构域在PD-1配体结合时通过Lck的酪氨酸激酶活性磷酸化。
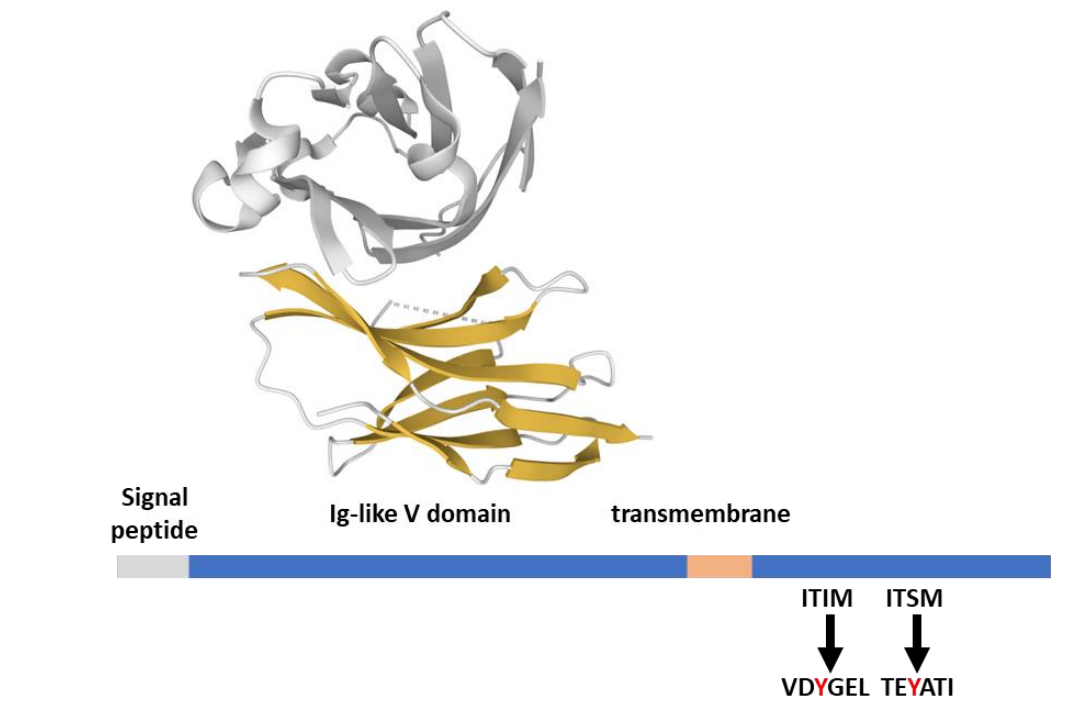
PD-1在活化的T细胞和B细胞、自然杀伤(NK)细胞、单核细胞、树突状细胞和癌细胞如黑色素瘤上表达。PD-1通过与PD-L1(B7-H1,CD274)结合而被激活,并且与PD-L2(B7-DC,CD273)具有更高的亲和力。两者的表达都是干扰素/细胞因子诱导的,但具有特定的表达模式:PD-L1在造血细胞和非造血细胞中广泛表达,而PD-L2主要在APC上表达。
在免疫细胞中,PD-1信号依赖于酪氨酸磷酸酶SHP-2。PD-1/SHP-2信号轴的破坏是肿瘤环境中对PD-1抗体产生临床反应的部分原因。配体结合后,SHP-2被招募到PD-1的磷酸化ITSM, ITSM的磷酸化诱导SHP-2向活性构象的转换。对重建的免疫突触的显微镜观察表明,在PD-L1的存在下,PD-1和CD28在TCR富集区中央发生关联。其中PD-1招募SHP-2,促进CD3ζ和CD28磷酸化的降低,并对TCR信号强度产生负面影响。PD-1促进的CD28去磷酸化深刻影响TCR信号体的PI3K募集,降低PI3K/AKT途径活性及其转录靶点,如Bcl-xL。此外,SHP-2被认为不仅负责阻断CD28共刺激信号,而且还负责抑制TCR介导的ZAP70磷酸化及其与CD3ζ的关联,这些信号会导致PKCθ和ERK激活以及下游IL-2的产生和扩增。
CTLA-4与CD28配体B7-1(CD80)和B7-2(CD86)以比与CD28自身更高的亲和力相互作用。这些相互作用产生CTLA-4的抑制功能:与CD28竞争配体,从而减少完全T细胞激活所需的第二信号。此外,CTLA-4组成性内吞作用可能APC的B7-1和B7-2,使其T细胞活化能力降低。
在结构上,CTLA-4与CD28具有广泛的相似性。它们的细胞外部分具有Ig样V结构域,允许形成二硫键连接的同源二聚体,而细胞质尾部在激活时被SFK磷酸化。CTLA-4胞质尾部高度保守,含有两种酪氨酸底物(Y201VKM和Y218FIP),可被Fyn、Lck和可能的其他激酶活化。这两个酪氨酸不是典型的ITSM基序,但参与CTLA-4抑制功能,可招募含有SH3结构域的信号分子。

CTLA-4胞内部分招募的许多效应子与CD28招募的效应子相同,如PI3K和II型丝氨酸/苏氨酸磷酸酶PP2A。虽然CD28是完全激活所需的典型第二信号,但CTLA-4也共同参与,通过在TCR信号体中招募SHP-1或SHP-2,减少早期TCR信号事件,包括ζ链、Zap70和LAT磷酸化以及MAPK途径活性。然而,CTLA-4缺乏用于SHP-2结合的ITSM基序,表明可能是间接招募。
BTLA是TNF受体家族成员疱疹病毒侵入介质(HVEM,也称为TNFRSF14)的几种受体之一,它本身也是一种受体,允许双向信号传导。由于二者均在T细胞中表达,因此顺式异源二聚化可能形成,并允许BTLA抑制HVEM依赖性NFκB活化。相反,HVEM结合诱导BTLA磷酸化,抑制T细胞增殖和IL-2产生。BTLA在单核细胞、B细胞、NK细胞和静止T淋巴细胞上表达。其表达在激活后的T细胞和NK细胞以及肿瘤浸润T细胞中上调。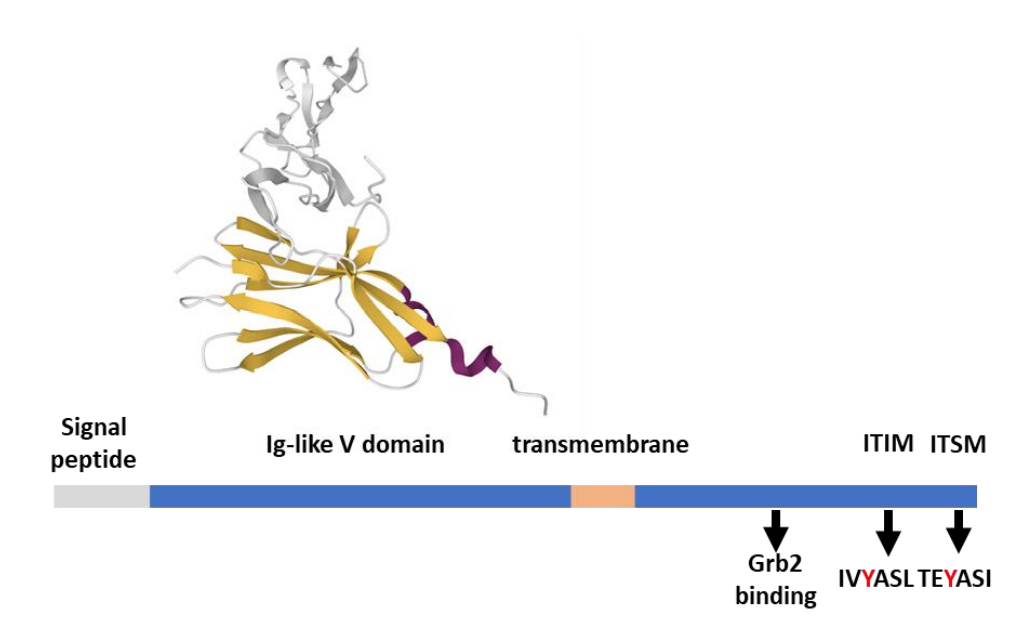
BTLA在进化和结构上与PD-1和CTLA-4相关,包括细胞外Ig样V结构域、跨膜区和胞质尾部。与PD-1类似,BTLA的尾部包含两个参与Grb2结合的额外酪氨酸(Y226和Y243),一个ITIM(IVY257ASL)和一个ITSM(TEY282ASI)。这四个酪氨酸是BTLA抑制功能所必需的。BTLA通过Y257和Y282优先招募SHP-1,从而有效促进CD28和CD3ζ的去磷酸化。此外,BTLA还通过与BCR信号体络合并招募SHP-1,减少B细胞增殖和细胞因子分泌,导致Syk激酶的去磷酸化和PLCγ2和NF-kB的活性降低。
T细胞免疫球蛋白粘蛋白-3(TIM-3)属于TIM蛋白家族,在Th1、CD4+、CD8+T细胞、NK细胞和树突状细胞上表达。在结构上,TIM-3具有参与配体相互作用的膜远端Ig样V结构域、膜近端粘蛋白结构域、跨膜区和参与磷酸酪氨酸依赖性信号传导的胞质尾部。TIM-3的配体包括CEACAM1、HMGB1和Gal-9。
T细胞中的细胞内Tim-3信号传导依赖于其胞质尾部,但具体仍不清楚。最近的一项蛋白质组学研究表明,Tim-3与37种蛋白质共沉淀,其中11种蛋白质由过矾酸钠动态调节,包括E3泛素连接酶CBL-B、SHP-1和Grb2。然而,这些相互作用与TIM-3的功能仍然存在争议。
白细胞相关免疫球蛋白样受体1(LAIR-1,也称为CD305)是一种广泛表达的胶原和胶原结构域蛋白的抑制性受体,如补体C1q。各种胶原亚型与细胞外LAIR-1结构域的结合抑制NK细胞的细胞毒活性和效应T细胞的活化。
LAIR-1的细胞内区域包含两个ITIM(Y251和Y281),它们在LAIR-1激活时均被磷酸化,并且是SHP-1和SHP-2募集所必需的。LAIR-1与胶原的结合抑制了TCR触发的Lck、Lyn和典型T细胞信号通路中其他关键成分的磷酸化,如CD3ζ链、ZAP-70和MAPK。
淋巴细胞激活基因-3(LAG-3)是一种抑制性受体,具有四个Ig样结构域,与CD4结构相似。LAG-3与MHC II相关,但其亲和力高于CD4本身,并通过干扰pMHC与CD4的结合来抑制T细胞激活。
LAG-3的胞内区由大约60个氨基酸残基组成,缺乏典型的抑制基序。然而,它包含几个氨基酸序列,这些氨基酸序列在不同的LAG-3物种中非常保守,而不与其他抑制性共受体共享。这些序列包括并列膜区的FSAL,中部区域的KIEELE,10-15个谷氨酸串联重复序列,以及在C末端区域的EX-repeat。LAG-3抑制T细胞活化需要细胞内区域的信号传递,它可以通过这些序列传递不同的抑制信号。
SLAM是主要在造血细胞中表达的受体家族(SLAM/CD150、CD48、Ly-9/CD229、CD84、2B4/CD244、NTB-a/Ly108和CRACC/CD319)。这些受体是同型(自结合)的,但2B4除外,它识别CD48。
结构上,SLAM家族蛋白包括细胞外部分Ig样V结构域和Ig样C结构域,随后是跨膜区和带有一个或多个ITSM的细胞质尾部。这些ITSM可以与含有SH2的SAP及其同系物EAT-2或抑制性分子(如SHP-1、SHP-2以及SHIP-1)相互作用。在与受体结合时,SAP通过招募SFK(如Fyn和Lck)激活下游信号,同时还与磷酸酶如SHP-1/SHP-2和SHIP-1竞争。因此,这些效应器之间的细胞特异性平衡决定了SLAM受体向细胞传递正信号还是负信号,从而调节其分化和效应器功能。
免疫信号网络在免疫检查点受体中的作用是一个令人兴奋的研究领域,然而我们对免疫检查点信号通路的了解依然有限,信号整合是信号复合物精细调节和激活的结果。目前,免疫检查点受体的一些关键信号通路分子已经引起了人们的关注,因为其可能靶向共同的抑制机制而不是特异性受体。最领先的靶点是SHP-2,其抑制剂已进入多个I期临床试验,而SHIP和DGK抑制剂仍处于临床前阶段。未来,随着对于免疫检查点信号通路网络的深入研究,将可能为我们提供新的治疗靶点。
参考文献:
1.Immune Checkpoint Receptors Signaling in T Cells. Int J Mol Sci.2022 Apr; 23(7): 3529.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#免疫检查点#
97
#信号通路#
87