I级优选推荐:CSCO指南重磅更新,阿得贝利单抗纳入小细胞肺癌指南一线治疗推荐
2023-08-21 中国医学论坛报今日肿瘤 中国医学论坛报今日肿瘤 发表于上海
PD-L1不仅仅表达在肿瘤细胞表面,在T细胞,树突细胞,巨噬细胞等表面均有表达,甚至某些细胞的表达量还高于肿瘤细胞。
2023年中国临床肿瘤学会(CSCO)指南大会将于4月21-22日在广州召开。其中《CSCO小细胞肺癌诊疗指南(2023)》将迎来重磅更新,并将在4月22日下午的全体大会上进行报告解读。近日CSCO小细胞肺癌专委会主任委员程颖教授在专访中揭晓了本次指南更新的要点[1]。其中,由恒瑞医药自主研发的全新一代PD-L1抑制剂阿得贝利单抗(艾瑞利®),重磅纳入指南广泛期小细胞肺癌一线治疗,I级优选推荐(1A类证据)。 这个PD-L1不一样 在过去,人们认为PD-L1表达在肿瘤细胞上,而PD-1表达在T细胞上,因此认为PD-L1抗体保留Fc段效应功能(ADCC,CDC,ADCP等效应)可能会进一步杀伤肿瘤细胞。但是,随着对于免疫微环境了解的不断深入,人们发现,PD-L1不仅仅表达在肿瘤细胞表面,在T细胞,树突细胞,巨噬细胞等表面均有表达,甚至某些细胞的表达量还高于肿瘤细胞[2]。这也就是为什么PD-L1的表达检测,除了要进行肿瘤细胞表面的PD-L1染色外,还要进行肿瘤相关免疫细胞染色,因此就有了CPS评分和TC/IC评分[3]。如果抗体具有Fc段效应功能,甚至有目的的增强效应功能,可能会导致免疫微环境中的免疫细胞被杀伤,从而导致不可控的疗效损失和不良反应。上述的ADCC,CDC和ADCP效应可以理解为“多余的无差别攻击”,药物结合在肿瘤细胞上就杀伤肿瘤细胞,药物结合在免疫细胞上也杀伤免疫细胞。 图1 PD-L1不仅表达在肿瘤细胞,在T细胞、树突细胞、巨噬细胞等表面也有表达 Avelumab作为一款完全保留Fc段效应功能的IgG1型PD-L1抑制剂,在一线单药治疗PD-L1高表达(TPS≥80%,仅检测肿瘤细胞PD-L1表达)NSCLC的III期研究JAVELIN Lung 100中,未能显著改善患者生存[4]。另一款PD-L1抑制剂度伐利尤单抗,保留了Fc段效应功能,在一线单药治疗PD-L1高表达(TC≥25%,仅检测肿瘤细胞PD-L1表达)NSCLC的两项III期研究MYSTIC和PEARL中,也未能显著改善患者生存[5,6]。阿替利珠单抗是IgG1型PD-L1抑制剂,去除了Fc段效应功能,在一线单药治疗PD-L1高表达(TC3/IC3,肿瘤细胞和免疫细胞PD-L1表达均检测)NSCLC的III期研究IMpower110中,显著改善了患者生存[7]。虽然一个研究的成功与失败,影响的因素有很多,但是从抗体结构特点和研发思路上,也可能一定程度上决定了其未来的命运。 图2 不同PD-L1单抗FC段功能的改造 阿得贝利单抗是恒瑞公司原研的PD-L1免疫检查点抑制剂,据悉已于2023年2月28日获批上市。分析该产品研发细节后发现,这个抗体还真“有点不一样”。 阿得贝利单抗在抗体研发立项时,就非常明确地希望筛选得到一款抗体功能更加纯净,高亲和力的并专注于阻断PD-L1/PD-1信号通路的免疫检查点抑制剂。因此阿得贝利单抗与既往已上市的PD-L1抑制剂有以下几个方面的不同: 首先,抗体选择不一样,同类进口PD-L1抑制剂都选择的是IgG1抗体类型,而阿得贝利单抗选择了IgG4抗体类型;IgG4抗体没有CDC作用,ADCC和ADCP作用也较弱[8,9],抗体更加纯净,安全性较好。 其次,抗体Fc段进行了改造,阿得贝利单抗的Fc段采用了234A/235A定点突变改造,消除了ADCC和ADCP作用[10]。去除了这些效应,自然避免了误杀和错杀,安全性进一步得到优化。同时,阿得贝利单抗Fab段进行了S228P改造,避免了Fab段置换,提高了药物的稳定型。 最后,从分子结构角度看,相比于既往上市的PD-L1抗体,阿得贝利单抗具有独特的与PD-L1的结合表位,其结合的角度更加居中,结合区域与结合面积更接近天然配体PD-1[11]。同时阿得贝利单抗与PD-L1结合的解离常数Kd值仅为0.27*10-10nmol/L[11],亲和力相较于已上市的PD-L1抗体更强。 这样的药物研发设计最终也体现在了临床疗效和安全性上,阿得贝利单抗的注册临床研究CAPSTONE-1结果显示,相较于对照组,阿得贝利单抗联合化疗显著改善患者的总生存期(mOS: 15.3个月vs12.8个月),降低死亡风险达28%,2年生存率达31.3%(vs化疗17.2%),且具有良好的安全性,≥3级的irAE发生率均不超过1.8%[11]。该研究结果发表在The Lancet Oncology国际顶级医学杂志上,中国原研已得到国际认可。 从以上信息可以看出,阿得贝利单抗的研发设计从头就没有走老路,最终临床上的疗效和安全性也更好,为国产原研正名,展现了民族药企强大的研发能力和中国临床研究者强大的科研水平。谁说中国只能制造不能智造? 纳入指南 规范实践 阿得贝利单抗本次纳入《CSCO小细胞肺癌诊疗指南(2023)》一线治疗I级优选推荐,是基于CAPSTONE-1研究的卓越结果。CAPSTONE-1研究是首个针对中国广泛期小细胞肺癌一线免疫治疗的III期研究,评估我国自主研发的PD-L1抑制剂阿得贝利单抗联合化疗一线治疗中国ES-SCLC的疗效和安全性。这项研究一共纳入中国47家医院462例患者,更符合中国的ES-SCLC的临床特点,为中国SCLC临床实践提供重要的循证医学证据。CAPSTONE-1研究使ES-SCLC的中位总生期(mOS)达到15.3个月,降低死亡风险达28%,2年生存率31.3%,使近1/3患者生存期突破两年,且具有良好的安全性。阿得贝利单抗组免疫相关不良反应(irAEs)发生率为27.8%,≥3级的irAE发生率均不超过1.8%。卓越的疗效和良好的安全性,离不开阿得贝利单抗具有独特的抗体选择、分子结构设计以及出色的药理特性。 优选推荐 利久长安 随着免疫时代的到来,多款免疫检查点抑制剂的出现为ES-SCLC带来改变治疗格局的曙光。然而,PD-1抑制剂与PD-L1抑制剂在ES-SCLC领域的探索结果不尽相同。全球范围内,纳武利尤单抗和帕博利珠单抗在ES-SCLC领域的多项III期临床研究均未能显著改善患者生存,先后撤回FDA获批的SCLC适应症[13,14];PD-1抑制剂斯鲁利单抗是全球范围内目前唯一取得阳性结果的PD-1抑制剂[15]。与之相反,PD-L1抑制剂在ES-SCLC领域捷报频传。IMpower133、CASPIAN两项III期研究先后取得阳性结果[16,17],并获批ES-SCLC适应症,开启了小细胞肺癌免疫治疗新纪元,中国自主研发的阿得贝利单抗CAPSTONE-1研究,进一步验证了PD-L1抑制剂在ES-SCLC中的标准治疗地位,研究结果荣登The Lancet Oncology,随着适应症的获批,必将为更多中国ES-SCLC患者带来长生存希望。 阿得贝利单抗的CAPSTONE-1研究是唯一纳入100%中国人群的III期临床研究,疗效和安全性结果更符合中国临床实践。斯鲁利单抗ASTRUM-005研究中亚裔人群占67%,并纳入了乌克兰、俄罗斯、格鲁吉亚等西方国家的患者[15],而IMpower133和CASPAIN研究入组的亚裔患者分别仅占17%和16%[16,17]。免疫治疗在中国人群中的疗效和安全性亟待确认。CASPIAN研究中国队列显示,度伐利尤单抗联合化疗未能显著延长中国患者生存,中位OS为14.4个月,较化疗组无统计学差异(p=0.0664),且PFS和ORR均为阴性[17]。度伐利尤单抗联合化疗组中位PFS为4.9个月,而化疗组为5.5 个月,HR为1.00(95%CI:0.68,1.48)。度伐利尤单抗联合化疗组的ORR为65.6%,而化疗组为71%[18]。 图3 CASPIAN中国队列研究结果 CAPSTONE-1研究在中国人群中首次证实,全新PD-L1抑制剂阿得贝利单抗联合化疗可以显著地改善中国ES-SCLC患者的生存,取得了PFS和OS的双阳性结果,显著降低疾病进展风险达33%,1年的PFS率为19.7%,是对照组5.9%的3倍多,更加展现了阿得贝利单抗稳健持久的肿瘤控制作用,也提示我们提升患者一线治疗的PFS对于延缓疾病进展意义重大。OS更是达到了15.3个月,与安慰剂联合化疗相比延长2.5个月,可以降低28%的死亡风险,2年OS率达31.3%(化疗组17.2%),让近1/3的患者生存突破2年[11,12]。 图4 CAPSTONE-1研究OS结果 
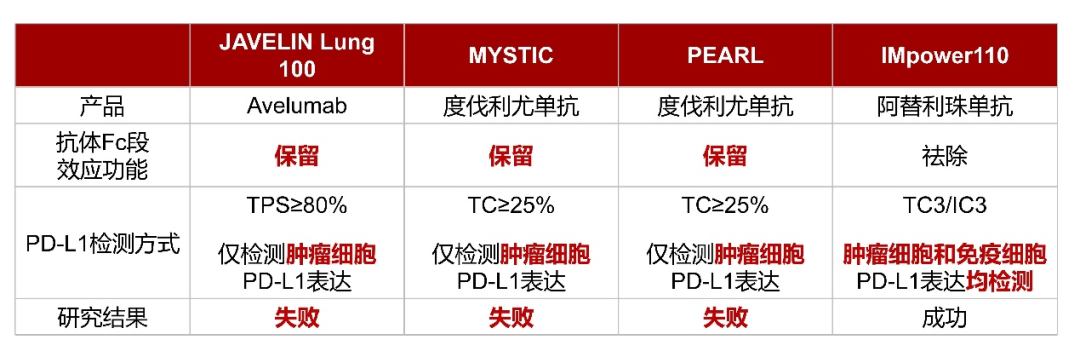
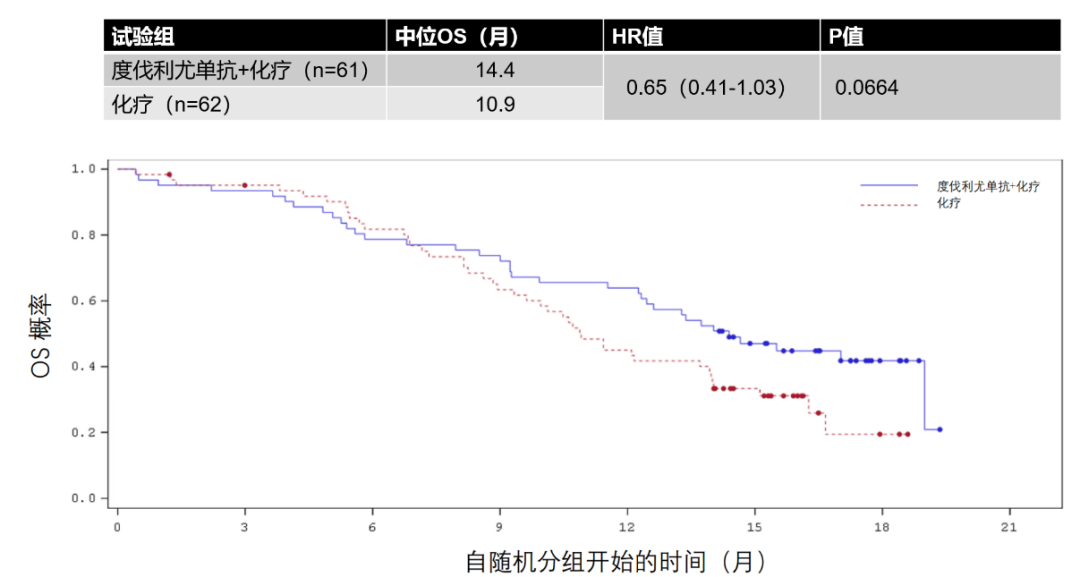
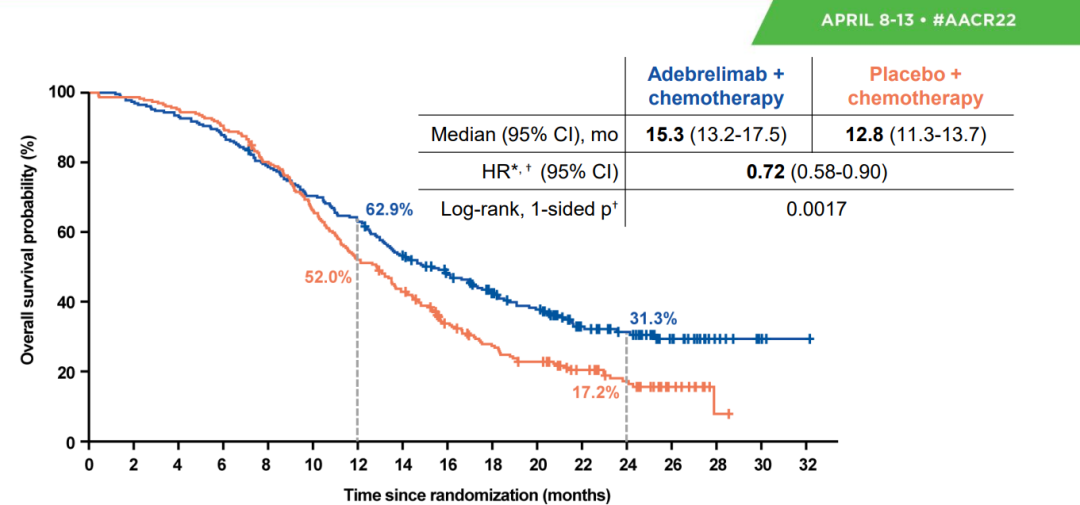
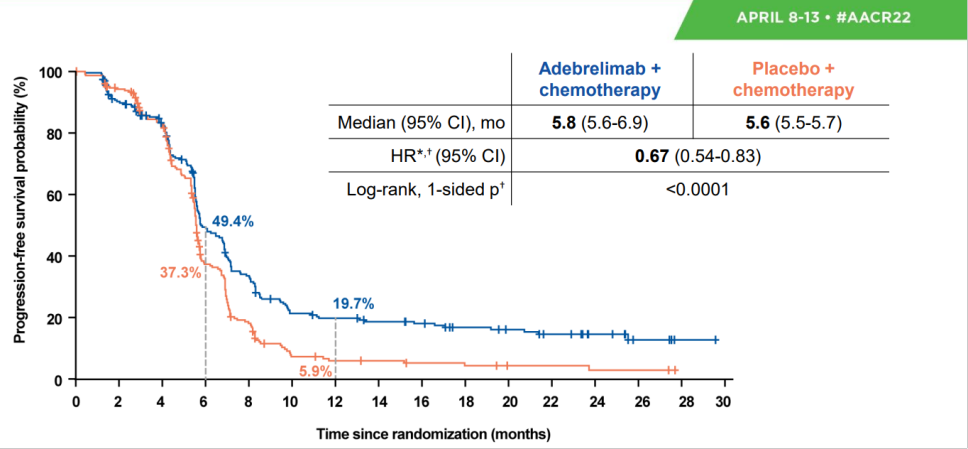
图5 CAPSTONE-1研究PFS结果
阿得贝利单抗联合化疗在中国人群中具有良好的安全性。免疫治疗更为关注的是irAEs。irAE的判定需要研究者进行鉴别诊断,不同研究irAE的鉴别诊断标准也不尽相同,同时开放标签试验研究者对于irAE的判定存在偏移。因此,同一研究试验组与对照组irAE的相对关系,更能反映irAE的发生率。阿得贝利单抗联合化疗相较于对照组irAEs的发生率增加更低,仅10.6%。更为重要的是,阿得贝利单抗联合化疗任何AE导致的死亡率更低,仅0.9%,任何AE导致的停药发生率更低,仅5.2%[11]。

图6 ES-SCLC核心研究免疫相关不良反应(irAE)试验组与对照组数据表(仅罗列数据,非头对头研究不可直接比较)
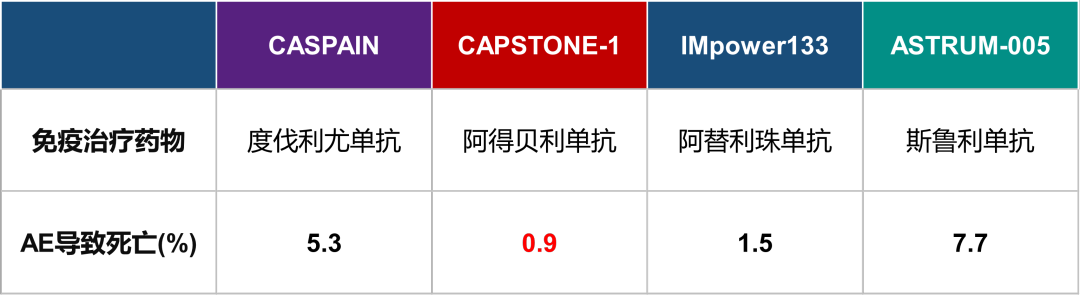
图7 ES-SCLC核心研究中免疫不良反应(AE)导致死亡发生率数据表(仅罗列数据,非头对头研究不可直接比较)
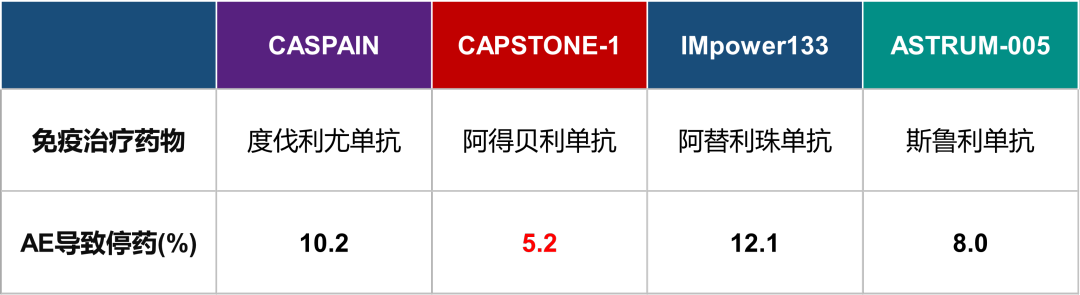
图8 ES-SCLC核心研究中免疫不良反应(AE)导致停药发生率数据表(仅罗列数据,非头对头研究不可直接比较)
结语
路虽远,行则将至;事虽难,做则必成。在Leading PI程颖教授和王洁教授的带领下,在全国47家中心研究者的不懈努力下,CAPSTONE-1研究在中国人群中首次证实,全新PD-L1抑制剂阿得贝利单抗联合化疗可以显著改善中国ES-SCLC患者的生存,且具有良好的安全性,疗效和安全性数据源自中国患者,更能指导中国的临床实践。相信随着阿得贝利单抗纳入CSCO指南I级优选推荐,小细胞肺癌免疫治疗药物的可及性将大幅提高,定能惠及更多中国患者。
参考文献:
[1]https://mp.weixin.qq.com/s/2_HmUpXL6sRChSdPxw7S7w
[2] Venetis K. Eur J Cancer Prev. 2023 Apr 10
[3] Mary E. Keir, et al. Annu Rev Immunol. 2008. 26:677–704
[4] Christoph Goletz, et al. Frontiers in Immunology,2018.01614
[5] 2019 ELCC. Abstract LBA4
[6] Update on PEARL phase III trial of Imfinzi monotherapy in stage IV non-small cell lung cancer. News release. AstraZeneca. December 19, 2022. Accessed December 19, 2022. https://bit.ly/3WsH1Pd
[7] IMpower110: updated OS analysis of atezolizumab vs platinum-based hemotherapy as first-line treatment in PD-L1–selected NSCLC. Presented at: 2020 World Conference on Lung Cance
[8] Vidarsson, et al. frontiers in immunology. 2014 Oct 20;5:520
[9] Gogesch P, et al. Int J Mol Sci. 2021 Aug 19;22(16):8947
[10] Liu R, et al. Antibodies (Basel). 2020 Nov 17;9(4):64.
[11] Wang J, Zhou C, Yao W, et al. The Lancet Oncology. 2022 Jun;23(6):739-747
[12] Cheng Y, et al. 2022AACR. CT038
[13] 2020 ASCO.#9001
[14] J Clin Oncol 2021 Apr 20;39(12)
[15] JAMA 2022 Sep 27;328(12)
[16] Liu SV et al., J Clin Oncol. 2021 Feb 20;39(6)
[17] Paz-Ares L, et al. Lancet. 2019;394(10212):1929- 1939.
[18] 《度伐利尤单抗注射液说明书》2021年7月12日版
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






