学术交流|黄羽薇:SIRT2去乙酰化激活DNA-PK以通过非同源末端连接促进DNA双链断裂修复
2024-01-13 医悦汇 医悦汇 发表于陕西省
在本研究中,研究者揭示了通过SIRT2去乙酰化激活DNA-PK的调控步骤,该步骤可以促进DNA-PKcs定位到DSBs并与Ku相互作用,从而通过NHEJ促进DSB的修复。
编者按:DNA双链断裂(DSB)具有很强的细胞毒性,必须对其进行修复才能保持基因组的完整性。本期文献内容由吉林大学基础医学院辛颖教授课题组黄羽薇分享肿瘤治疗相关领域及病理生物学研究领域最新进展,以供交流!
研究背景
DNA双链断裂(DSB)具有很强的细胞毒性,必须对其进行修复才能保持基因组的完整性。DSBs的发生与多种因素有关,包括电离辐射(IR)、化学暴露、活性氧(ROS)等。非同源末端连接(NHEJ)是DSBs修复的主要途径,在整个细胞周期都可以发生,它是通过直接连接断裂的DNA末端进行DSBs修复。NHEJ功能障碍可导致染色体易位和端粒融合,从而诱发癌症、免疫缺陷和多种人类综合征。
DNA依赖性蛋白激酶(DNA-PK)由DNA-PK催化亚基(DNA-PKcs)和Ku70/Ku80异源二聚体组成,并在NHEJ修复途径中起作用。DSBs发生后,Ku70/Ku80异源二聚体可以识别并组装到DSB末端,招募DNA-PKcs形成DNA-PK全酶。然后,DNA-PK招募并激活Artemis核酸内切酶进行DNA末端加工。最后,DNA连接酶IV与XRCC4和XLF相互作用形成复合物,进一步结合并催化断裂DNA末端的连接。XRCC4和XLF (PAXX)的类似物可以通过稳定染色质上参与NHEJ的各成员,以促进该途径发挥修复功能。
DNA-PKcs与DNA上的Ku70/80异源二聚体的相互作用可能通过构象变化导致其激活。一旦被激活,DNA-PKcs就会发生自身磷酸化,并使一些下游底物发生磷酸化,包括Ku70/Ku80、XRCC4、XLF、DNA连接酶IV、Artemis、PNKP和H2AX。DNA-PKcs有多个可以发生磷酸化的位点,包括丝氨酸2056 (S2056)簇[2023-2056]、苏氨酸2609 (T2609)簇[2609-2647]等。除了构象变化可能导致DNA-PKcs激活外,它还受表皮生长因子受体(EGFR)、Akt、异染色质蛋白1β (HP1β)和CK2的调控。
SIRT2是Sirtuin家族的一种NAD依赖性去乙酰化酶,可调节多种生物过程,包括基因组维稳、衰老、肿瘤发生和新陈代谢。缺失Sirt2的小鼠会罹患乳腺癌、肝癌和其他癌症,这表明SIRT2具有抗肿瘤作用。此外,SIRT2突变可以降低其维持基因组完整性的活性。所以,SIRT2抗肿瘤作用的可能机制之一是参与基因组维稳。SIRT2可通过乙酰化的ATRIP和CDK9诱导复制应激反应(RSR)。SIRT2还可以通过BARD1去乙酰化和RPA70与RAD51募集到DSBs促进BRCA1-BARD1异源二聚体形成,进而促进同源重组的发生,除此以外,SIRT2还可以促进核苷酸切除修复(NER)。然而,SIRT2在NHEJ中的作用尚未确定。
在本研究中,研究者揭示了通过SIRT2去乙酰化激活DNA-PK的调控步骤,该步骤可以促进DNA-PKcs定位到DSBs并与Ku相互作用,从而通过NHEJ促进DSB的修复。本文研究结果阐明了SIRT2介导的去乙酰化激活DNA-PK的机制,以及NHEJ是如何启动DSBs修复的。此外,抑制SIRT2可提高肿瘤中放射治疗的效果。
研究结果
结果一:SIRT2去乙酰化酶活性通过NHEJ促进DNA双链断裂的修复
为了确定SIRT2在DSB修复中的作用,研究者检测了由CRISPR/Cas9产生的HCT116 SIRT2野生型(WT)和敲除型(KO)细胞对电离辐射(IR)和喜树碱(CPT)的敏感性。实验结果与用DNA-PK抑制剂(NU7441)处理的细胞结果相似,与WT细胞相比,HCT116 SIRT2 KO细胞对IR和CPT敏感性高(图1A,B)。SIRT2-FLAG WT的表达可以恢复HCT116 SIRT2 KO细胞对IR和CPT的高敏感性,但催化失活的SIRT2-FLAG H187Y不能恢复其敏感性,这表明SIRT2去乙酰化酶活性对DSBs的反应很重要。此外,与SIRT2 KO细胞或NU7441处理的细胞相比,用NU7441处理HCT116 SIRT2 KO细胞对IR和CPT的敏感性没有明显升高,这意味着SIRT2和DNA-PKcs在响应DSBs的反应中通过相同的途径起作用。
为了直接确定SIRT2是否在NHEJ修复DSB中有与DNA-PKcs类似的作用,研究者在整合EJ5 NHEJ GFP报告底物的U2OS细胞中检测了SIRT2缺失情况,其中I-SceI核酸内切酶的表达会产生DSB,当DSB被NHEJ修复后,GFP表达恢复 (图1C)。与非靶向(NT) siRNA对照相比,这些细胞中的SIRT2缺失明显损害了NHEJ(图1D, E)。此外,siRNA抗性的SIRT2-FLAG WT而非SIRT2-flag H187Y的表达可以使NHEJ恢复到对照组水平,这表明SIRT2去乙酰化酶活性促进了NHEJ的修复。与此相同的是,在整合了lac操作符重复序列的 U2OS 报告细胞中,SIRT2 的缺失破坏了内源 DNA 连接酶 IV 与mCherry-LacI-FokI内切酶诱导的 DSB 的结合,SIRT2-FLAG WT可以有效地恢复这种结合,但H187Y则不能 (图1F, G)。此外,缺失SIRT2减少了Artemis和XRCC4(分别在S516和S260位点磷酸化)定位于IR诱导的病灶和Fok1诱导的DSBs。SIRT2-FLAG WT的表达有效地恢复了Artemis S516磷酸化和XRCC4 S260磷酸化对Fok1诱导的DSB的定位,但H187Y的表达不能。总之,这些数据证明了SIRT2去乙酰化酶活性促进NHEJ。
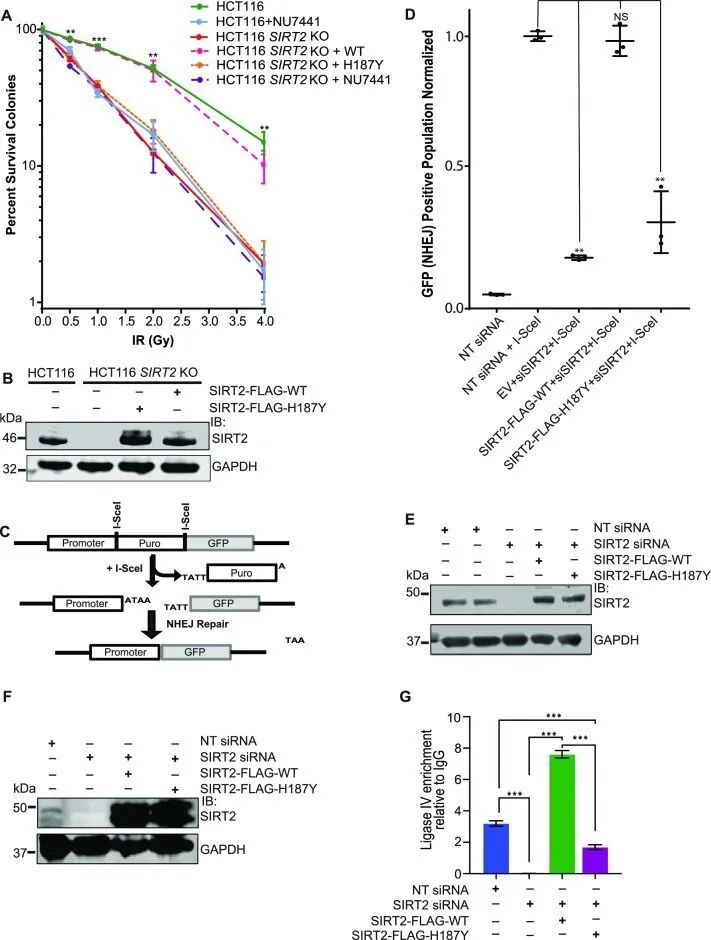
图1
结果二:SIRT2与DNA-PKcs复合物相互作用
为了鉴定NHEJ修复中SIRT2的潜在底物,研究者从HCT116细胞中免疫纯化了SIRT2,并对其进行了质谱分析,结果显示NHEJ修复激酶DNA-PKcs富集(图2A)。在HCT116和HeLa细胞中,通过co-IP验证了SIRT2和DNA-PKcs的内源性相互作用(图2B, C)。无论IR是否存在(图2C),这种相互作用都没有明显变化。此外,在溴化乙啶(EtBr)存在的情况下,这种相互作用也得以保持。EtBr可以插入DNA,并破坏依赖于DNA存在的蛋白质-蛋白质相互作用(图2C)。此外,尽管SIRT2与DNA-PKcs发生co-IP,但无论在IR处理之前还是之后,它都不会与HeLa细胞中表达的Ku80-GFP发生co-IP (图2D)。总之,这些结果表明SIRT2与DNA-PKcs特异性地相互作用,并且这种相互作用不依赖于DNA损伤、DNA结合、细胞周期或DNA- PKcs与Ku的复合物在DNA损伤位点的表达。
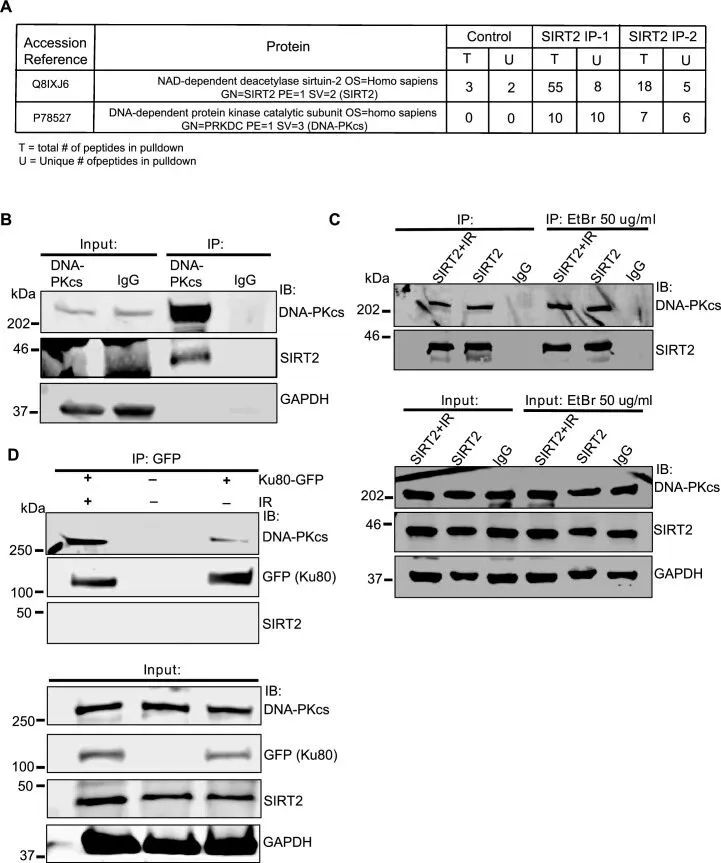
图2
结果三:在DNA损伤反应中SIRT2使DNA-PKcs去乙酰化
为了确定SIRT2是否能使DNA-PKcs去乙酰化,研究者使用纯化的乙酰化DNA-PKcs、SIRT2-FLAG WT和H187Y以及含有或不含有烟酰胺(sirtuin活性抑制剂)的NAD+,进行了体外去乙酰化实验。SIRT2-FLAG WT使DNA-PKcs去乙酰化,而不是H187Y使其去乙酰化,并且烟酰胺可以抑制去乙酰化(图3A)。为了确定SIRT2是否会使细胞内源性DNA-PKcs去乙酰化,研究者用SIRT2-FLAG WT或H187Y转染的HeLa细胞,并使用或不用烟酰胺处理细胞。SIRT2-flag WT可以使细胞中的内源性DNA-PKcs去乙酰化,但H187Y不能,而且该过程可以被烟酰胺抑制(图3B, C),这证实了SIRT2使细胞中的DNA-PKcs去乙酰化。此外,用IR处理的细胞也会导致DNA- PKcs发生类似程度的去乙酰化(图3B, C),这表明在DNA损伤时,DNA-PKcs可能会被SIRT2去乙酰化。为了确定SIRT2是否会在DNA损伤反应中使内源性DNA-PKcs去乙酰化,研究者在转染SIRT2或NT siRNA的HeLa细胞中,在有或无IR处理下,检测了DNA- PKcs的乙酰化水平。内源性DNA-PKcs在对照条件下被乙酰化,在IR处理下发生去乙酰化,SIRT2缺失可以恢复IR导致的DNA-PKcs去乙酰化 (图3D, E)。这表明DNA-PKcs在细胞中被乙酰化,随后在DNA损伤反应中被SIRT2去乙酰化。据报道,SIRT6可能通过支架功能稳定染色质中的DNA-PKcs,并促进其在NHEJ中的活性。为了确定SIRT6是否在DNA-PKcs去乙酰化中起作用,研究者在过表达SIRT6-FLAG WT的HeLa细胞中检测了DNA-PKcs乙酰化情况。与SIRT2的结果相反,过表达SIRT6-FLAG,内源性DNA-PKcs乙酰化并没有减少(图3F),这表明DNA-PKcs去乙酰化是由SIRT2特异性介导的,而不是SIRT6。
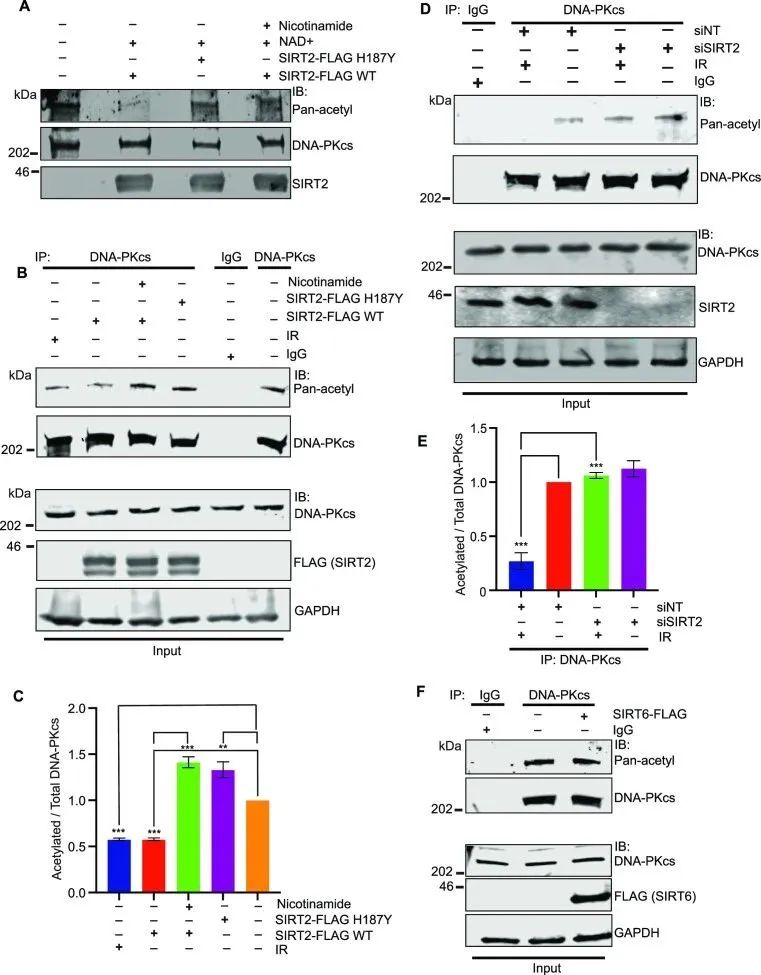
图3
结果四:SIRT2去乙酰酶活性促进DNA-PKcs定位到DNA损伤位点并与Ku相互作用
为了确定SIRT2是否有助于DNA-PKcs定位到DNA损伤位点,研究者在稳定转染了DNA- PKcs-GFP的U2OS细胞中进行了激光微照射实验。SIRT2的耗竭延迟了激光微照射诱导的DNA-PKcs-GFP向DNA损伤位点的早期募集(图4A-B和4E)。此外,在稳定转染人DNA-PKcs-GFP的CHO V3细胞中,SirReal2抑制SIRT2后,也会抑制激光微照射诱导的DNA-PKcs-GFP向DNA损伤位点上的募集(图4C和F),这表明SIRT2去乙酰化酶活性促进DNA-PKcs募集到DNA损伤位点。另外,用SirReal2抑制SIRT2并不影响激光微照射后通过γH2AX染色测定DNA损伤的程度(图4D)。
已有研究表明,DNA-PKcs与Ku在DNA损伤位点形成复合物。为了确定SIRT2是否促进了DNA-PKcs和Ku之间的相互作用,研究者在HCT116 SIRT2 WT和KO细胞中进行了co-IP实验。实验结果显示,HCT116 SIRT2 WT细胞中,IR处理后DNA-PKcs与Ku70-GFP的co-IP增加(图4G)。然而,在HCT-116 SIRT2 KO细胞中,IR导致的DNA-PKcs与Ku70-GFP相互作用的增加被削弱(图4G, H)。SIRT2-FLAG WT的表达可以恢复IR诱导的DNA-PKcs与Ku70-GFP相互作用的损伤(图4H),但SIRT2-FLAG H187Y的表达不可以,这表明SIRT2去乙酰化酶活性促进了DNA-PKcs与Ku70在应对DNA损伤时的相互作用。

图4
结果五:SIRT2的去乙酰化作用可以诱导DNA-PK激活和信号传导
为了确定SIRT2是否在DNA损伤时直接诱导DNA-PK的激活,研究者检测了IR处理后U2OS SIRT2 WT和KO细胞中的DNA-PKcs在丝氨酸2056 (pS2056)的自磷酸化水平。与WT细胞相比,IR处理后,U2OS SIRT2 KO细胞中DNA-PKcs pS2056明显受损,但γH2AX对IR反应的聚焦诱导不明显(图5A, B),这一过程可通过SIRT2-FLAG WT的表达而恢复,但是H187Y无法恢复该过程 (图5C-E),这提示SIRT2去乙酰化酶活性促进DNA-PK的激活。与这些发现一致的是,通过western blot分析,与WT细胞相比,HCT116 SIRT2 KO细胞中IR诱导的DNA-PKcs S2056自磷酸化水平有所降低,但总DNA-PKcs水平没有降低(图5F)。SIRT2-FLAG WT能充分地恢复这种损伤,但H187Y不能(图5F)。此外,用DNA-PK抑制剂NU7441处理表达SIRT2-FLAG WT的HCT116 SIRT2 KO细胞可以抑制这种恢复效果。总的来说,这些结果表明在IR处理下,SIRT2去乙酰化酶活性以一种DNA-PK催化活性依赖的方式诱导DNA-PK的激活。
为了确定SIRT2是否在DNA-PK依赖性信号传导中起作用,研究者检测了IR处理下, HCT116 SIRT2 WT和KO细胞中DNA-PK底物的磷酸化水平。与WT细胞相比,IR处理后的HCT116 SIRT2 KO细胞中的Artemis丝氨酸516磷酸化 (pS516)和XRCC4的丝氨酸260磷酸化(pS260)被破坏(图5G)。在HCT116 SIRT2 KO细胞中,观察到DNA-PKcs在丝氨酸2056处发生自磷酸化,还有通过SIRT2-FLAG的表达,而不是SIRT2-FLAG-H187Y的表达,可以恢复Artemis S516和XRCC4 S260的DNA-PK依赖性磷酸化(图5G)。总的来说,结合研究者的数据发现SIRT2与DNA-PKcs相互作用并使其去乙酰化,这些结果支持SIRT2使DNA-PKcs去乙酰化导致DNA-PK的激活和信号传导。
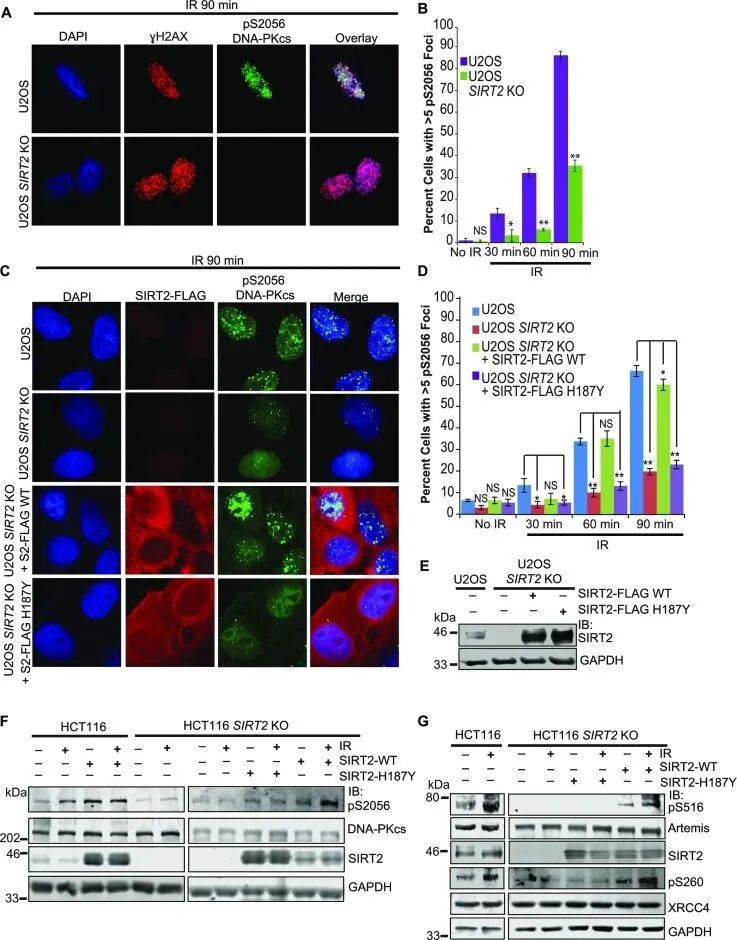
图5
结果六:SIRT2抑制剂可提高肿瘤中放射治疗的效果
研究者观察发现,癌细胞中SIRT2缺乏导致其辐射敏感性增加,并且可以通过SIRT2-FLAG WT来恢复其敏感性,但H187Y不可以。这表明SIRT2可能是一个有希望的治疗靶点,并且可以靶向抑制SIRT2的活性以增加癌细胞的辐射敏感性。据报道,SIRT2抑制剂对多种类型的癌症具有抗增殖活性;然而,SIRT2抑制剂可能对哪些特定类型的癌症治疗最有效,其具体的细胞环境如何等问题尚不明确。事实上,与SIRT2缺陷类似,用AGK2(一种选择性SIRT2抑制剂)处理的HCT116细胞对IR敏感(图6A)。用DNA-PK抑制剂NU7441处理细胞,引起了类似水平的辐射敏感性增加,并且联合使用AGK2和NU7441处理细胞并没有进一步提高细胞的辐射敏感性(图6A),这证实了SIRT2和DNA-PKcs通过相同途径调控细胞的辐射抗性。
为了确定SIRT2抑制剂是否可以使辐射抗性的肿瘤对放射治疗敏感,研究者在雌性Balb/cnu/nu(胸腺)小鼠中使用辐射抵抗的 A549细胞(IRR-A549)进行肿瘤异种移植。结果显示,放疗并没有显著抑制辐射抗性肿瘤的生长(图6B)。然而,与单独放疗相比,AGK2与放疗联合治疗的小鼠肿瘤的生长明显受到抑制(图6B),这表明SIRT2抑制剂可以使辐射抗性肿瘤重新对辐射敏感。与使用其他类型肿瘤的研究结果一致,单独使用AGK2治疗的小鼠也显著抑制了肿瘤生长(图6B),但比AGK2与放疗联合治疗的抑制生长效果要差。与对照组相比,经AGK2处理的小鼠体重无显著差异(图6C)。
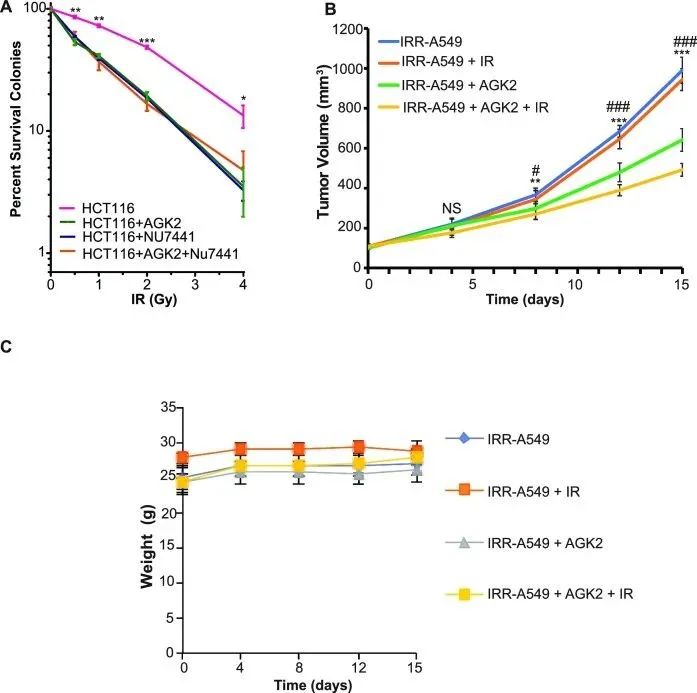
图6
研究结论
SIRT2通过去乙酰化激活DNA-PK,促进DNA-PKcs定位到DSBs并与Ku相互作用,从而促进NHEJ的DSB修复。SIRT2抑制剂可以增加肿瘤细胞的辐射敏感性。
原文出处:
Head PE, Kapoor-Vazirani P, Nagaraju GP, Zhang H, Rath SK, Luong NC, Haji-Seyed-Javadi R, Sesay F, Wang SY, Duong DM, Daddacha W, Minten EV, Song B, Danelia D, Liu X, Li S, Ortlund EA, Seyfried NT, Smalley DM, Wang Y, Deng X, Dynan WS, El-Rayes B, Davis AJ, Yu DS. DNA-PK is activated by SIRT2 deacetylation to promote DNA double-strand break repair by non-homologous end joining. Nucleic Acids Res. 2023 Aug 25;51(15):7972-7987. doi: 10.1093/nar/gkad549.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#去乙酰化# #DNA双链断裂# #DNA-PK#
41