NCB:甘波谊/陈俊杰等发现全新细胞死亡类型——双硫死亡
2023-02-07 MedSci原创 MedSci原创 发表于上海
2023年2月7日,MD安德森癌症中心甘波谊教授和陈俊杰教授团队合作在 Nature Cell Biology 发表了题为:Actin cytoskeleton vulnerability to di
2023年2月7日,MD安德森癌症中心甘波谊教授和陈俊杰教授团队合作在 Nature Cell Biology 发表了题为:Actin cytoskeleton vulnerability to disulfide stress mediated disulfidptosis 的研究论文,该研究发现和鉴定了一种全新细胞死亡类型——Disulfidptosis(双硫死亡)。这是继去年发现铜死亡之后,又一种新的细胞死亡形式。详细见:Science:细胞新的死亡方式——铜死亡被发现

值得注意的是,这篇论文是甘波谊教授研究组2020年在 Nature Cell Biology 发表的 Cystine transporter regulation of pentose phosphate pathway dependency and disulfide stress exposes a targetable metabolic vulnerability in cancer 论文的课题延续性研究成果。
2020年甘波谊教授研究组及其合作者在 Nature Cell Biology 发文,发现SLC7A11 介导摄入的胱氨酸还原为半胱氨酸过程高度依赖于葡萄糖-戊糖磷酸途径生成的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)。因此葡萄糖饥饿条件下,SLC7A11高表达细胞内NADPH被大量消耗,胱氨酸等二硫化物异常积累,诱发二硫化物应激(disulfide stress)和细胞快速死亡。
然而,这是何种细胞死亡类型以及二硫化物应激触发细胞死亡的机制仍然未知。
在2021年,该团队进一步发现这种死亡系统可能是铁死亡不一样,文章发表在Nature上,详细见:Nature:甘波谊团队发现全新铁死亡防御系统,为癌症治疗提供新靶点
2021年5月12日,美国MD安德森癌症中心甘波谊教授团队在 Nature 期刊发表了题为:DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer 的研究论文。
该研究首次发现定位于线粒体中不依赖于谷胱甘肽(glutathione,GSH)的铁死亡防御系统, 并对癌症治疗有重要提示。
线粒体内膜上的二氢乳清酸脱氢酶(DHODH)在阻止铁死亡中起着重要而以前未知的作用。临床前研究结果表明,靶向DHODH可以恢复铁死亡,由于铁死亡在许多肿瘤中活跃,因此,这项研究表明,可以通过诱导铁死亡,抑制肿瘤生长,为癌症治疗提供了新的靶点。
本次研究团队发现葡萄糖饥饿诱导的SLC7A11高表达癌细胞死亡不属于已知的细胞死亡类型,例如不能被抑制细胞死亡抑制剂恢复(图1a-b)。进一步研究发现,SLC7A11高表达一定程度上恢复了葡萄糖饥饿导致的ATP降低(图1c),表明SLC7A11促进葡萄糖饥饿诱导的细胞死亡不是由于ATP耗竭引起的。二硫化物还原试剂抑制,而硫醇氧化试剂Diamide等则显著增强葡萄糖饥饿条件下SLC7A11导致的细胞死亡(图1d),因而研究者们将这种细胞死亡称为——Disulfidptosis(双硫死亡)。
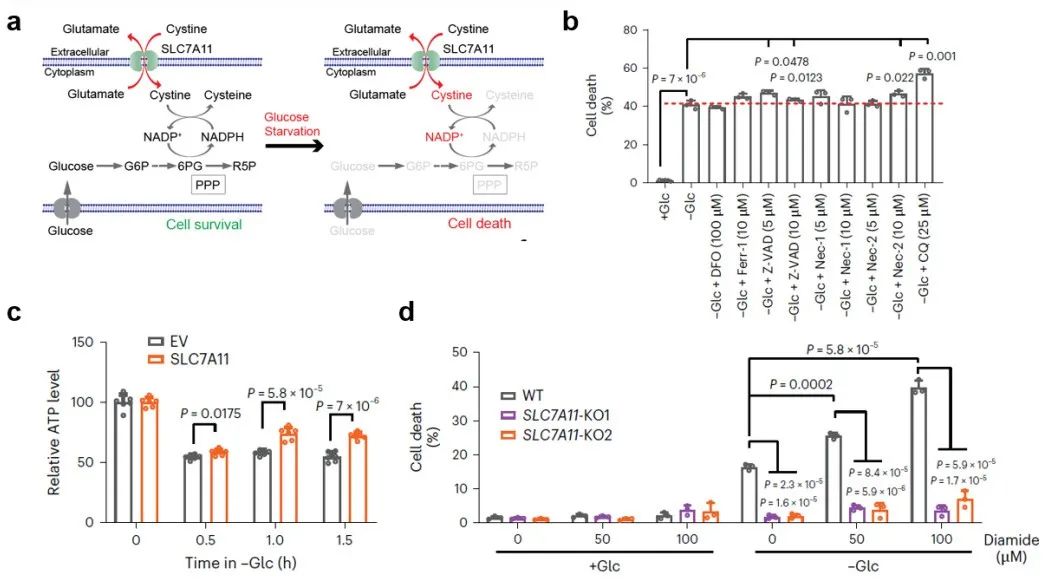 图1:二硫化物应激导致的新型细胞死亡类型
图1:二硫化物应激导致的新型细胞死亡类型为了探究双硫死亡的具体触发机制,研究团队发现葡萄糖饥饿时, SLC7A11高表达的细胞中 NADPH 耗竭和二硫化物应激会诱导某些蛋白上半胱氨酸的巯基之间形成分子间和/或分子内二硫键,进而破坏相应蛋白的活性和功能,造成细胞死亡。于是研究者们在稳定同位素标记条件下应用生物正交化学蛋白质组学策略来量化SLC7A11高表达的UMRC6肾癌细胞中葡萄糖饥饿诱导的二硫键变化(图2a)。结果显示葡萄糖饥饿时二硫键增加最显著的蛋白主要集中在肌动蛋白细胞骨架(actin cytoskeleton)和细胞粘附相关的生物过程或途径(图2b-c)。
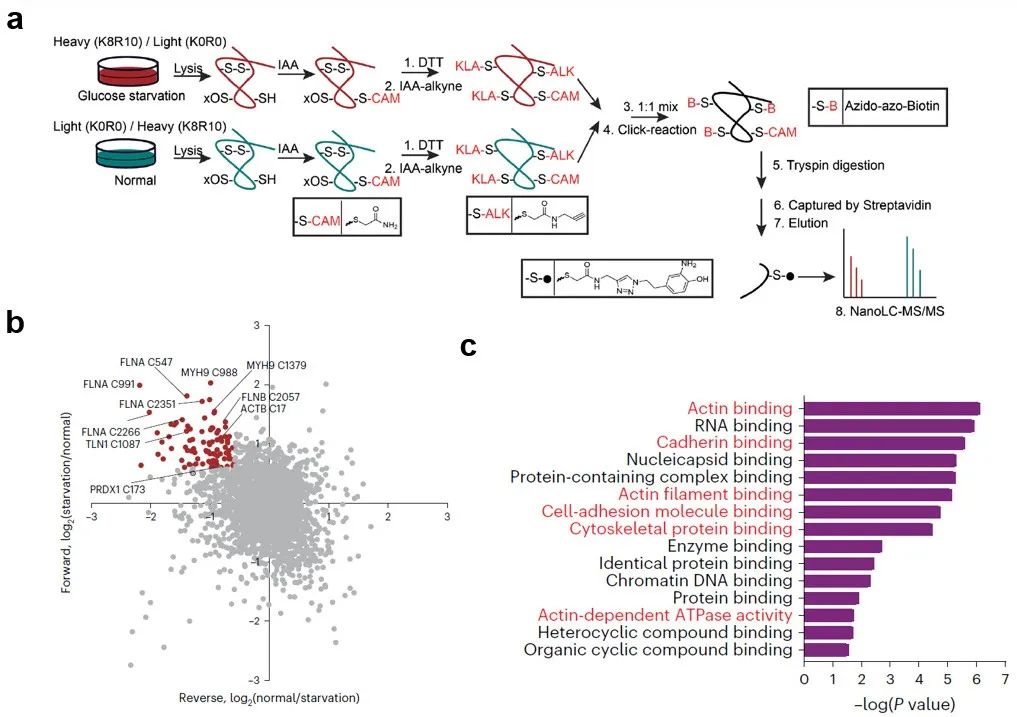 图2:蛋白质谱组学鉴定双硫死亡中二硫键变化
图2:蛋白质谱组学鉴定双硫死亡中二硫键变化已知二硫键会影响蛋白质在非还原条件下的电泳迁移率。研究团队发现,UMRC6细胞在葡萄糖饥饿1小时会显著增加 NADP+/NADPH 比率(即NADPH消耗)(图3a)。在非还原条件下,葡萄糖饥饿2小时后,多种肌动蛋白细胞骨架蛋白出现明显的凝胶迁移阻滞,堆积层附近出现极高分子量条带(图3b),表明这些肌动蛋白细胞骨架蛋白在葡萄糖饥饿下形成多个分子间二硫键。而显著的细胞死亡(大于10%)则发生在4小时以后(图3c),表明了葡萄糖饥饿诱导的这些肌动蛋白细胞骨架蛋白中的二硫键形成不太可能是细胞死亡的次要后果,而可能是由 NADPH 耗竭引起的(图3d)。
接下来研究者们进一步检测双硫死亡过程中肌动蛋白细胞骨架的动态变化。正常培养条件下,肌动蛋白丝(F-actin)主要存在细胞皮层内和组成应力纤维。葡萄糖饥饿引起显著的肌动蛋白丝聚集和细胞收缩。肌动蛋白丝与膜染料的共染色显示葡萄糖饥饿诱导肌动蛋白丝快速收缩,并且在明显的细胞死亡前(4小时)与细胞质膜剥离(图3e)。
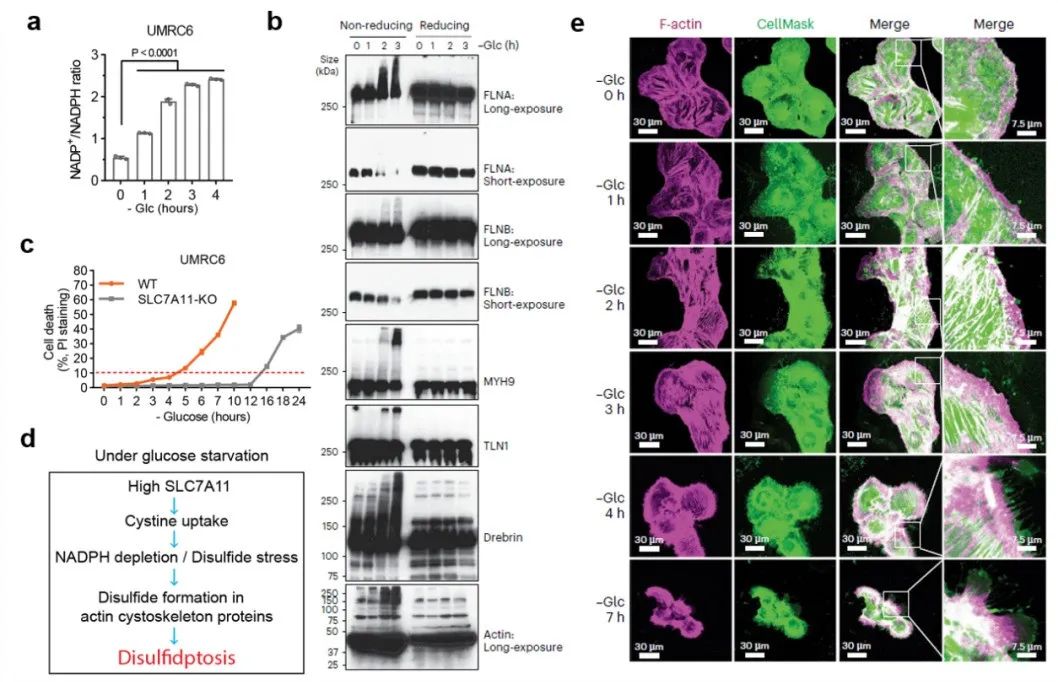
进一步研究表明,NCKAP1缺失并不影响SLC7A11和SLC3A2蛋白水平、胱氨酸摄入或NADP+/NADPH比率,但是减弱了葡萄糖饥饿诱导的二硫键形成、 肌动蛋白骨架收缩以及与细胞质膜的脱离。WRC的一个特点是其5个亚基当中任何一个缺失都会导致整个复合物降解。研究发现,敲除WRC其它亚基也会减缓双硫死亡(图4d)。另外,一般情况下WRC处于抑制状态,其受Rac1激活以促进细胞片状伪足的形成(图4b)。进一步研究表明,Rac1的组成型活性突变体(Rac1 Q61L)的过表达促进细胞片状伪足形成和双硫死亡(图4e-f)。
总之,这些数据表明Rac1-WRC介导的片状伪足形成促进了双硫死亡,这可能是因为片状伪足中的肌动蛋白网络分支为二硫化物应激提供了关键靶点。
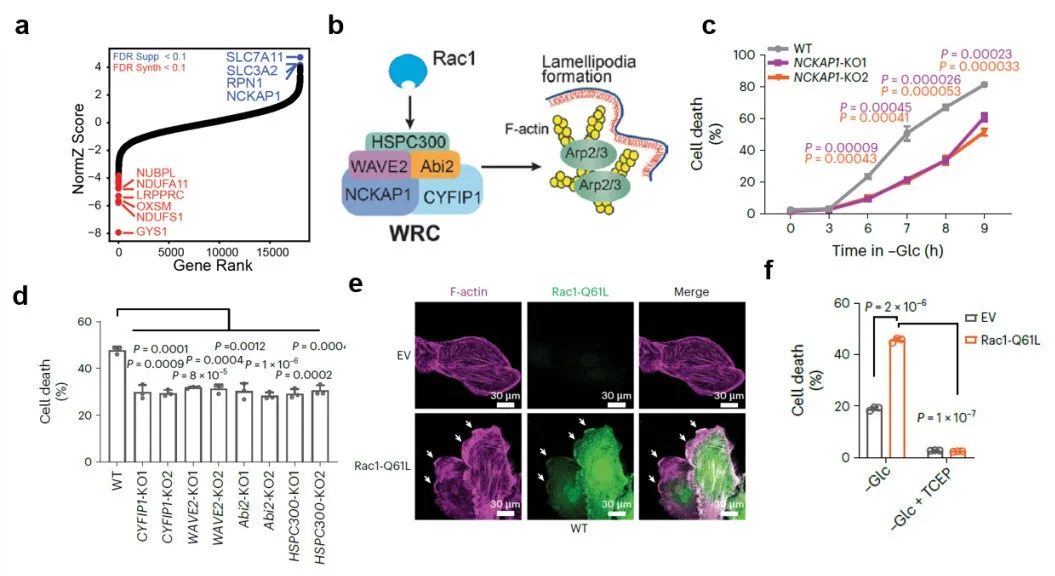 图4:WRC介导的细胞片状伪足促进双硫死亡
图4:WRC介导的细胞片状伪足促进双硫死亡研究发现,葡萄糖转运蛋白GLUT1抑制剂BAY-876和GLUT1/3抑制剂KL-11743能够有效抑制细胞的葡萄糖摄入、进而在SLC7A11高表达癌细胞中造成NADPH消耗、肌动蛋白细胞骨架交联和双硫死亡(图5a-b)。小鼠体内实验证实GLUT抑制剂能够显著抑制SLC7A11高表达的肿瘤生长并诱导肌动蛋白细胞骨架蛋白的异常二硫键交联(图5c-e)。
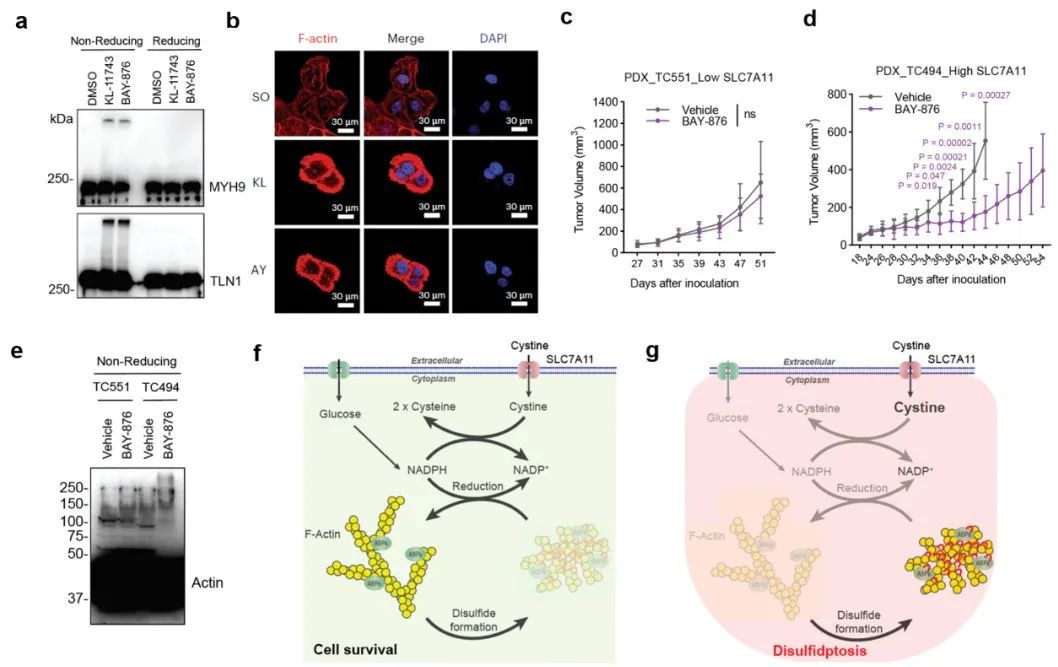
最后,双硫死亡主要是在SLC7A11高表达的癌细胞中被发现,其主要来源于NADPH供应不能满足胱氨酸还原成半胱氨酸过程,进而造成了二硫化物应激(图5f-g)。研究发现,在无葡萄糖的培养基中添加更多的胱氨酸,也会造成SLC7A11低表达的细胞中NADPH过度消耗、诱导肌动蛋白细胞骨架蛋白二硫键交联和细胞骨架收缩,并最终诱发双硫死亡。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#甘波谊#/陈俊杰等发现全新#细胞死亡#类型——#双硫死亡#,又是一个#国自然#的热点话题了。继#铜死亡#以后的新型细胞死亡方式
146