【衡道丨病例】一文了解:食管黏膜下腺导管腺瘤的诊治要点
2023-10-25 衡道病理 衡道病理 发表于上海
食管黏膜下腺导管腺瘤非常罕见,内镜下也没有特异表现,我们将工作中遇到的典型病例进行讨论,旨在提高对其认识,避免误诊。
病例资料
患者男,48岁,患者1月前行肾结石碎石后出现食欲不振,进食量较前减少,具体不详,伴恶心、呕吐,呕吐物为胃内容物,未见鲜血及血凝块,无腹痛、腹胀,无反酸、烧心,无胸闷、憋气,无发热、寒战,无排气排便停止,遂就诊于当地医院,完善胃镜提示糜烂性胃炎伴胆汁反流、食管占位,当时予以输液治疗,食欲不振及恶心、呕吐症状好转出院,现为行内镜下治疗,遂来我院门诊,完善超声内镜提示:食管低回声隆起病变,来源于粘膜下层,考虑NET可能。遂以“食管肿物”收入我科病房。患者自发病以来,神志清,精神可,饮食及睡眠尚可,近1月体重下降约5kg。
辅助检查
超声内镜提示:食管低回声隆起病变,来源于粘膜下层,考虑NET可能。
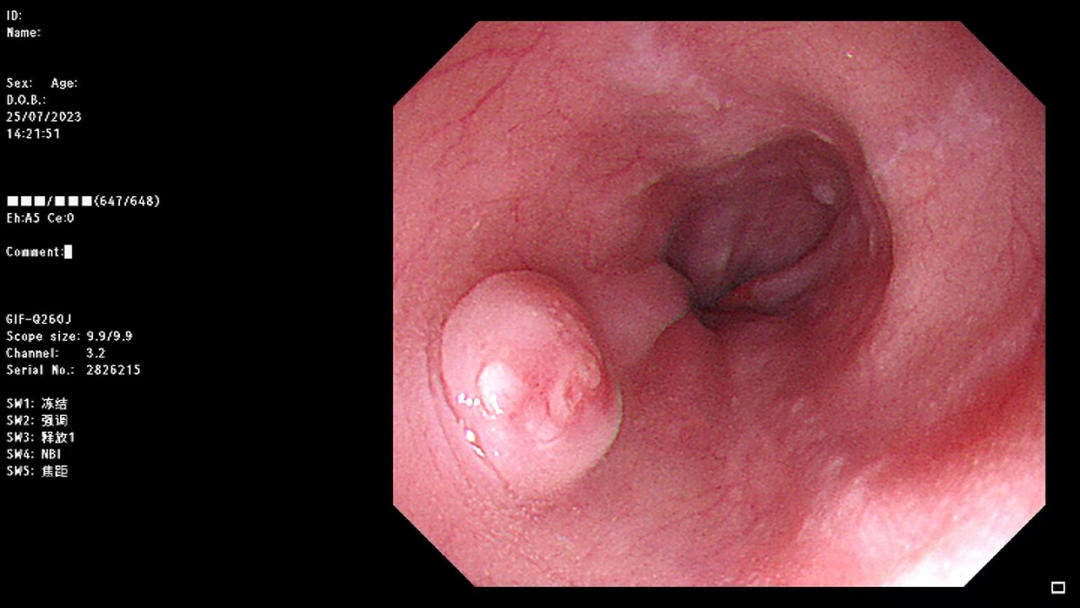
大体特征
(食管)粘膜组织一块,面积3.0cm*2.0cm,粘膜见一灰白隆起,体积0.8cm*0.7cm*0.5cm,距离最近切缘0.3cm。
病理形态镜下表现:
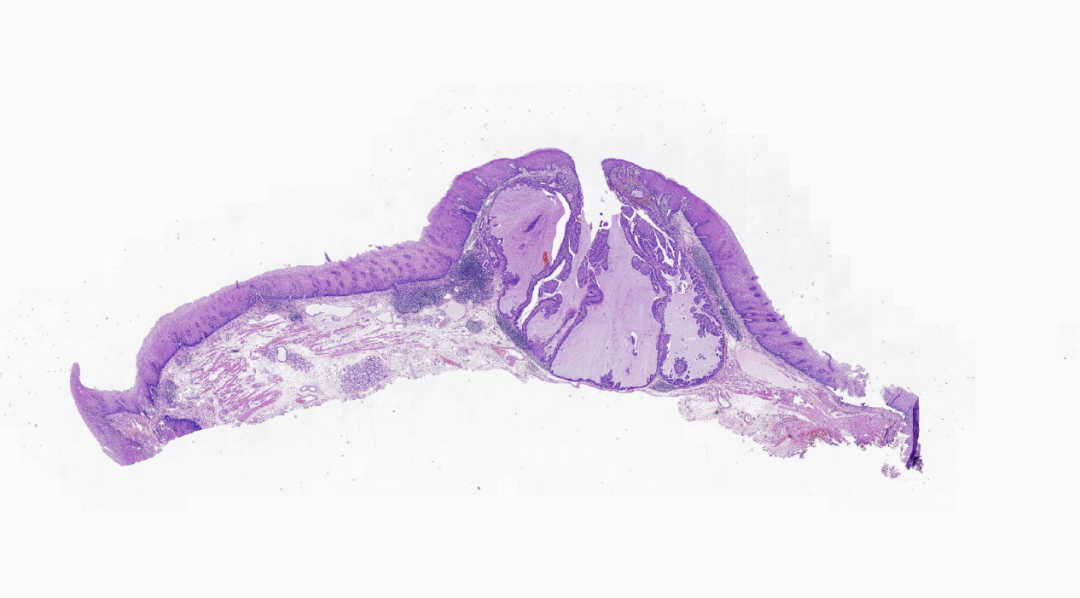
图1.ESD切除标本,鳞状上皮黏膜下病变,边界清楚,可见多个扩张的管腔
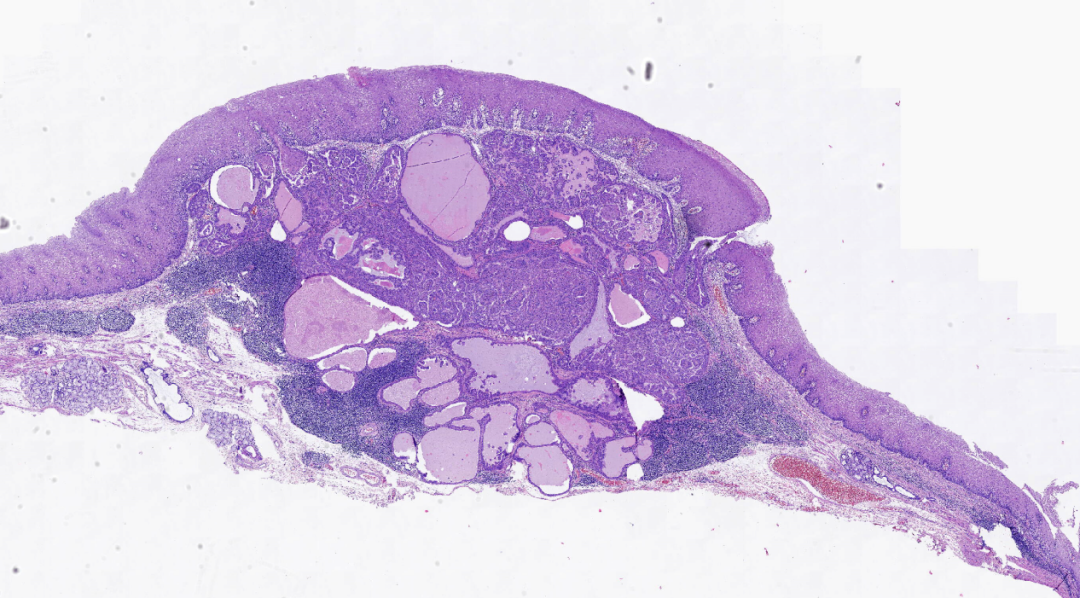
图2.肿瘤边界清楚,周围可见较多淋巴细胞浸润,部分管腔内可见较多分泌物,部分管腔内肿瘤乳头状增生充满管腔
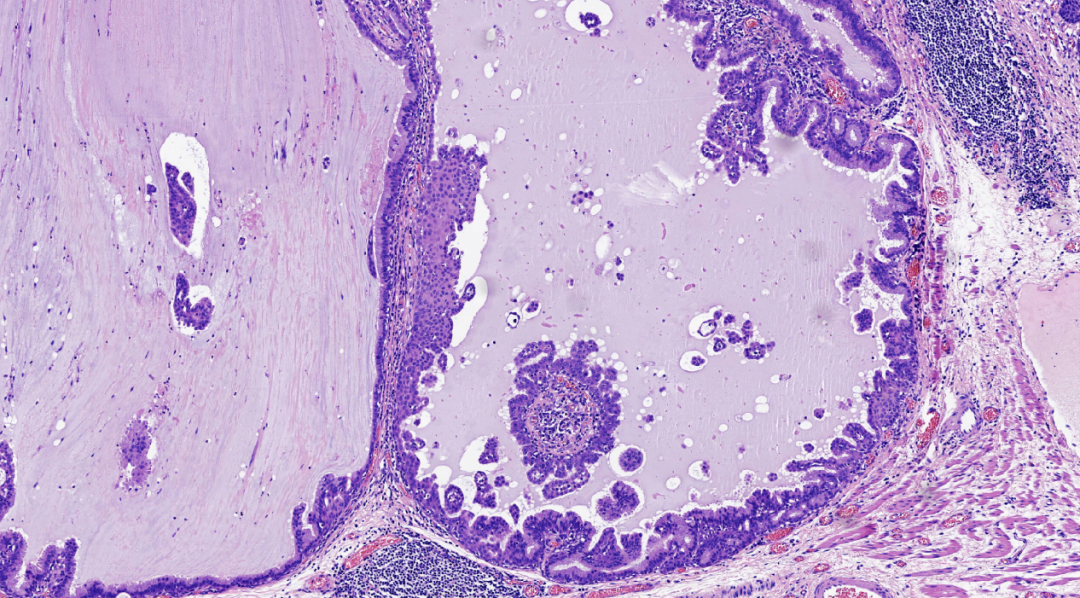
图3.管腔内上皮增生呈乳头状突入腔内,部分上皮脱落在腔内
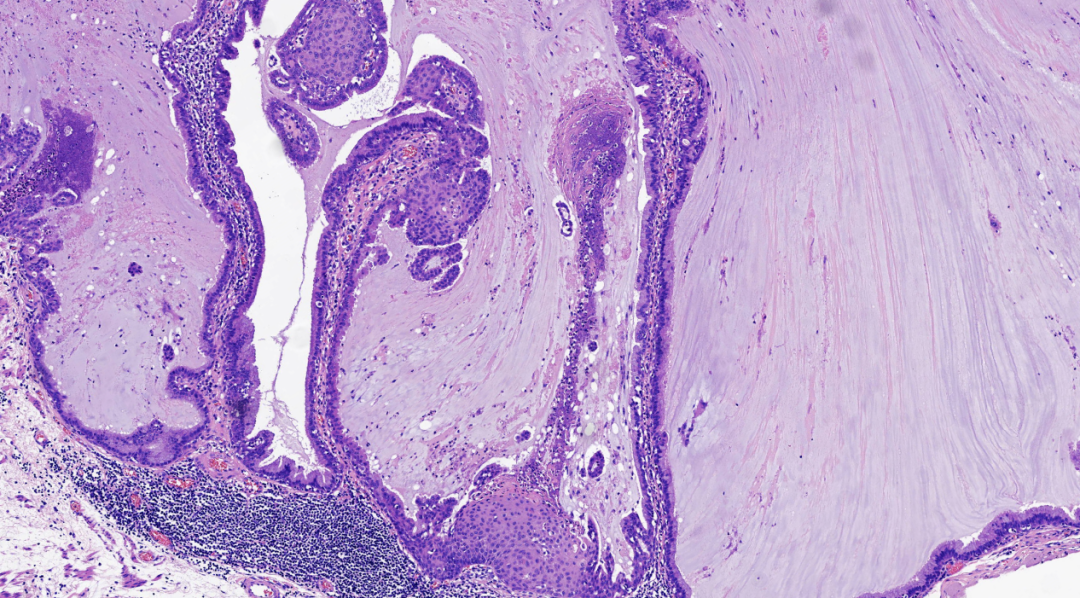
图4.局部上皮为双层,内层为柱状腺上皮,局部上皮增生并鳞化
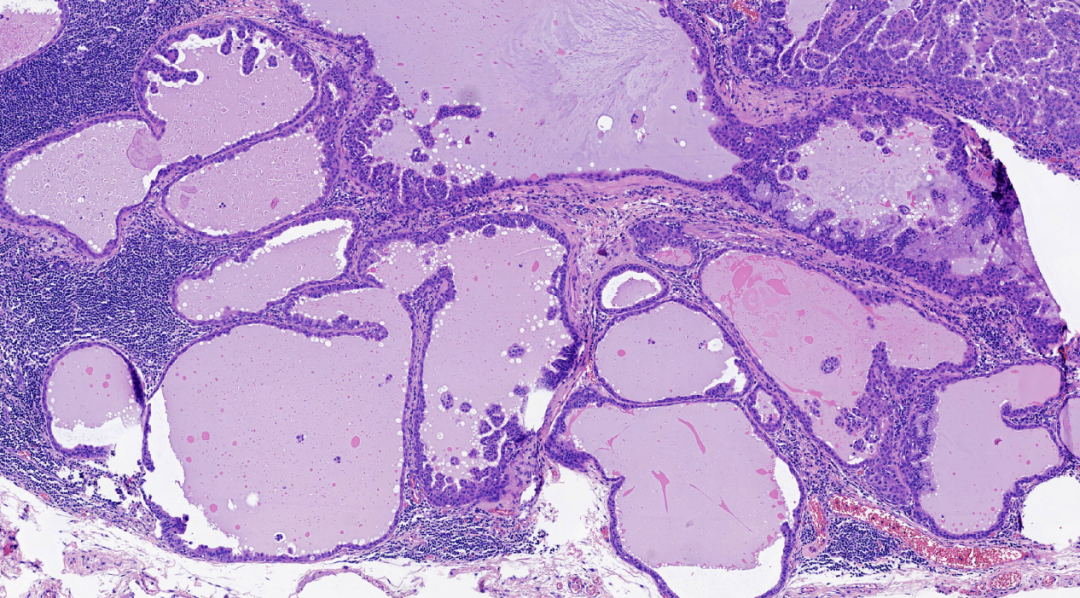
图5.管腔内上皮乳头状或小簇状增生,局部上皮增生旺盛(右上角),间质内大量淋巴细胞浸润
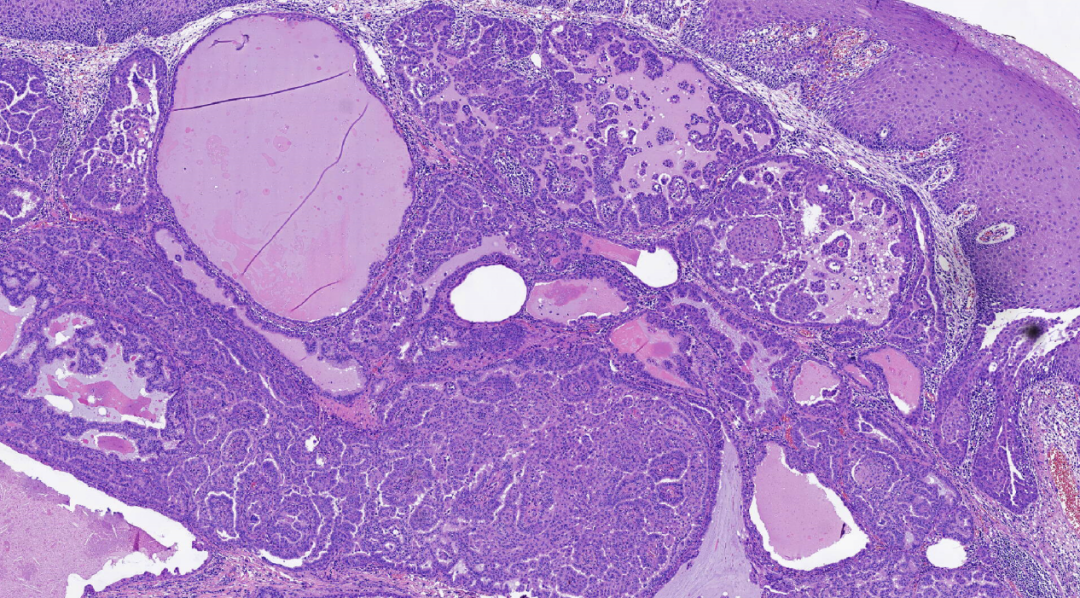
图6.上皮乳头状增生,充满管腔,局部可见鳞化,个别管腔内衬薄层上皮,腔内可见嗜酸性分泌物
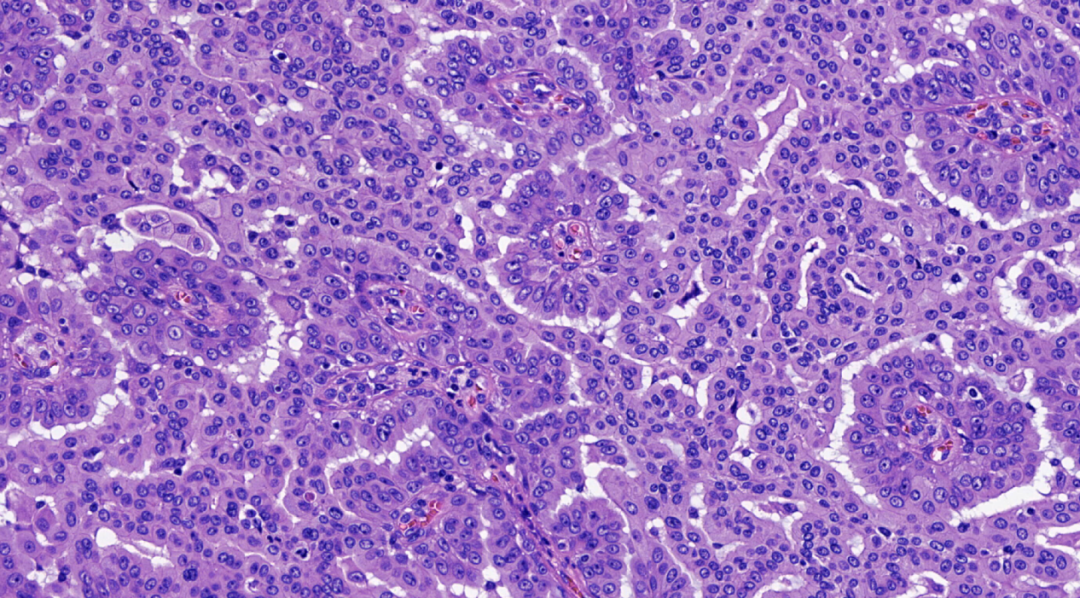
图7.具有纤维血管轴心的乳头结构,细胞形态温和,未见核分裂象,细胞核圆形、椭圆形,可见小核仁,胞浆嗜酸或嗜双色
免疫组化
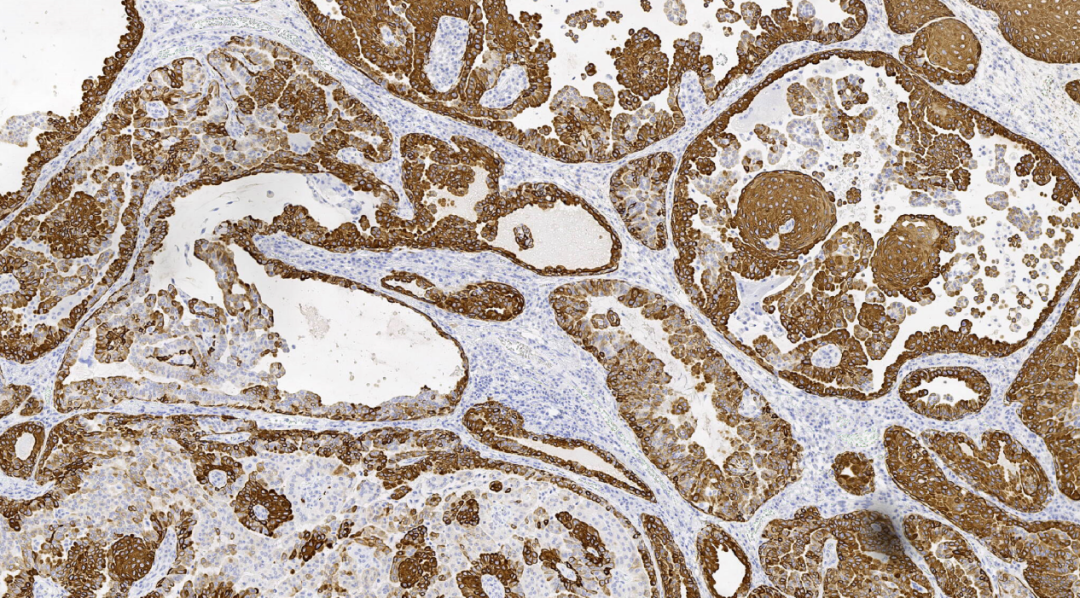
图8.CK5/6阳性
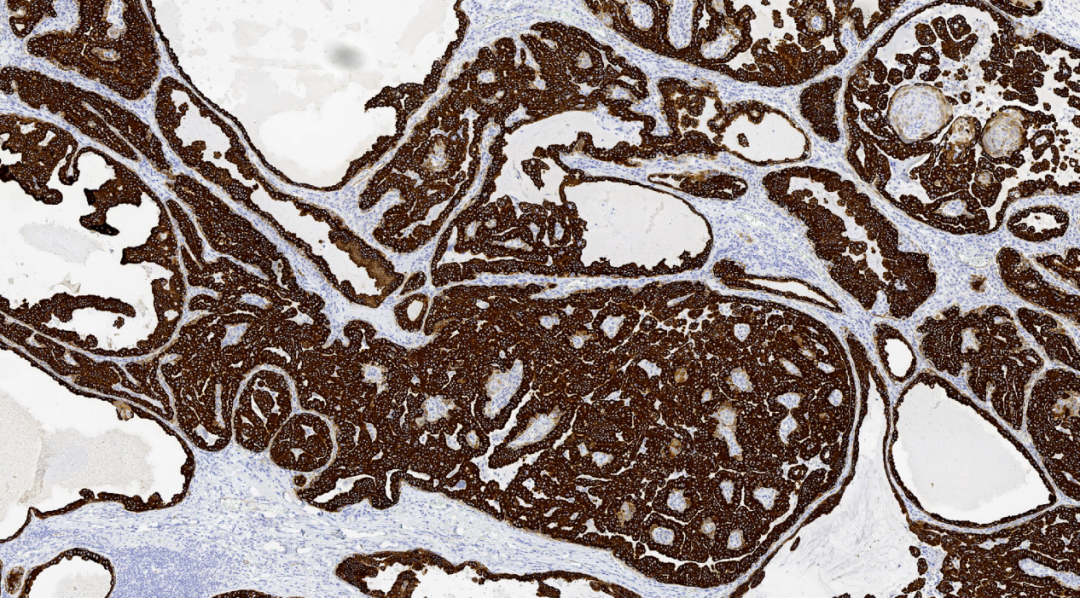
图9.CK7阳性
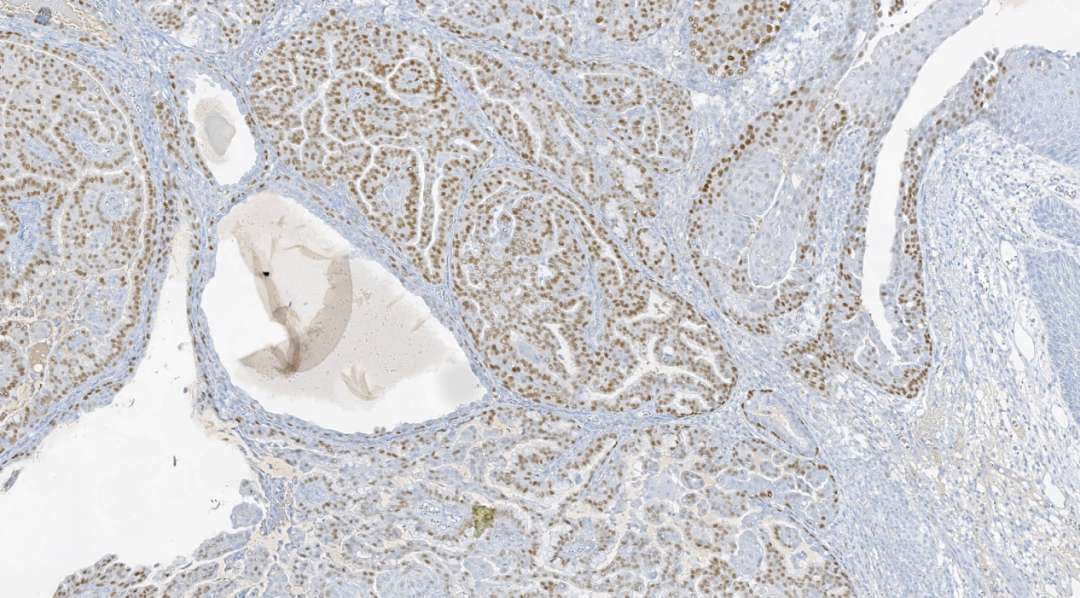
图10.SOX10阳性
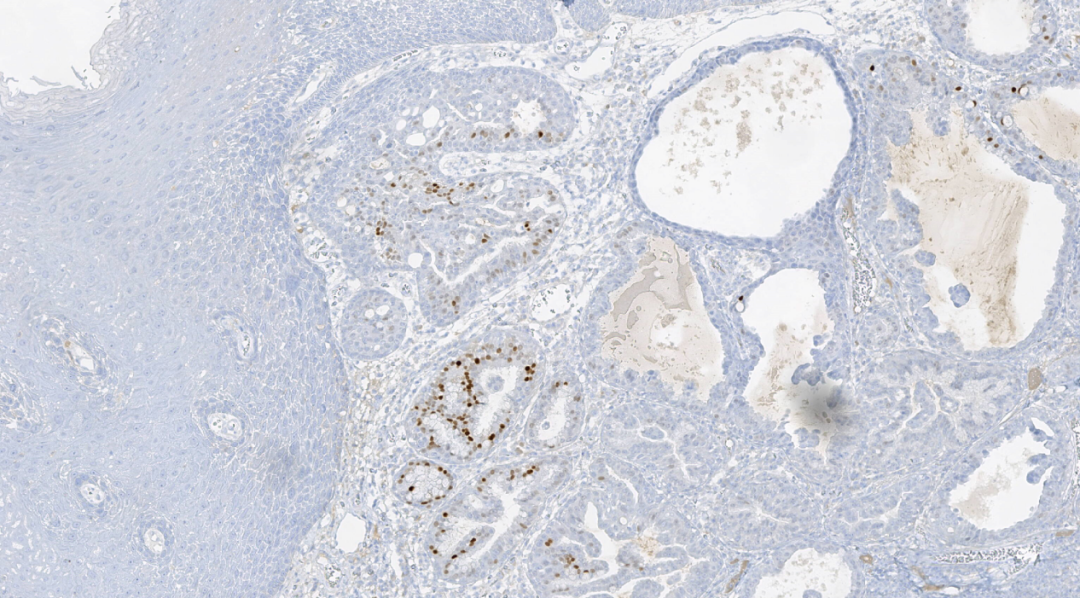
图11.NKX3.1局部阳性
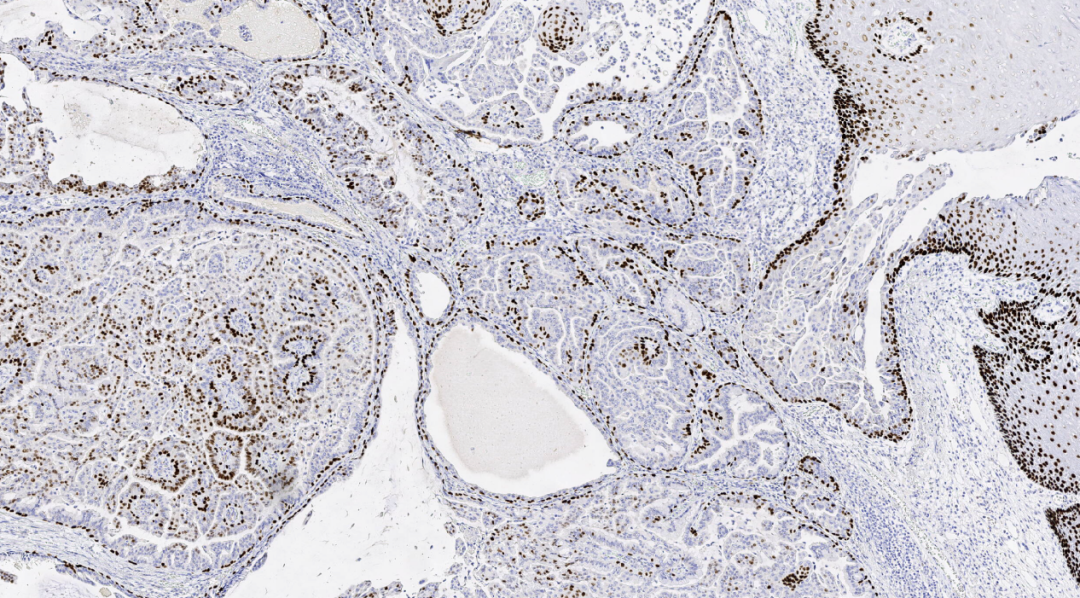
图12.P63基底细胞阳性
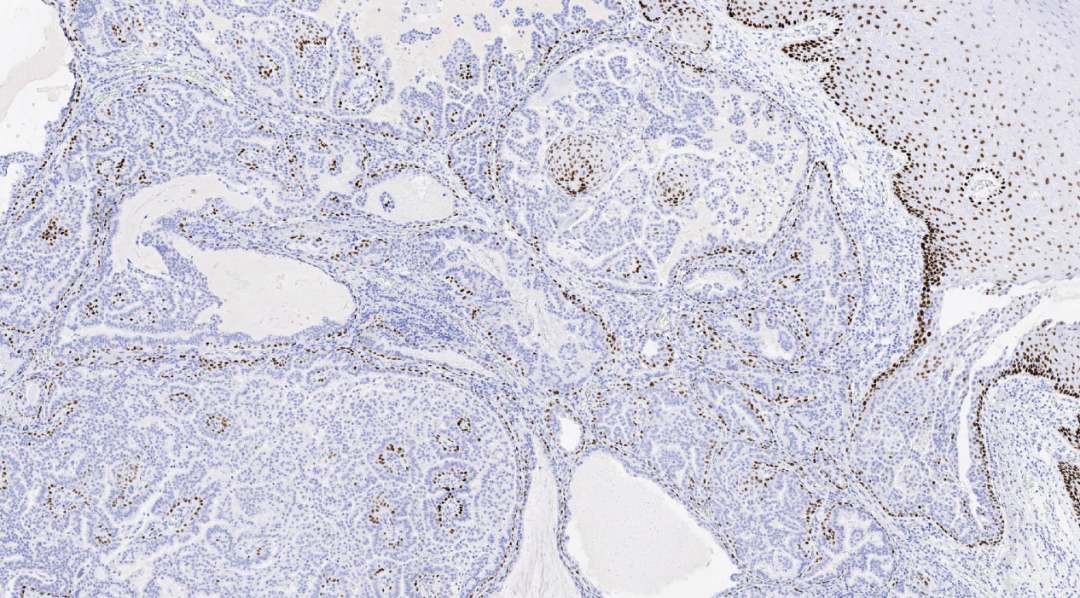
图13.P40基底细胞阳性
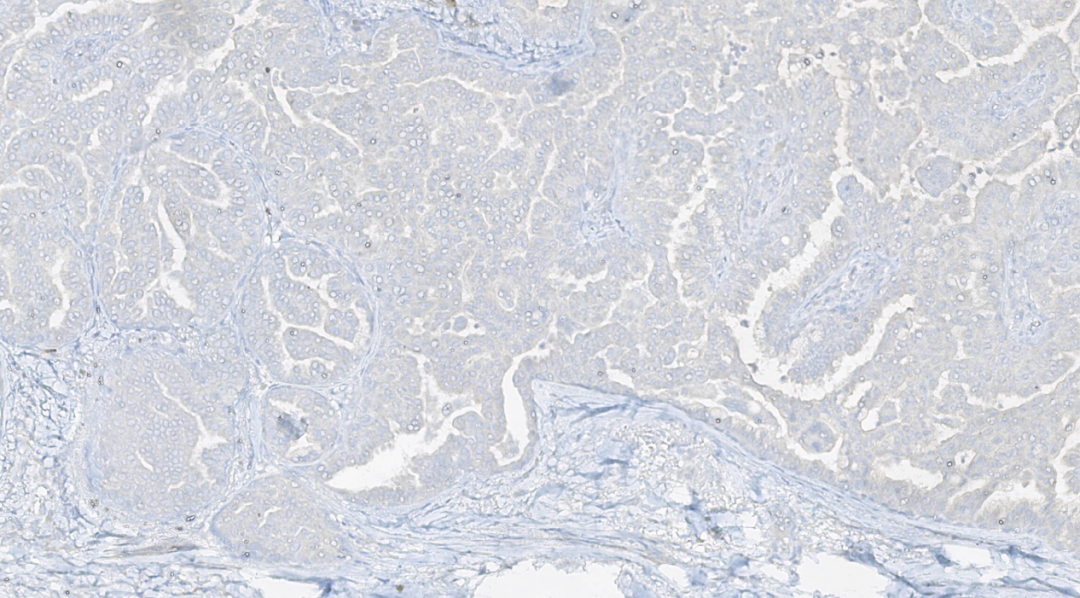
图14.BRAF V600E阴性
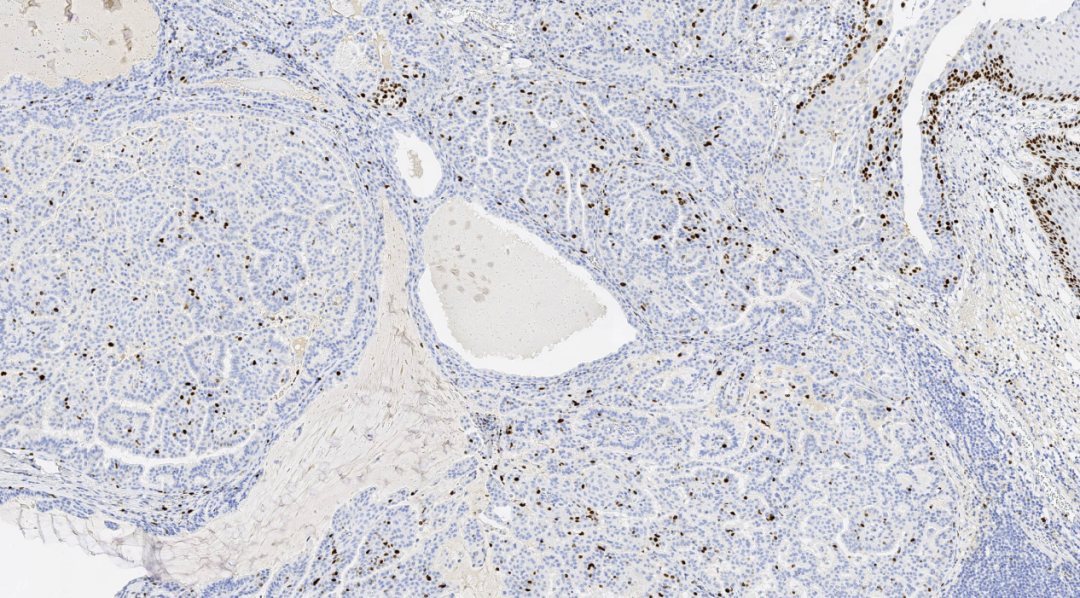
图15.KI67低表达
病理诊断
食管黏膜下腺导管腺瘤
定义:
食管黏膜下腺导管腺瘤( esophageal submucosal glandduct adenoma,EAGDA)为起源于食管黏膜下腺导管上皮的良性肿瘤。
发病机制:
ESGDA的发病机制尚不明确,推测其可能与胃食管反流相关,长期的胃食管反流导致食管腔的压力增加,从而影响正常食管功能。食管黏膜下腺导管受炎性细胞、上皮碎片或渗出物的阻塞造成导管的收缩功能受阻,分泌物难以排出进而导致黏膜下腺导管的扩张伴囊肿形成,在潴留物和炎性细胞的长期刺激下,具有多向分化潜能的原始前体干细胞增生,最终导致肿瘤的形成。
临床特征:
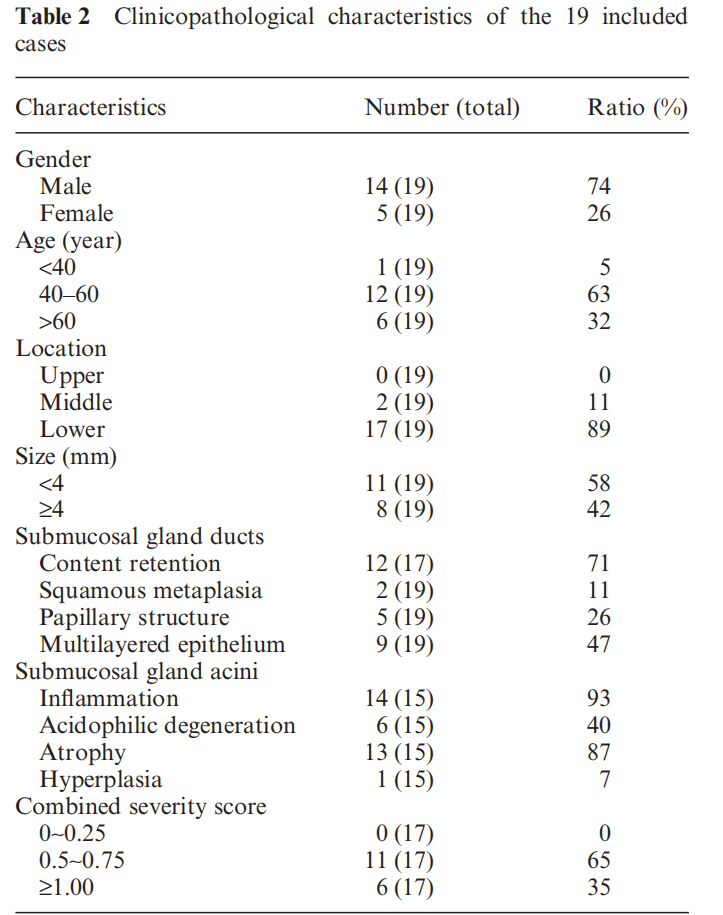
EAGDA是罕见肿瘤,2016年国际食管学会报道了19例,主要临床病理特征见表1。患者多为老年人、男性,病变最大径0.3-1.5cm。患者无症状或有腹部不适、烧心、吞咽困难等症状,可伴发其他恶性肿瘤。
大体检查:
肿瘤为半球形或息肉样突出的黏膜下隆起,表面黏膜光滑。
组织学特征:
肿瘤位于食管黏膜下层,界限相对清晰,但不具有包膜,可见多个扩张的腺腔。由比例不等的较为复杂增生的腺管或囊腔组成,腺管及囊腔衬覆双层上皮结构,即内层腔缘上皮细胞层和外周基底细胞层。内层腔缘腺上皮层柱状或立方状,复层排列,伴有程度不等的腔内乳头状突起形成,细胞质呈颗粒状、嗜酸性,其内不含有黏液。细胞核圆形至椭圆形,核染色质细腻,异型性轻微、核分裂象罕见;部分病例腔内有细胞碎屑或无定形粉染分泌物。外层基底层细胞多呈卵圆形或短梭形,胞质淡嗜酸性或透明。背景间质内有较为显著的淋巴细胞浸润,有时甚至可以形成生发中心。
免疫表型:
内层腔缘腺上皮细胞弥漫表达:CK5/6、CK7、CK19、DOG1、CD117
基底细胞层表达:CK5/6、p63、SMA、p40。
肿瘤细胞不表达:MUC5AC、MUC6、MUC2、GCDFP15、CK20、CDX2、Villin。
讨论:
食管的上皮源性肿瘤以鳞状上皮病变最为常见,腺上皮病变则以Barrett食管及相关性腺癌为主,罕见情况下食管可以发生唾液腺型肿瘤,如腺样囊性癌或黏液表皮样癌等。食管的良性腺上皮肿瘤极为少见,ESGDA则是一种罕见的肿瘤。此肿瘤最早于1993年由Takubo等提出,当时称之为食管黏膜下肿瘤(esophageal submucosal tumor),由于肿瘤发病率低,早期对其认识较为局限使得命名也较为混乱,包括食管的多形性腺瘤、浆液性囊腺瘤、乳头状涎腺腺瘤等。
1995年Rouse等正式将其命名为“食管黏膜下腺导管腺瘤”,并且初步推测其可能起源于黏膜下腺的导管成分。食管的黏膜下腺位于黏膜下层,其本质上被认为是口咽部小唾液腺的延续。黏膜下腺导管由双层细胞组成,分别是单层导管上皮细胞和外层的肌上皮细胞。虽然食管黏膜下腺散在分布于整个食管内,但在理化性质变化显著的食管下段与贲门交界处则更为集中。
ESGDA大体常表现为界限清晰的黏膜下扁平隆起,罕见情况下亦可表现为带蒂的息肉状隆起。体积较小,直径一般不超过2cm。胃镜活检通常难以明确诊断,术后标本低倍镜下肿瘤位于黏膜下层,与周围组织界限清晰但无包膜,肿瘤主要由比例不等的腺管及囊腔组成,腺管及囊腔衬覆双层细胞结构,分别为内层的导管上皮细胞及外层基底细胞层,肿瘤细胞形态温和,无明显异型性。腔缘内层的导管上皮常常形成复层结构伴乳头状突起,乳头状突起的程度不一,从短指状的细小芽突到细长的相互吻合成筛的高柱状。肿瘤周围间质内可见显著的淋巴细胞浸润,有时可伴有生发中心形成。
由于ESDGA罕见且内镜下的表现缺乏特异性,临床医师很难作出准确的术前诊断。超声内镜下肿瘤显示低回声信号的囊性病变,但其内无血管血流,与其他常见食管黏膜下病变诸如平滑肌瘤、颗粒细胞瘤、脉管病变等有一定区别,具有提示意义。
显微镜下ESGDA需要与多种其他类型食管肿瘤及病变相鉴别。与腺癌的鉴别尤其重要,ESGDA发病率较低,病理医师对其诊断比较陌生,活检标本组织的局限性很难观察到肿瘤的全貌,复杂的乳头状结构常常导致将其误诊为腺癌,部分肿瘤导管腔内细胞坏死碎屑和炎性渗出物的出现在主观印象层面上似乎更加重了其为恶性肿瘤的比重。与腺癌鉴别诊断的要点在于:ESGDA缺乏明显的细胞学异型性及多形性,核分裂象罕见,其具有特征性的双层上皮结构是与腺癌鉴别的最为关键的组织学特征。此外ESGDA尚需和食管囊肿、嵌入斑块(食管胃黏膜异位)及多种唾液腺肿瘤等鉴别。
治疗及预后
肿瘤一般较小,可在内镜下经EMR或ESD切除,如伴有其他恶性肿瘤则需外科手术。预后好,已知的病例随访6个月至4.5年均未见进展和复发。
参考书籍及文献:
1.化宏金,杨沁怡,李可栋,李海. 食管黏膜下腺导管腺瘤临床病理学特征[J]. 中华病理学杂志,2021,11:1266-1268.
2.临床病理诊断与鉴别诊断 消化道疾病 李增山主编2020年
3.Nie L, Wu HY, Shen YH, et al. Esophageal submucosal gland duct adenoma: a clinicopathological and immunohistochemical study with a review of the literature.Dis Esophagus. 2016;29(8):1048-1053.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







