Tiragolumab联合阿替利珠单抗治疗广泛期小细胞肺癌的III期研究,结果失败(SKYSCRAPER-02研究)
2022-04-02 网络 网络
非小细胞肺癌 (NSCLC) 患者的5年平均生存率约为15%, 超过70%的NSCLC被诊断为晚期, 不适合传统的放化疗。近年来, 肿瘤免疫治疗取得一系列突破, 免疫检测点抑制剂 (Immune ch
非小细胞肺癌 (NSCLC) 患者的5年平均生存率约为15%, 超过70%的NSCLC被诊断为晚期, 不适合传统的放化疗。近年来, 肿瘤免疫治疗取得一系列突破, 免疫检测点抑制剂 (Immune check point inhibitors, ICI) 治疗晚期恶性肿瘤疗效显著。免疫逃逸是恶性肿瘤发生的重要机制之一, 免疫检测点是这一机制中的关键环节之一。PD-1/PD-L1 (Programmed cell death-1/programmed cell death1 ligang-1) 便是重要的免疫检测点,该检测点能够下调T细胞免疫活性, 并参与恶性肿瘤细胞的免疫逃逸。PD-1/PD-L1检测点的免疫阻断已成为免疫治疗关注的热点之一。
目前,全球已获批多款 PD-1/PD-L1 单抗药物,包括纳武利尤单抗(Nivolumab)、阿特珠单抗(Atezolizumab)、阿维鲁单抗(Avelumab)以及度伐利尤单抗(Durvalumab),均表现了喜人的疗效。为了将免疫治疗的疗效发挥到极致,越来越多的研究着眼于免疫联合治疗方案,例如免疫治疗联合放疗、化疗、靶向治疗、抗血管内皮细胞生长因子(VEGF)及其受体(VEGFR)药物等。随着联合治疗临床试验的增加并取得满意的治疗效果,使得免疫联合治疗成为抗肿瘤治疗的主力军。
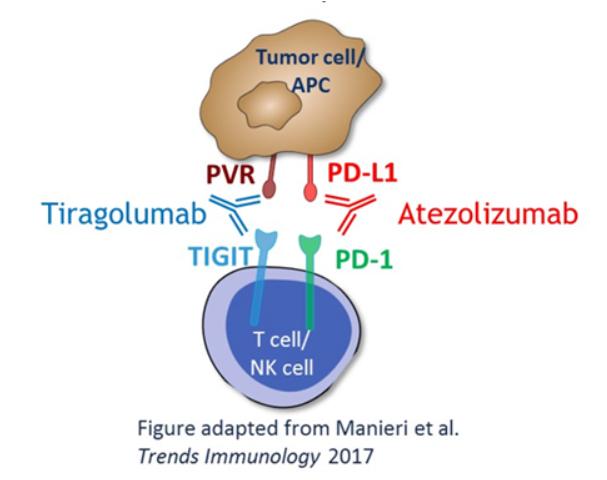
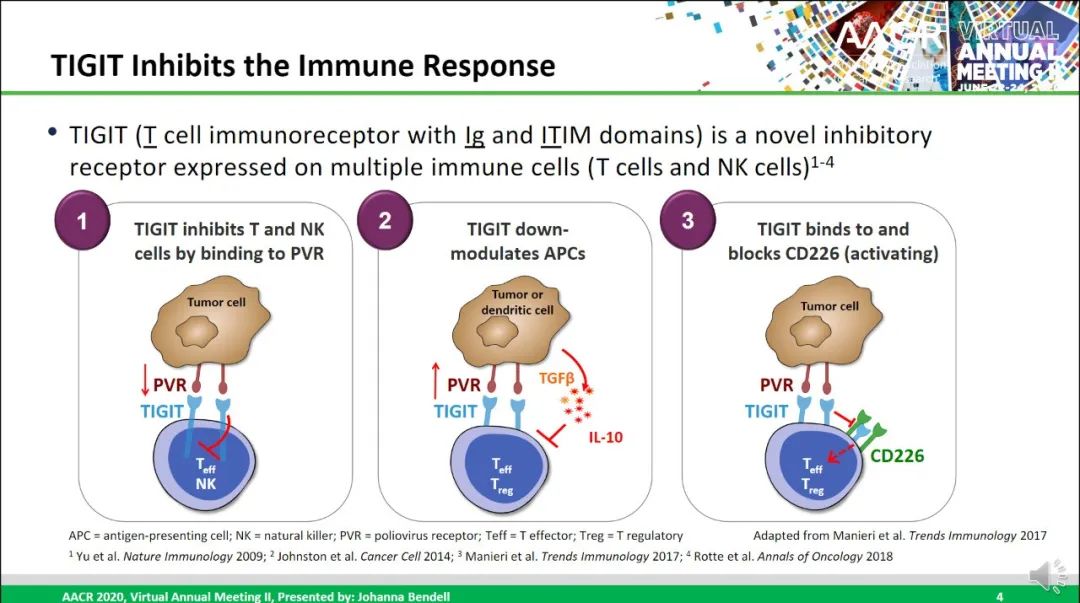
TIGIT(T cell immunoreceptor with Ig and ITIM domains),全称为T细胞免疫球蛋白和ITIM结构域蛋白,是一种新型免疫检查点抑制性受体,存在于包括NSCLC在内的多种癌症的活化T细胞和NK细胞上。TIGIT可与PVR(polio virus receptor, CD155)、CD112(PVRL2)、CD113(PVRL3)结合,其中与PVR的亲和力最高。PVR在各种正常人体组织中几乎不表达或弱表达,但通常在人类恶性肿瘤中过度表达。一旦与NK、T细胞表面的TIGIT结合,就会使免疫细胞对肿瘤细胞的杀伤作用受到抑制。
Tiragolumab为一种单克隆抗体,也是全球首个推向III期临床的TIGIT抗体。该药能够靶向结合免疫细胞上表达的蛋白受体TIGIT,由此阻断TIGIT与PVR之间的机体免疫反应抑制作用,从而改善免疫抑制肿瘤微环境,产生良好的抗肿瘤疗效。
Tecentriq(Atezolizumab,阿特珠单抗)为一种单克隆抗体,也是首支获得FDA批准的用于肿瘤临床治疗的PD-L1抑制剂。Tecentriq以 PD-1 /PD-L1 通路为靶点,通过靶向结合肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1的蛋白,达到预防肿瘤免疫逃逸的作用,从而助力于人体免疫系统抗击癌细胞。
双免疫检查点抑制剂联合治疗构想
此前1,2期临床研究结果比较理想。2期研究CITYSCAPE 01是一项前瞻性、随机、双盲、安慰剂对照的II 期临床试验,旨在评价Tiragolumab+Atezolizumab(TA)对比安慰剂+阿替利珠单抗(PA)一线治疗晚期NSCLC患者的疗效和安全性。中位随访5.9个月的初步分析结果显示,TA组可以带来更显著的生存获益。TA相比PA将疾病进展或死亡的风险降低43%,ORR几乎是PA组的两倍,分别为31%和16%。TA组的mPFS也有改善,为5.4个月,PA组仅为3.6个月。此次随访结果与初步分析结果一致,在意向治疗患者(ITT)中,TA组显著提高了ORR (37% vs 21%),延长了mPFS (5.55个月 vs 3.88个月,HR=0.58,95%CI:0.38-0.89)。
为此开展了3期临床试验。SKYSCRAPER-02研究将探索新的联合治疗方案——Tiragolumab+Atezolizumab+化疗,在广泛期的小细胞肺癌中的治疗效果。SKYSCRAPER-01/02的研究也有望推动Tiragolumab的临床应用步伐,以求让更多患者获益。
SKYSCRAPER-02研究是一项全球 III 期、随机、安慰剂对照的双盲研究,在490名广泛期患者中评估tiragolumab联合阿替利珠单抗和化疗对比阿替利珠单抗和化疗在小细胞肺癌中的疗效。阿替利珠单抗是第一个在 ES-SCLC(III 期IMpower133研究)中显示出生存获益的肿瘤免疫疗法,并且也是第一个在该适应症中获得批准的免疫疗法。
遗憾的是,今年3月30日,这项临床未能达到无进展生存期(PFS)共同主要终点,在中期分析中也没有达到总生存期 (OS)的共同主要终点,并且在计划的最终分析中不太可能达到统计学意义。
关于TIGIT
TIGIT全称T细胞免疫球蛋白和ITIM结构域蛋白(T cell immunoreceptor with Ig and ITIM domains),也是一种抑制性受体,在多种类型的T细胞和NK细胞表面表达。Tiragolumab是一种全人源 IgG1/kappa 抗TIGIT单克隆抗体,具有完整的Fc区,可阻断TIGIT与其配体 PVR 和共激活受体CD226的结合,理论上可恢复抗肿瘤反应并增强抗PD-L1抗体疗效。
Tiragolumab是罗氏重点开发的下一代免疫检查点抑制剂之一,SKYSCRAPER-02也是罗氏针对tiragolumab开展的五项 III 期试验之一。同时,SCLC又是恶性程度较高的一类肺癌,多种不同机制药物也都折戟成沙。因此,在SCLC中的研究失利并不能决断TIGIT策略失败。毕竟LAG3固定剂量药物Opdualag同期刚刚获批上市,而TIGIT和LAG3相似,都是没有单方活性的新型免疫靶标。另一方面,与非小细胞肺癌试验(SKYSCRAPER-01和-03)不同,SCLC早期数据并没有公开披露。而Tiragolumab作为罗氏重点开发的产品在2021年被FDA授予治疗PD-L1高表达转移性非小细胞肺癌的突破性疗法,早期数据显示客观缓解率的改善和疾病恶化或死亡风险的降低。
SKYSCRAPER-02研究数据将在后期举行的医学会议上公布,但总的来说,TIGIT靶标并没有起到“雪中送炭”的作用。PD-1/L1免疫疗法之后,我们需要解决的如何扩大免疫疗法的获益人群,尤其PD-1/L1治疗无响应或不耐受人群中的新疗法,似乎TIGIT和LAG3目前并未表现出这样的潜质。
PD-1/L1免疫疗法之后,业界一直探索新的免疫疗法,TIGIT便是其中热门追逐的靶标之一,先后吸引了罗氏、吉利德、默沙东、诺华等国际巨头入局,同时国内外企业也在基于TIGIT开发特异性双抗疗法。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#mAb#
59
#III#
69
#PE#
41
#III期研究#
50
#替利珠单抗#
67
#广泛期小细胞肺癌#
0
#III期#
40
#SCR#
52