新型AAV体系再次验明NeuroD1不能在体内介导神经元的转分化
2023-05-21 生物世界 生物世界 发表于上海
新型AAV体系的结果进一步表明,即真正实现在Müller胶质细胞中高特异性的表达后,单一转化因子如NeuroD1也无法实现胶质细胞转分化为神经元。
神经损伤或退行性病变,如阿尔茨海默病、帕金森病、视网膜黄斑变性等等,往往会引起神经元的丢失和神经环路的受损。与具有强大自我再生能力的物种不同,哺乳动物成年后其中枢神经系统几乎丧失了神经元再生的能力。因此,上述病症会引起神经元大量死亡,形成不可逆的严重的功能损伤。胶质细胞被报道具有一定的可塑性。
近年来,对体内的胶质细胞进行重编程并将其转分化为神经元,已成为热门的研究领域并具备了成为新型治疗策略的潜力。这些胶质细胞包括大脑中的星形胶质细胞 (astrocytes)、小胶质细胞(microglia),视网膜中的Müller胶质细胞(Müller glia)或脊髓中的NG2胶质细胞(NG2 glia)等。
研究人员往往运用病毒工具(例如腺相关病毒AAV或慢病毒Lentivirus)操控某一个或几个转化因子在胶质细胞内的表达,诱导成年体内的神经元原位再生。这些因子往往在神经发育过程中,对于神经干细胞(stem cell)、祖细胞(progenitor)或前体细胞(precursor)等的分化起到关键性作用,某些甚至被认为是细胞命运决定因子(cell fate determinants)。
其中,神经分化因子NeuroD1在转分化过程的作用被广泛研究和激烈争论【1-3】。最早于2014年,暨南大学陈功教授教授团队(回国前就职于美国宾夕法尼亚州立大学)就报道运用“胶质细胞特异性”GFAP微型启动子将NeuroD1通过病毒工具递送到星形胶质细胞中表达,即可在阿尔茨海默病小鼠模型的大脑内实现超高效率的神经元原位再生【4】。此后,该团队多次运用NeuroD1介导的转分化技术,成功恢复了多种疾病中的功能缺陷,包括小鼠中风模型【5】、亨廷顿病模型【6】、脊髓损伤模型【7】,大鼠颞叶癫痫模型【8】,甚至非人类灵长类动物缺血性中风模型【9】。
然而,2021年的发表在Cell上的一项研究则对NeuroD1的转分化的真实性提出了质疑【10】。该研究中,来自德州大学西南医学中心的张春立教授团队运用严格的遗传谱系追踪技术标记大脑中的星形胶质细胞,重新审视了NeuroD1介导的转分化过程。他们发现之前研究发现的“再生神经元”并非源于星形胶质细胞,而仅仅是由于GFAP微型启动子引起的AAV泄漏表达而被错误标记的内源性神经元。令人惊讶的是,当运用GFAP微型启动子来表达其他某些转分化因子时,该类泄漏表达也或多或少存在,并呈现无规律性。
此后, 陈功团队对于张春立团队在该Cell论文中所使用的病毒滴度提出了质疑, 认为造成错误标记的原因在于后者使用了过高滴度的病毒(1013 GC/mL)去感染星形胶质细胞,这会增加产生细胞毒性的风险并势必会导致NeuroD1在内源神经细胞中非特异表达【11、12】。
到目前为止,该研究领域内对这一争论还缺乏明确定论。并且,如果现有的胶质细胞AAV递送系统真的无法避免在内源神经元中的泄露表达,那么开发新型AAV体系用于高特异性感染胶质细胞也迫在眉睫。
2023年3月20日,美国纽约西奈山伊坎医学院眼科和神经科学系的陈波教授团队(博士后Ye Xie和Jing Zhou为共同第一作者)在 eBioMedicine 期刊发表了题为:New AAV tools fail to detect Neurod1-mediated neuronal conversion of Müller glia and astrocytes in vivo 的研究论文。
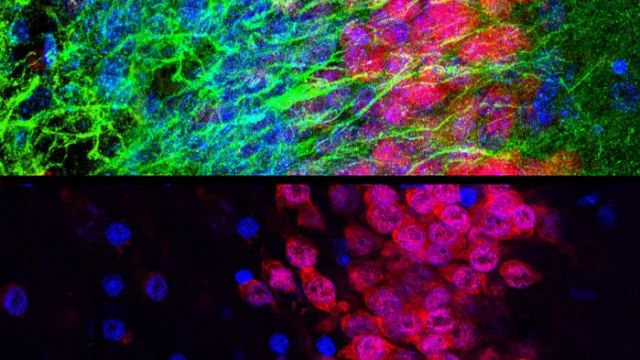
该论文中作者使用严格的遗传谱系追踪(特异性标记Müller胶质细胞), 并通过使用GFAP微型启动子将NeuroD1、Math5、ASCL1或NeuroG2这四个被广泛研究的转化因子逐一递送到成年小鼠视网膜的Müller胶质细胞,针对上述争论给予了深入的系统性探究。

实验结果表明,GFAP微型启动子介导的AAV泄露表达并非是由于高病毒滴度所引起的, 而是由其携带表达的转化因子所决定 (与2021年Cell文章在大脑中的观察结果相类似);相反,使用低病毒滴度(1011-1012GC/mL)无法消除泄露表达,却会造成感染效率的急剧下降;当使用不同血清型的AAV通过不同注射途径去感染Müller胶质细胞, 也无法消除泄露表达,却可以改变泄露表达的神经元类型;更有意思的是,当作者使用两套改造过的新型AAV体系将这四个转化因子导入到视网膜内,则可极大程度上降低甚至消除泄露表达。
新型AAV体系的结果进一步表明,即真正实现在Müller胶质细胞中高特异性的表达后,单一转化因子如NeuroD1也无法实现胶质细胞转分化为神经元。最后, 当使用新型AAV体系去测试大脑不同区域内的星形胶质细胞时,作者同样没有检测到NeuroD1介导的转分化(与2021年Cell文章的结论一致)。
值得一提的是,陈波团队曾于2022年在 Cell 子刊 Cell Reports 上报道称在Müller胶质细胞中下调Ptbp1(另一个颇有争议的转分化现象)的表达无法实现转分化为视网膜神经节细胞【13】。
该研究明确了病毒工具上的报告基因仅仅表明其当前的表达水平,并不能简单用作追溯细胞来源;对照报告基因如GFP、mCherry等的特异性表达并不足以说明该病毒工具会在携带表达其他重编程因子时也维持胶质细胞的高特异性;使用谱系追踪技术则是用来检验胶质细胞是否真正转分化为再生神经元的“金标准”;而在被严格谱系追踪的胶质细胞中高效表达相关因子则是进行胶质细胞重编程研究的关键。
另外,对于陈功团队之前提出的谱系追踪老鼠可能会阻碍Neurod1介导的转分化(相关机理不明)【12、14】,作者在文章的讨论中表示,到目前为止,有多个研究团队使用谱系追踪技术分别在大脑【15、16】、视网膜【17-19】、脊髓【20】等不同区域或组织内实现了胶质细胞重编程为再生神经元。因此谱系追踪老鼠会阻碍转分化的论断是不稳妥的。
有意思的是,陈功团队于2022年在 Neural Regeneration Research 上曾发表研究结果称视网膜内的Müller胶质细胞可以被NeuroD1转化为不同类型的神经元,包括感光细胞,水平细胞,无长突细胞和视网膜神经节细胞【14】。
就此,作者在文章的讨论中表示,陈功团队的上述结果恰好印证了文章中图4关于使用不同血清型AAV通过不同注射途径会引起泄漏到不同内源神经元的假象。最近,NeuroD1在视网膜上引起的类似假象同样被另外两个研究团队的结果所证实【21、22】。
此外,NeuroD1还于2019被报道可以将小胶质细胞转化为神经元【23】。有意思的是,同样运用遗传谱系追踪技术,复旦大学的彭勃团队于2021年在 Neuron 上发表文章表明NeuroD1不光无法诱导小胶质细胞转分化为神经元,反而会引起小胶质细胞的凋亡【24】。
至此,已经有至少三个独立团队对于三种不同类型的胶质细胞 (星形胶质细胞、Müller胶质细胞和小胶质细胞)的研究结果表明,NeuroD1在体内无法实现由胶质细胞到神经元的转分化。之前观察到的结果,极可能是病毒工具错误标记内源神经元的假象。
那么,NeuroD1的“神话”还会继续吗?我们拭目以待。
文章链接:
https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(23)00096-8/fulltext
参考文献:
1. Wang LL, Zhang CL. Reply to In vivo confusion over in vivo conversion. Molecular Therapy 2022; 30(3): 986-7.
2. Svendsen CN, Sofroniew MV. Lineage tracing: The gold standard to claim direct reprogramming in vivo. Mol Ther 2022; 30(3): 988-9.
3. Calzolari F, Berninger B. cAAVe phaenomena: Beware of appearances! Cell 2021; 184(21): 5303-5.
4. Guo Z, Zhang L, Wu Z, Chen Y, Wang F, Chen G. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell Stem Cell 2014; 14(2): 188-202.
5. Chen YC, Ma NX, Pei ZF, et al. A NeuroD1 AAV-Based Gene Therapy for Functional Brain Repair after Ischemic Injury through In Vivo Astrocyte-to-Neuron Conversion. Mol Ther 2020; 28(1): 217-34.
6. Wu Z, Parry M, Hou XY, et al. Gene therapy conversion of striatal astrocytes into GABAergic neurons in mouse models of Huntington's disease. Nat Commun 2020; 11(1): 1105.
7. Puls B, Ding Y, Zhang F, et al. Regeneration of Functional Neurons After Spinal Cord Injury via in situ NeuroD1-Mediated Astrocyte-to-Neuron Conversion. Front Cell Dev Biol 2020; 8: 591883.
8. Zheng J, Li T, Qi S, Qin B, Yu J, Chen G. Neuroregenerative gene therapy to treat temporal lobe epilepsy in a rat model. Prog Neurobiol 2022; 208: 102198.
9. Ge LJ, Yang FH, Li W, et al. In vivo Neuroregeneration to Treat Ischemic Stroke Through NeuroD1 AAV-Based Gene Therapy in Adult Non-human Primates. Frontiers in Cell and Developmental Biology 2020; 8.
10. Wang LL, Serrano C, Zhong X, Ma S, Zou Y, Zhang CL. Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell 2021; 184(21): 5465-81 e16.
11. Chen G. In vivo confusion over in vivo conversion. Molecular Therapy 2021; 29(11): 3097-8.
12. Xu L, Xiang Z-Q, Guo Y-W, et al. Enhancing NeuroD1 Expression to Convert Lineage-Traced Astrocytes into Neurons. bioRxiv 2022: 2022.06.21.496971.
13. Xie Y, Zhou J, Chen B. Critical examination of Ptbp1-mediated glia-to-neuron conversion in the mouse retina. Cell Rep 2022; 39(11): 110960.
14. Xu D, Zhong LT, Cheng HY, et al. Overexpressing NeuroD1 reprograms Muller cells into various types of retinal neurons. Neural Regen Res 2023; 18(5): 1124-31.
15. Zhang YJ, Li BX, Cananzi S, et al. A single factor elicits multilineage reprogramming of astrocytes in the adult mouse striatum. P Natl Acad Sci USA 2022; 119(11).
16. Niu WZ, Zang T, Zou YH, et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nature Cell Biology 2013; 15(10): 1164-U94.
17. Todd L, Hooper MJ, Haugan AK, et al. Efficient stimulation of retinal regeneration from Muller glia in adult mice using combinations of proneural bHLH transcription factors. Cell Rep 2021; 37(3): 109857.
18. Hoang T, Wang J, Boyd P, et al. Gene regulatory networks controlling vertebrate retinal regeneration. Science 2020; 370(6519).
19. Todd L, Jenkins W, Finkbeiner C, et al. Reprogramming Muller glia to regenerate ganglion-like cells in adult mouse retina with developmental transcription factors. Sci Adv 2022; 8(47): eabq7219.
20. Tai W, Wu W, Wang LL, et al. In vivo reprogramming of NG2 glia enables adult neurogenesis and functional recovery following spinal cord injury. Cell Stem Cell 2021; 28(5): 923-37 e4.
21. Gao Y, Fang K, Yan Z, et al. Develop an efficient and specific AAV-based labeling system for Muller glia in mice. Sci Rep 2022; 12(1): 22410.
22. Le N, Appel H, Pannullo N, Hoang T, Blackshaw S. Ectopic insert-dependent neuronal expression of GFAP promoter-driven AAV constructs in adult mouse retina. Front Cell Dev Biol 2022; 10: 914386.
23. Matsuda T, Irie T, Katsurabayashi S, et al. Pioneer Factor NeuroD1 Rearranges Transcriptional and Epigenetic Profiles to Execute Microglia-Neuron Conversion. Neuron 2019; 101(3): 472-85 e7.
24. Rao YX, Du SL, Yang BZ, et al. NeuroD1 induces microglial apoptosis and cannot induce microglia-to-neuron cross-lineage reprogramming. Neuron 2021; 109(24): 4094-+.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











神经损伤或#神经退行性病变#,如#阿尔茨海默病#、#帕金森病#、视网膜黄斑变性等等,往往会引起神经元的丢失和神经环路的受损。 所以体内与体外是完全不一样的!体外能进行#转分化#,在体内未必可以!!就象四因子可以诱导iPSC分化,但是体内几乎不可能。
133