Science发表首个人类剪接体图谱,揭示RNA剪接交叉调控的复杂网络
2024-11-19 测序中国 测序中国 发表于陕西省
西班牙 CRG 研究人员耗时 10 余年绘人类剪接体图谱,揭示剪接体调控等机制,包括敲低剪接因子影响等,为癌症等疾病治疗策略提供见解,强调其对转录水平治病及新药设计的重要性。
人体中的各项生命活动都依赖DNA的指导,这些指令通过转录成RNA,再由RNA翻译成蛋白质而实现,这便是大名鼎鼎的“中心法则“。然而人类大约有20000个蛋白质编码基因,却能产生至少5倍的蛋白质,这是为什么呢?这就是RNA转录后剪接的神奇之处。
RNA剪接是去除RNA的非编码片段,将剩余的编码序列拼凑在一起,从而形成不同蛋白质的模板。这是RNA转录后修饰的关键过程,一旦发生剪接错误,就可能导致癌症、神经退行性疾病和遗传疾病。由于RNA可变剪接(AS)的复杂性,剖析其剪接位点选择机制目前仍是一项巨大挑战。
西班牙基因组调控中心(CRG)的研究人员耗时10余年成功绘制了人类剪接体的第一张图谱。研究团队敲低了人类癌细胞中的305个剪接体和不同类别AS决定的功能性剪接因子,进行全转录组分析,并重建了不同功能性剪接因子网络,发现剪接体的不同组分具有独特的调控功能,揭示了剪接因子交叉调控的复杂网络。这些结果为剪接体治疗癌症或罕见病的策略提供了全新的见解。相关研究已发表在Science上。

文章通讯作者、CRG研究员Juan Valcárcel博士表示:“我们希望这项结果可以成为研究界的宝贵资源。纠正剪接错误的药物彻底改变了脊髓性肌萎缩症等罕见疾病的治疗策略。该图谱可以将这种策略扩展到其他疾病,并将这些疗法纳入主流。”
一、敲低剪接因子对转录组的影响
研究人员通过siRNA敲低了Hela细胞系的305个剪接相关蛋白质编码基因(SF),SF包括核心剪接体组分(来自主要和次要剪接体)和相关因子、在AS中具有已知调节功能的RNA结合蛋白,以及与剪接调节相关的RNA修饰酶和染色质相关因子。随后,研究人员纯化出聚腺苷酸(polyA)+RNA样品,进行深度RNA-seq处理。
研究人员比较了不同敲低操作下的AS扰动曲线,发现单个SF的敲低可导致AS发生重大变化,参与5'或3′端识别早期剪接步骤的因子的敲低对ES事件影响较大,而参与剪接体组装和激活后期步骤的因子的敲低更影响内含子保留(IR)事件(图1B, C)。表明IR的限速步骤通常发生在初始剪接位点识别之后。此外,研究发现物理连接因子对剪接位点的选择具有不同贡献,复合物之间的SF表达变化还存在补偿机制。
研究人员创建的该数据集概括了此前描述[1]的剪接扰动缩放定律效应(图1D, E),揭示了跳过外显子和保留其侧翼内含子的不同调节因子(图1G),证实了AS事件受到SF的强烈调控作用,具体取决于基因在细胞核中的位置(图1H)。
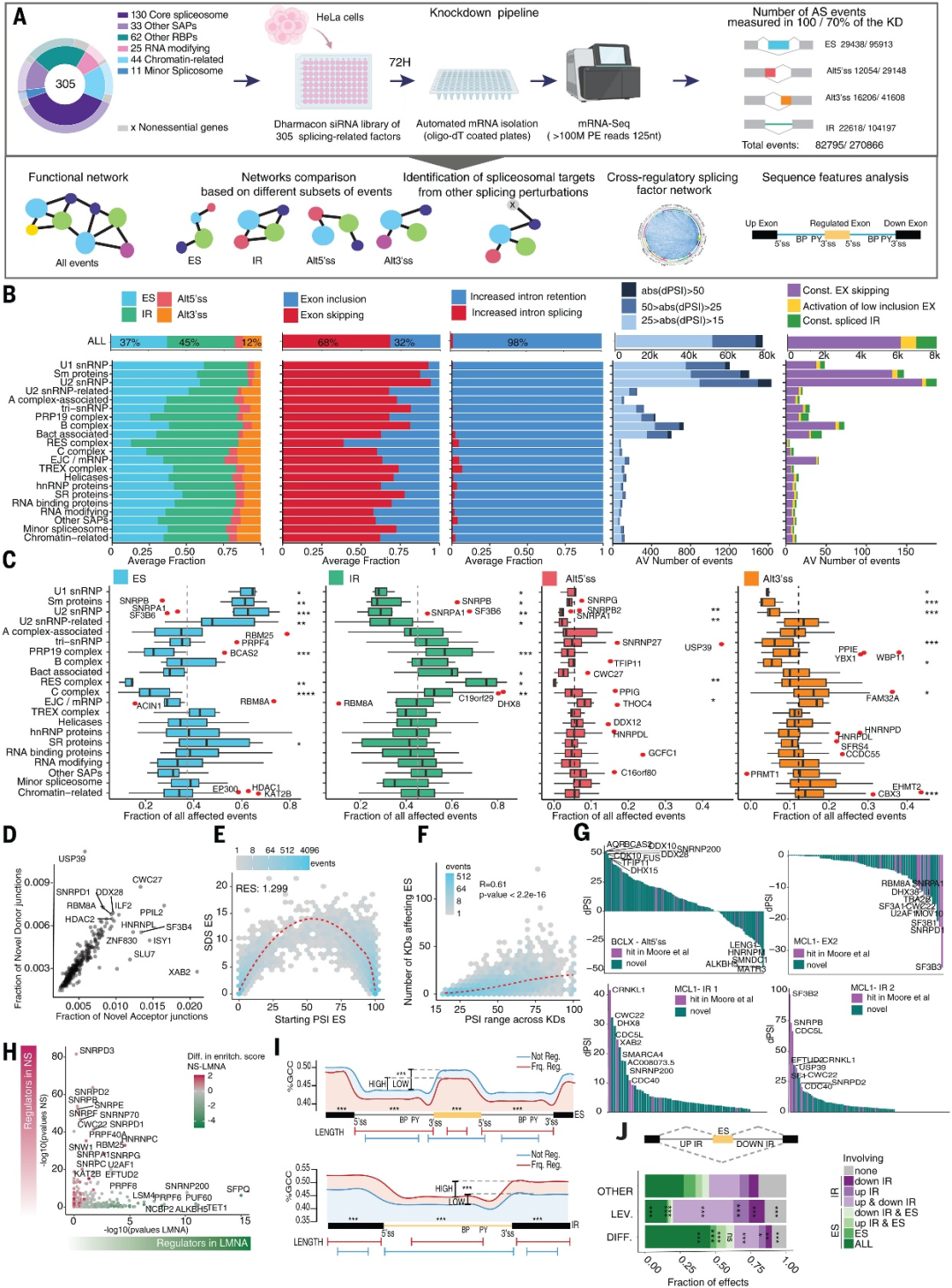
图1. 305个剪接相关因子系统性敲低表达后的转录组分析
二、广泛的剪接因子交叉调节网络
Go分析显示,编码SF和RNA结合蛋白的基因在SFs敲低后AS水平上受影响最大(图2A)。平均而言,基因中的AS事件会因6个SF基因的敲低而发生重大改变,调节因子的数量与基因的转录复杂性(即其所携带的AS事件的数量)无关(图2B)。80%的SF基因通过AS受其他SF的调控,其中43%参与AS自动调控(图2C)。SF基因中约50%的ES和超过60%的Alt5′ss或Alt3'ss事件不会破坏开放阅读框(ORF),因此导致mRNA编码不同的蛋白质亚型(图D, E)。某些类别的SF往往优先影响其他特定的SF类别(例如转录输出复合物成分、解旋酶等),表明交叉调节网络内的功能结构(图2F)可能有助于缓冲剪接活动以维持细胞稳态。
研究人员分析了数据集用于预测剪接扰动的直接和间接影响的效果,发现SF3B1的敲低诱导基因RBM10(RBM10基因在多种癌症类型中经常突变)的外显子6跳跃,导致RBM10蛋白水平逐渐降低(图2G, H),这种作用引起NUMB外显子9的转换增加,从而减弱了SF3B1靶向药物的抗肿瘤作用。表明类似影响蛋白质表达水平的间接作用会导致与药物抗肿瘤活性相关的AS变化。
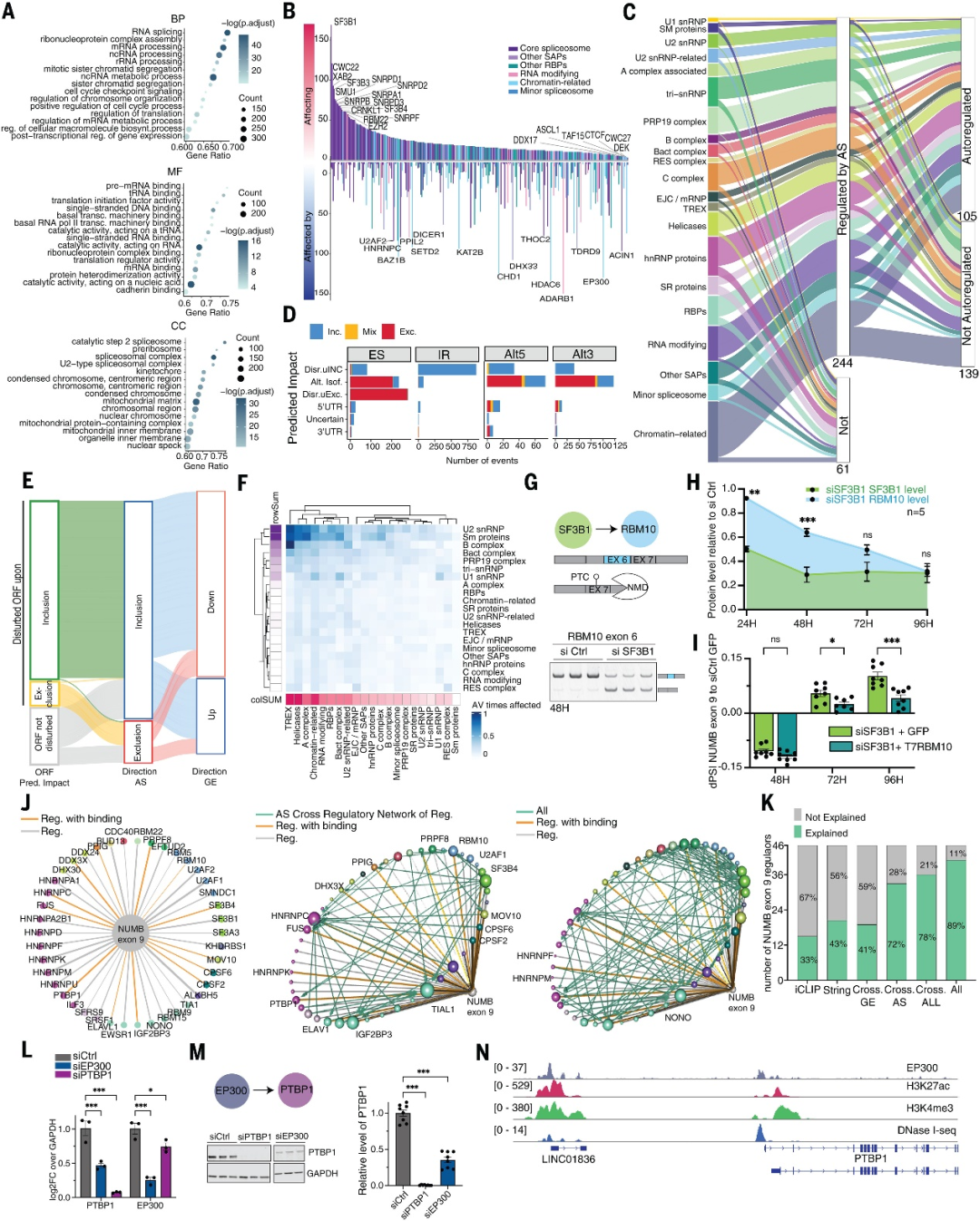
图2.剪接因子交叉调控网络
随后,研究人员根据跨敲低剪接扰动谱之间的相似性、联合比较所有类别的AS事件及关注特定子集(如ES, IR, Alt5′ss, or Alt3′ss)构建了SF之间的功能相互作用网络,并概括了已知的物理特征与功能关联(图3-4)。
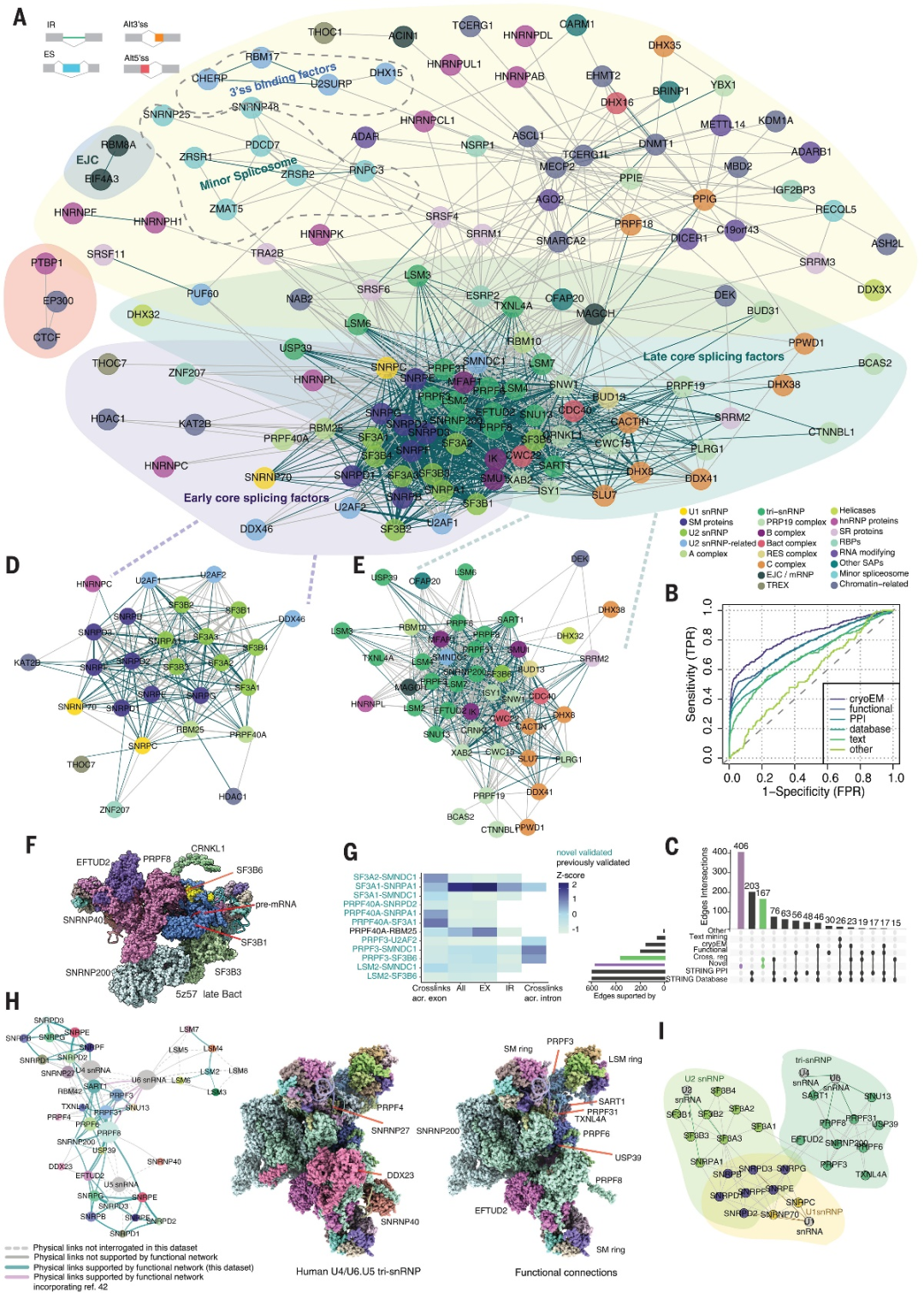
图3.功能网络准确地反映已知的物理和功能关联
三、U1 snRNP蛋白在剪接位点选择中的不同功能
研究人员关注了U1 snRNP复合物的功能连接作用。虽然三种U1特异性蛋白(U1A、U170K和U1C)在Alt5’ss交叉网络中彼此紧密连接,并与U1 snRNA紧密连接,但U1A在外显子跳跃网络中明显缺失(图4D, E)。这一结果在两个AS类别的具体实例和转录组分析中得到了独立验证(图4F, G),并利用Hela细胞系细胞核的灭活提取物与含有U1A和U170K的纯化U1 snRNP互补实验实现了Alt5’ss选择的功能性网络重建(图4)。以上结果显示,U1A在Alt5’ss选择中发挥作用,但并非外显子包含或跳跃的决定因素(图4H),这是核心剪接体复合物中前所未有的分工。该分析表明,剪接体核心内的蛋白质不仅仅是辅起到辅助作用,而是决定了如何处理遗传信息,并最终影响人类蛋白质的多样性。
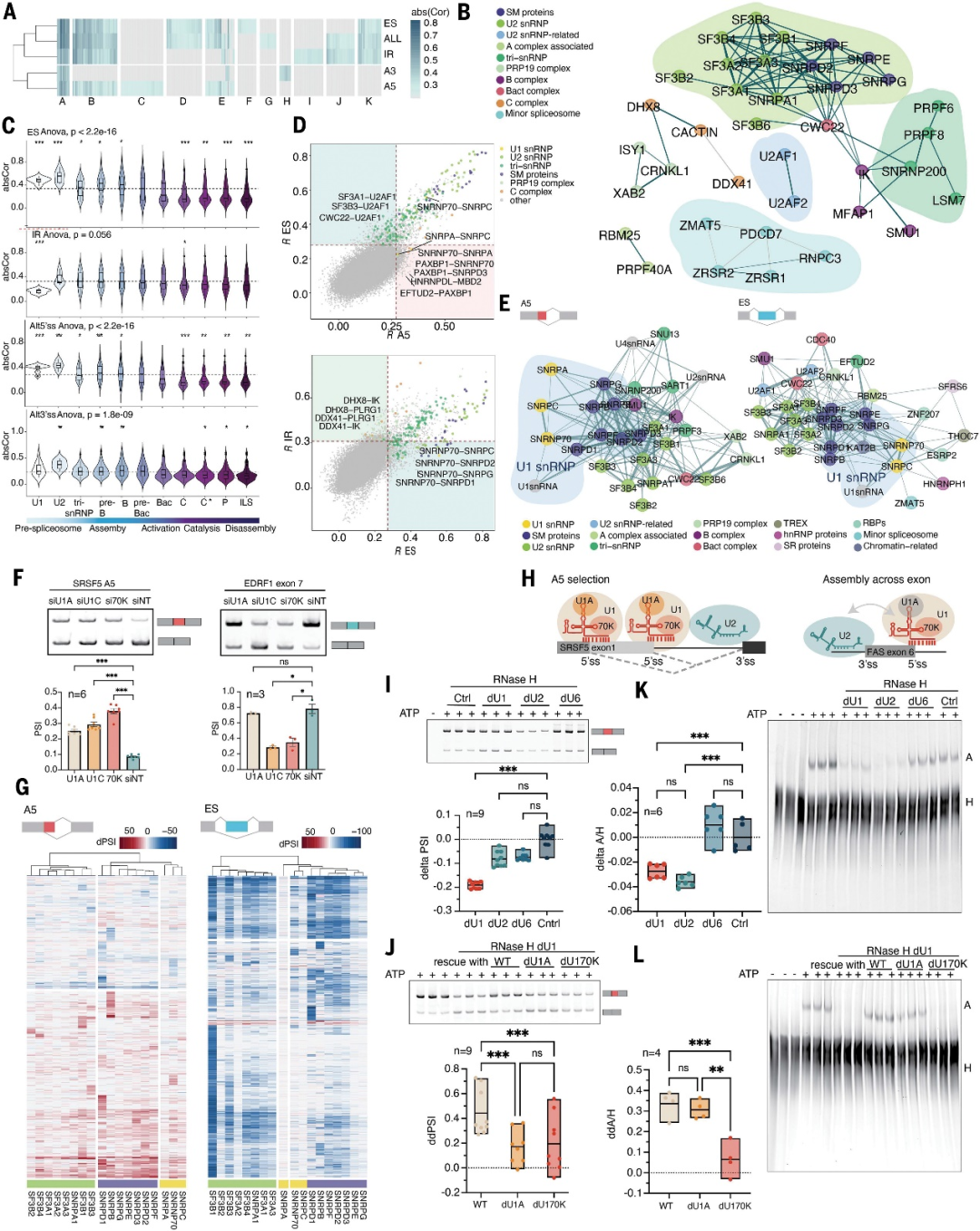
图4.不同类别AS事件之间的功能关系
综上所述,研究人员破译了剪接体及其调节因子系统、以及功能网络重建方法如何揭示不同生物学背景下SF调控活动的机制见解,揭示了核心剪接机制在剪接体组装早期和晚期作用复合物中意想不到的特殊功能。该研究提供的资源、方法和见解有可能阐明潜在的生理和病理机制,并最终为新治疗方法的设计提供信息。
文章共同通讯作者、CRG研究员Malgorzata Rogalska博士表示:“目前的剪接相关治疗主要集中在罕见病上,但它们只是冰山一角。我们正在进入一个新的时代,即在转录水平上解决疾病,创造改善疾病的药物,而不仅仅是解决症状。我们绘制的剪接图谱为全新的治疗方法铺平了道路。”
这项开创性研究最重要的发现之一是,剪接体是高度互联的,扰乱其中一个组件可以在整个网络中产生广泛的连锁反应。癌症治疗的方式之一是重组其剪接机制。靶向剪接可以将患病细胞推过无法弥补的临界点,导致它们自我毁灭。
Valcárcel表示:“癌细胞中剪接体有如此多的改变,以至于它们已经达到了生物学上合理的极限。癌细胞对高度互联剪接网络的依赖是一个潜在的致命弱点,我们可以利用它来设计新的疗法,我们的图谱提供了一种发现这些弱点的方法。”
原文链接:https://www.science.org/doi/10.1126/science.adn8105
参考文献:
[1] P. Baeza-Centurion, B. Miñana, J. M. Schmiedel, J. Valcárcel, B. Lehner, Combinatorial Genetics Reveals a Scaling Law for the Effects of Mutations on Splicing. Cell 176, 549–563.e23 (2019).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#RNA剪接# #剪接体图谱#
22