Brain 中国医学科学院阜外医院汪一波教授团队发现GPRASP1突变参与动静脉畸形的新机制
2023-10-19 论道心血管 论道心血管 发表于江苏省
该研究为AVM的发病机制解密和进一步的精准治疗提供了新的思路。
中国医学科学院阜外医院汪一波教授团队一直从事心血管疾病遗传机制研究。在血管畸形表型上,发现了KRAS/BRAF体细胞突变是散发性动静脉畸形的核心遗传机制(Brain, 2019)1,MAP3K3和PIK3CA体细胞变异是散发性海绵状血管畸形的核心遗传机制(Brain, 2021, 封面文章)2,定义了第四种类型的CCM—CCM4,并首次绘制了不同突变类型的人类海绵状血管畸形单细胞图谱(Exp Mol Med, 2023)3,为血管畸形的精准治疗提供了新的靶点和思路。
动静脉畸形(Arteriovenous malformation, AVM)由动脉和静脉直接异常交通形成,缺乏毛细血管床,是一种快速血流的血管畸形。AVM是青壮年脑出血的重要原因之一,深入了解AVM的遗传发病机制是必要的。该团队前期在脑和脊髓AVM患者中发现了KRAS/BRAF的高体细胞突变率1。然而,仍有超过10%的患者未检测到任何KRAS/BRAF突变。越来越多的证据表明,仅体细胞变异的局部事件可能不足以使AVM表现出来,其遗传机制仍有待进一步阐明。
2023年10月3日,中国医学科学院阜外医院汪一波教授团队在Brain上发表了题为“GPRASP1 loss-of-function links to arteriovenous malformations by endothelial activating GPR4 signals”的文章,首次在AVM患者中发现了GPRASP1错义突变,并阐明了GPRASP1功能丧失与AVM的关系。内皮GPRASP1功能丧失造成严重的脑出血和血管畸形,并激活GPR4/cAMP/MAPK信号通路导致内皮功能障碍。该研究为AVM的发病机制解密和进一步的精准治疗提供了新的思路。

首先,作者通过全外显子测序对77名AVM患者血液进行测序分析,发现其中三名男性患者携带GPRASP1突变:两人携带GPRASP1 NM_014710.4: c.3499C>T (p.Arg1167Trp) (GPRASP1R1167W)突变,一人携带GPRASP1 NM_014710.4: c.1659G>C (p.Trp553Cys) (GPRASP1W553C)突变(图1)。
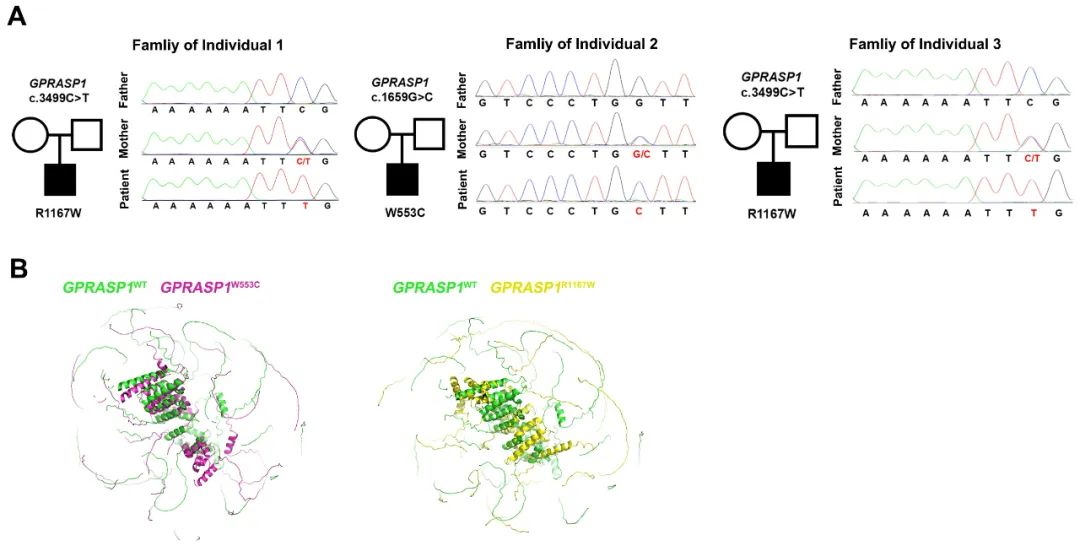
图1. 首次在AVM病人中发现GPRASP1突变
GPRASP1是G蛋白偶联受体(G protein-coupled receptor,GPCR)分选蛋白家族成员,对于维持体内GPCR稳态具有重要作用4。作者推测GPRASP1突变可能通过影响GPCR的正常功能,从而导致血管异常。作者通过体内和体外实验证实了GPRASP1突变在内皮细胞中为功能丧失性突变。为进一步探究内皮GPRASP1功能丧失对体内血管的影响,作者构建了内皮细胞特异性敲除Gprasp1的小鼠。该小鼠生长迟缓,且表现出严重的脑出血,脑和肠的AVM,脑、肝脏和视网膜血管密度明显增加。此外,敲除小鼠的脑微血管内皮细胞中血管生成相关因子和黏附因子的表达显著上调(图2)。
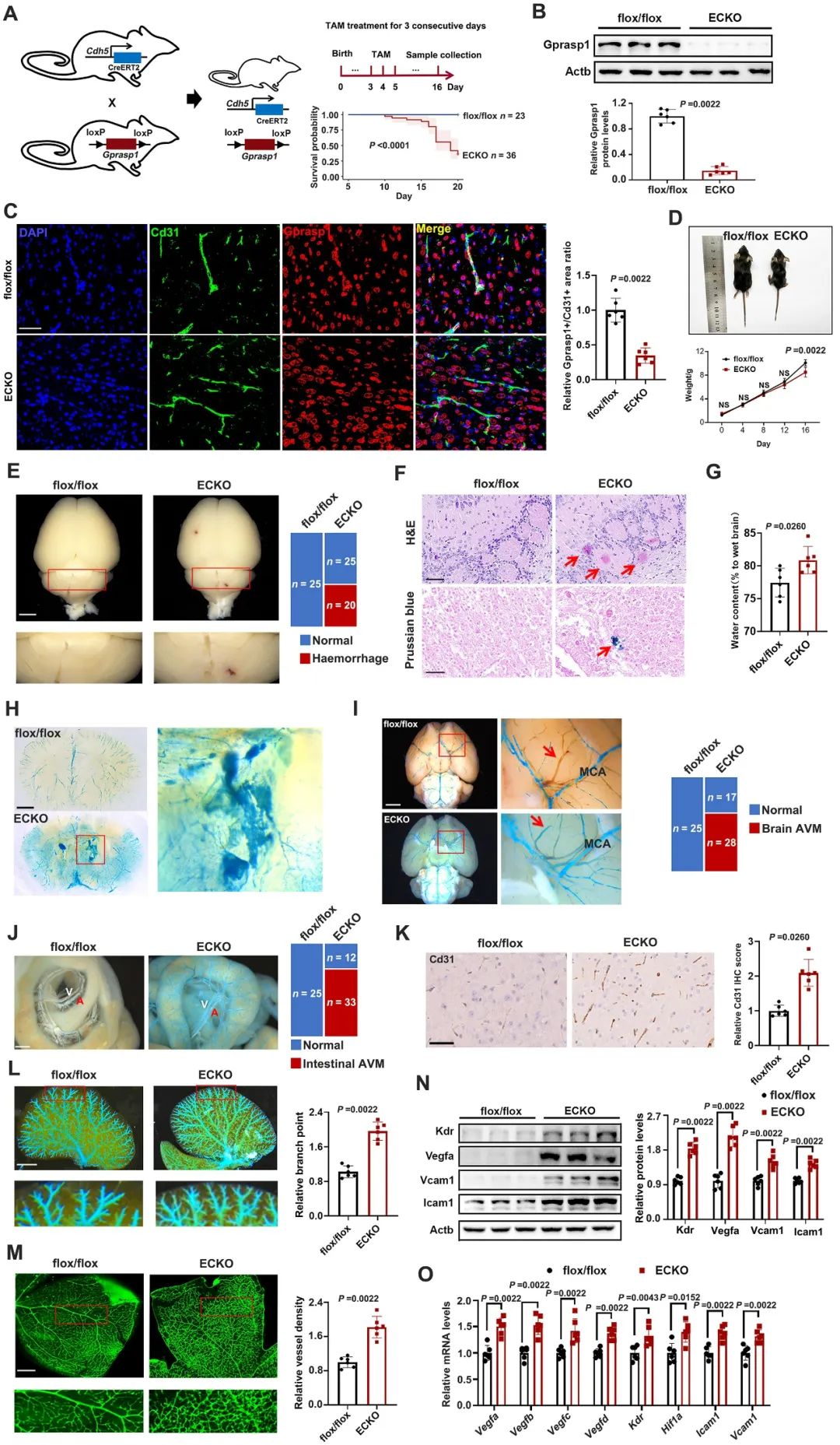
图2. 内皮Gprasp1敲除小鼠的血管表型
接下来,作者探究了GPRASP1缺失导致血管异常表型的机制,发现GPR4可与GPRASP1在内皮细胞中有效结合,且GPRASP1促进了GPR4的降解。其机制为GPRASP1促进了GPR4的K63泛素化,该作用有助于GPR4进入内体-溶酶体途径。被K63泛素化标记的GPR4可有效与RABGEF1结合,激活早期内体标志物RAB5。随后,携带GPR4的囊泡转化为早期内体,ESCRT系统成员识别被泛素标记的GPR4,将GPR4包装进入多泡体/晚期内体,最终进入溶酶体降解。该过程依赖于GPRASP1和GPR4相互作用(图3)。
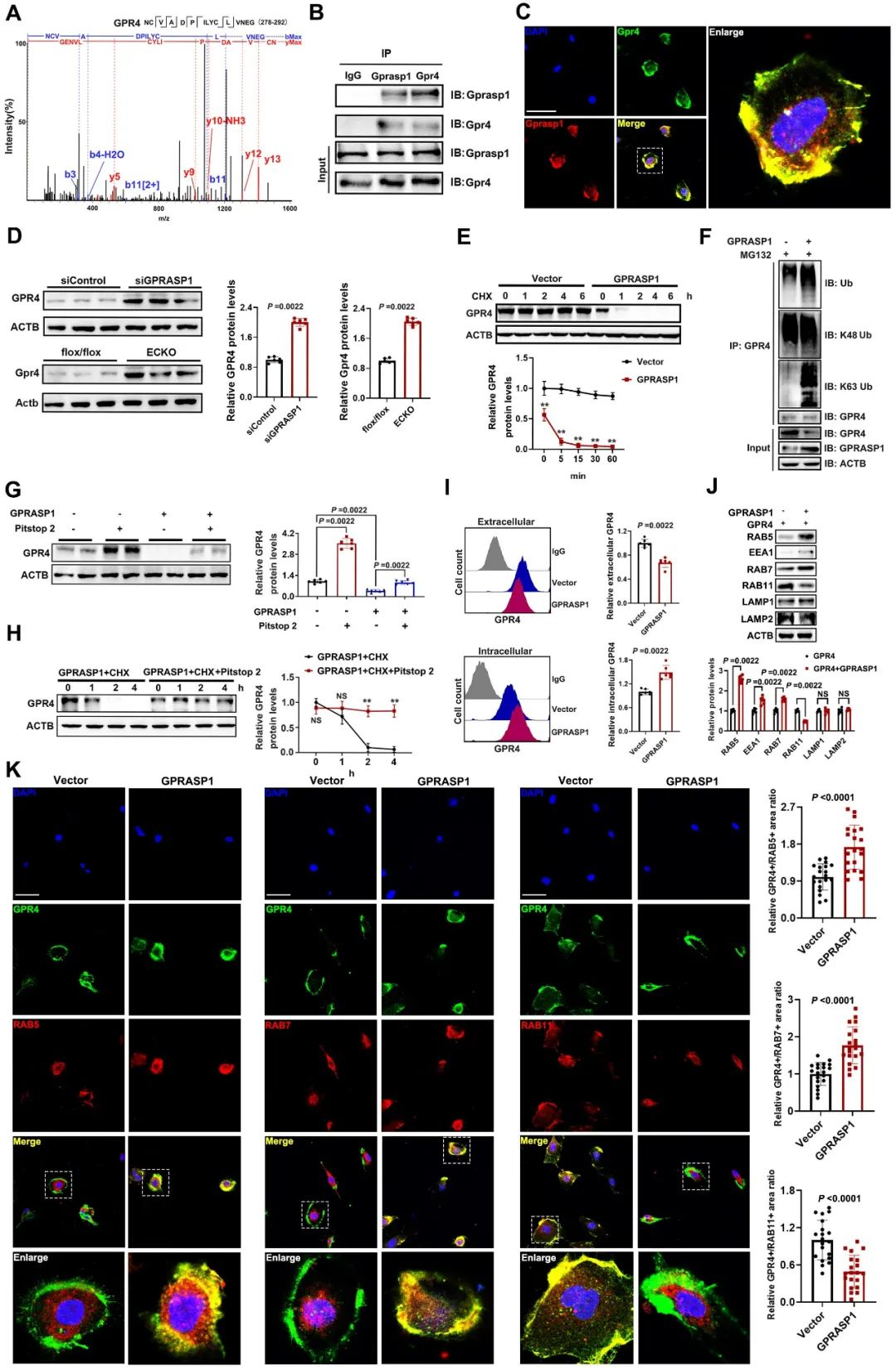
图3. GPRASP1促进GPR4降解
最后,作者通过一系列分子实验证实GPRASP1缺失可通过激活GPR4/cAMP/MAPK信号通路导致内皮功能紊乱和血管异常。GPR4拮抗剂NE 52-QQ57和JNK抑制剂SP600125可有效改善内皮细胞Gprasp1缺失导致的血管表型(图4)。
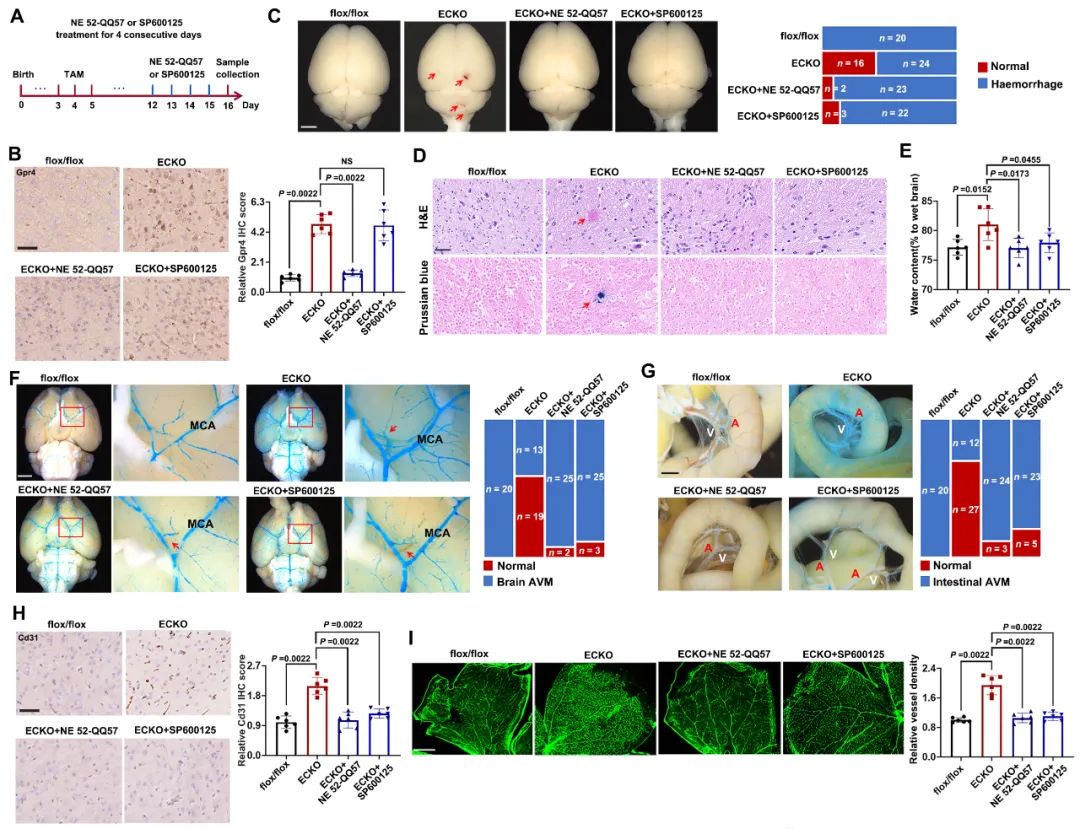
图4. GPR4拮抗剂和JNK抑制剂改善Gprasp1缺失导致的血管表型
综上所述,本研究首次在AVM患者中发现了GPRASP1突变,并证实它们在内皮细胞中为功能丧失性突变。内皮细胞GPRASP1功能丧失减少了GPR4的K63泛素化、内吞和降解,从而导致GPR4过度积累以及后续cAMP/MAPK信号激活,造成内皮功能紊乱、血管异常和AVM发生。抑制GPR4和JNK可有效改善内皮Gprasp1缺失导致的血管表型。这些发现为GPRASP1在AVM中的作用提供了新的见解,并提出了新的治疗策略(图5)。
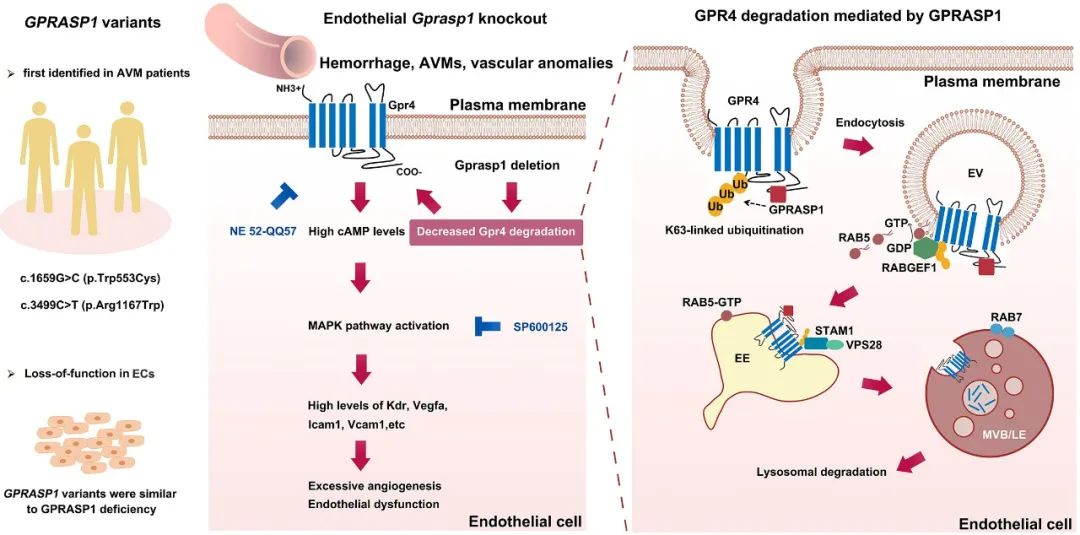
图5. 总结图
中国医学科学院阜外医院博士生李若飞为论文第一作者,汪一波教授为通讯作者。该研究得到国家自然科学基金和中国医学科学院创新基金的经费支持。
参考文献:
1. Hong, T. et al. High prevalence of KRAS/BRAF somatic mutations in brain and spinal cord arteriovenous malformations. Brain 142, 23-34, doi:10.1093/brain/awy307 (2019).
2. Hong, T. et al.Somatic MAP3K3 and PIK3CA mutations in sporadic cerebral and spinal cord cavernous malformations. Brain 144, 2648-2658, doi:10.1093/brain/awab117 (2021).
3. Ren, J. et al.Single-cell sequencing reveals that endothelial cells, EndMT cells and mural cells contribute to the pathogenesis of cavernous malformations. Exp Mol Med 55, 628-642, doi:10.1038/s12276-023-00962-w (2023).
4. Morales-Hernández., A.et al. GPRASP proteins are critical negative regulators of hematopoietic stem cell transplantation. Blood 135, 1111-1123, doi:10.1182/blood.2019003435 (2020).
原文链接:
https://doi.org/10.1093/brain/awad335
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言