人体是如何对抗肿瘤形成的呢?人的免疫系统包括多种免疫细胞,其中,1 型常规树突状细胞 (cDC1) 对于有效的抗肿瘤免疫是必不可少的。它可以识别肿瘤抗原,并引发CD8+T细胞的抗肿瘤免疫效应。当cDC1缺失时,CD8+T细胞驱动的肿瘤免疫作用发生消退,CD8+T细胞激活剂以及免疫检查点阻断抑制剂的治疗效果也会下降。因此,cDC1丰度、CD8+T细胞浸润与癌症患者对于抗肿瘤治疗的反应以及总体生存率息息相关。
癌症状态下cDC1的募集的干扰已成为逃避机体免疫的一种手段,而增加肿瘤微环境(TME)中cDC1的募集、存活、扩张和功能活性则具有抗肿瘤效果。时至今日,针对肿瘤免疫控制的干预已展现出了良好的应用前景,而对于这一通路的干预亦有研究开展。
2021年6月2日,国际学术期刊《Cell》在线发表了英国弗朗西斯·克里克研究所Caetano Reis e Sousa团队题为“Secreted gelsolin inhibits DNGR-1-dependent cross-presentation and cancer immunity”的研究。该研究揭示了内源性因子sGSN通过抑制cDC1对肿瘤相关抗原的呈递而促进肿瘤的免疫逃避。
研究人员提出,cDC1表达高水平的c型凝集素受体DNGR-1(又名CLEC9A),它可以与暴露在坏死细胞表面的F-actin结合,促进死亡细胞抗原的交叉传递。人体内含有两种丰富的肌动蛋白结合蛋白(ABP),即分泌型凝胶蛋白(sGSN)以及Gc球蛋白,它们可以抑制cDC1对坏死细胞的识别,进而抑制肿瘤免疫。
研究人员发现,胎牛血清(FCS)对DNFR-1与F-actin结合具有抑制作用,而经F-actin处理并高速离心后的FCS失去了这种功能。研究人员认为这与血清中的ABP有关。反过来看,使用sGSN处理的F-actin同样不能与DNFR-1结合,从两个方向证明了sGSN对DNGR-1与F-actin结合的抑制作用。
随后,研究人员构建了sGSN-/-小鼠模型,发现sGSN-/-小鼠的血清不能抑制DNGR-1与F-actin的结合,添加重组sGSN后,抑制作用恢复,而另一种ABP——Gc球蛋白不具有该抑制能力。
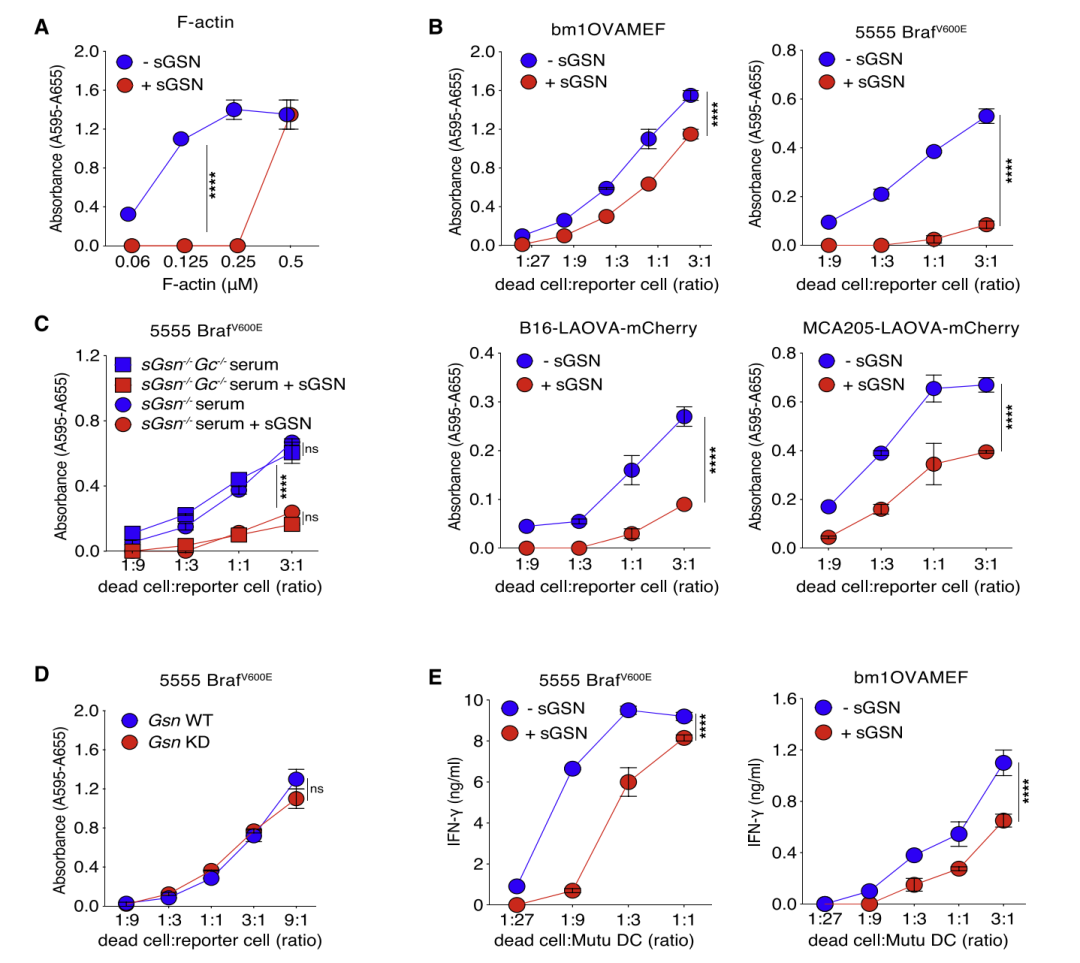
sGSN对DNGR-1与F-actin结合的抑制作用
研究人员推测,sGSN-/-小鼠的抗肿瘤CD8+T细胞反应增加。为了验证这一观点,他们在sGSN-/-小鼠体内构建了LA-OVAmCherry MCA-205肿瘤,结果表明,sGSN-/-小鼠体内的肿瘤生长明显较小,且对癌症免疫治疗更加敏感。然而,无论是否存在DNGR-1, sGSN的缺失都不会影响cDC1的激活,这种治疗反应性的增加主要与CD8+T有关。
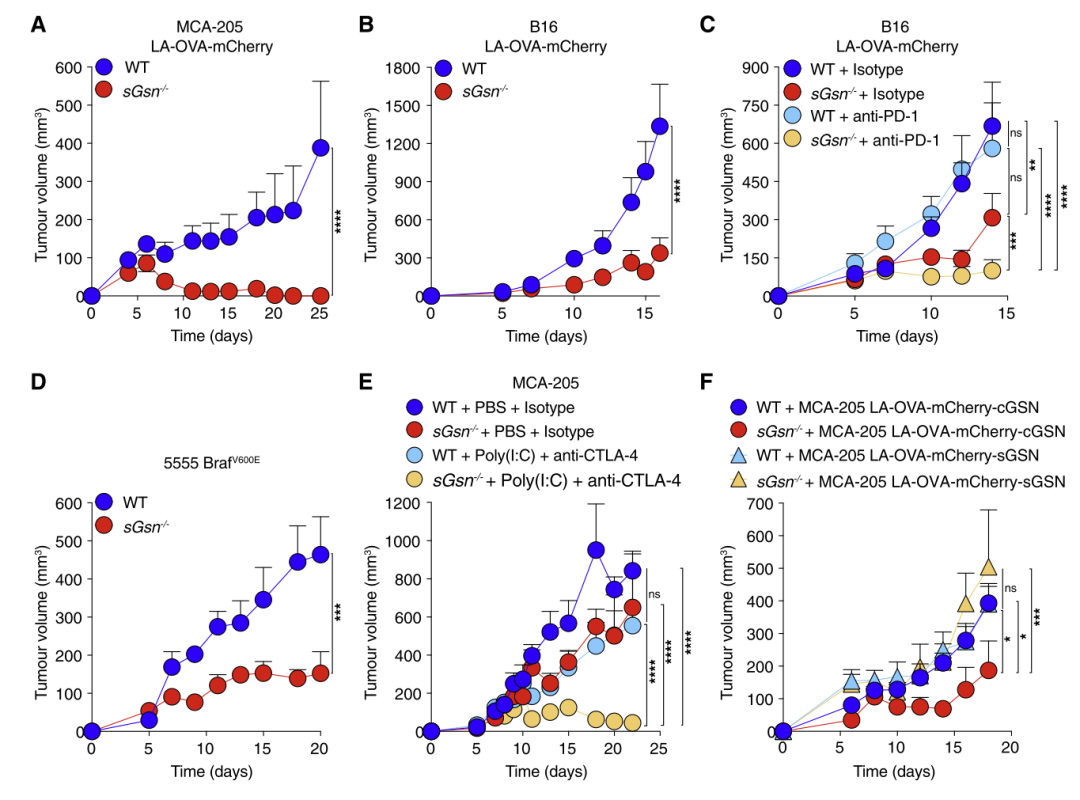
sGSN缺失损害肿瘤生长并增强对免疫治疗的反应
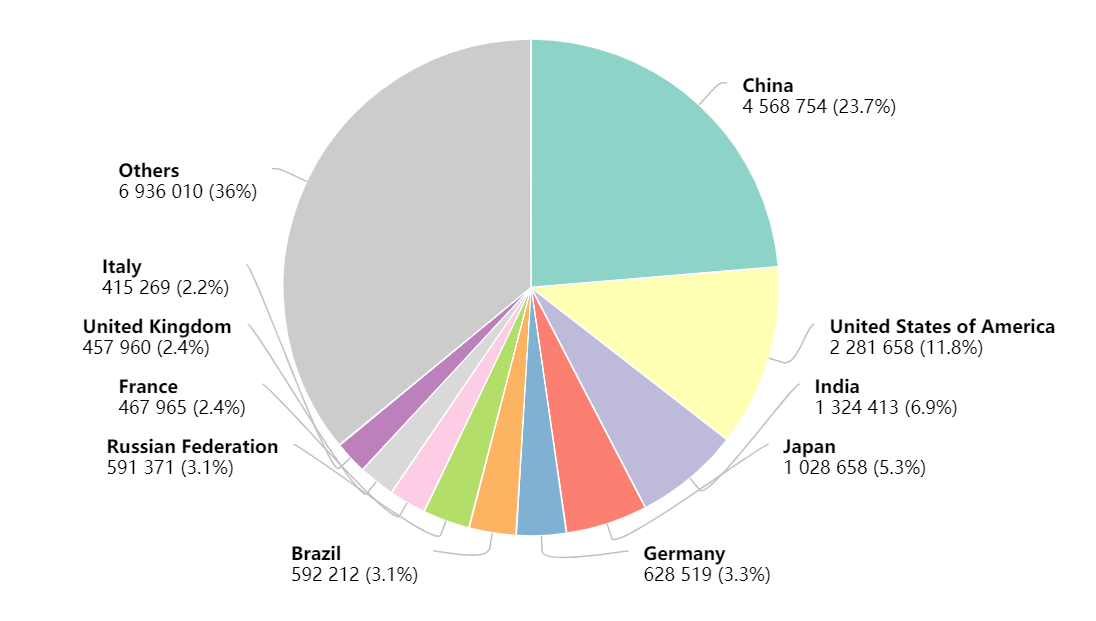
结合以上动物实验结果,研究人员推测,在人体内,某些癌症同样与sGSN有关。他们对癌症基因组图谱(TCGA)中10种癌症(皮肤、肝脏、乳房、肺部、胰腺、前列腺、低级别胶质瘤(LGG)、头颈部、胃和结肠直肠癌)的信息进行了分析,结果表明,低sGSN水平与高CLEC9A表达患者的生存具有相关性。
随后,研究人员检测了我们检测了LIHC、HNSC和STAD患者F-actin结合蛋白(FABPs)的表达,并进一步根据肿瘤内sGSN转录水平对患者进行分组。结果显示,低sGSN结合FABP突变三种癌症的总生存率具有相关性。
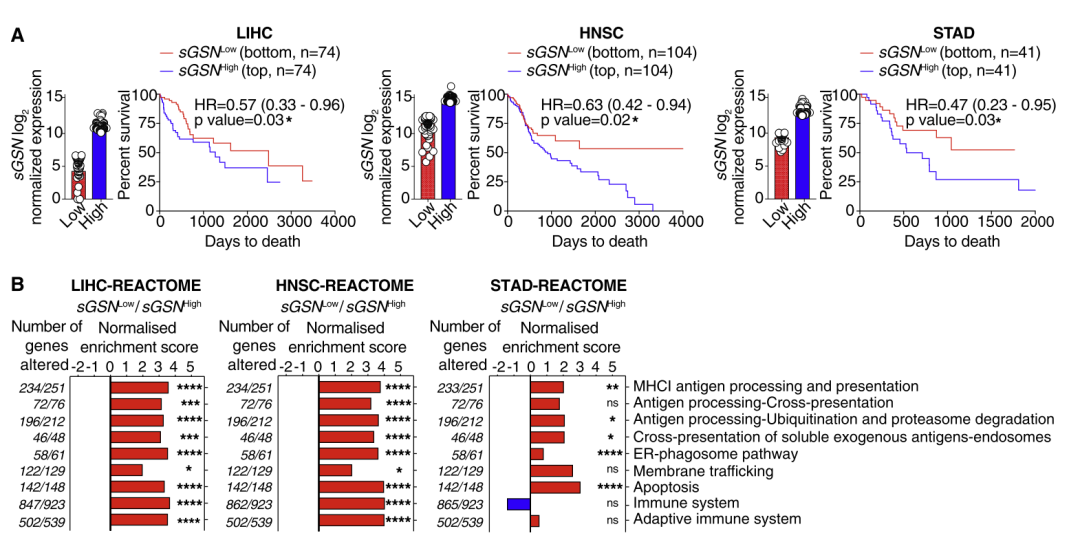
低sGSN水平与高CLEC9A表达患者的生存具有相关性
总体来说,此研究明确了sGSN是此前未被发现的肿瘤免疫逃避相关因子。sGSN抑制DNGR-1活性,同时也抑制了 cDC1 对肿瘤中出现的死细胞相关抗原的 DNGR-1 依赖性交叉呈递,从而促进了癌症的免疫逃避。
因此,瞬时靶向sGSN和F-actin之间的相互作用可能是一种安全有效的肿瘤免疫治疗策略。
原始出处:
Evangelos GiampazoliasOliver SchulzKok Haw Jonathan Lim, et al. Secreted gelsolin inhibits DNGR-1-dependent cross-presentation and cancer immunity. Cell, 2021.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#CEL#
93
#Cell#
85
#研究发现#
79
#分泌#
72
#免疫力#
65
#凝胶#
87