天坛医院徐俊团队发现两个CSF1R小胶质细胞脑病新发内含子突变家系
2023-09-23 神外前沿 神外前沿 发表于上海
该研究首次报道了两个新发内含子剪切突变的独立CSF1R小胶质细胞脑病家系。
近期,首都医科大学附属北京天坛医院徐俊教授团队发表题为“Two Novel Intronic Mutations in the CSF1R Gene in Two Families With CSF1R-Microglial Encephalopathy”的文章。
该研究首次报道了两个新发内含子剪切突变的独立CSF1R小胶质细胞脑病家系,详细描述各家系遗传、临床、多模态影像特征,提出CSF1R小胶质细胞脑病新概念,并使用Cereflow脑血流量CBF计算技术分析携带者早期的脑血流改变,强调了pCASL在CSF1R小胶质细胞脑病早期检测的应用价值,扩大CSF1R小胶质细胞脑病的遗传和影像谱。
相关研究成果在Frontiers in Cell and Developmental Biology发表,AAIC2022会议报道,并被Alzheimer’s Dementia以“POSTER PRESENTATION”报道。
首都医科大学附属北京天坛医院神经病学中心认知障碍性疾病科博士研究生姜季委为论文第一作者,徐俊教授为论文通讯作者。

据了解,集落刺激因子1受体(colony-stimulating factor-1 receptor, CSF1R)小胶质细胞脑病是一类十分罕见的CSF1R基因突变导致小胶质细胞功能障碍的常染色体显性遗传病(全球仅约300例报告)。其平均发病年龄约40岁,临床表现为认知功能下降、精神行为异常、帕金森样运动障碍和癫痫等不同组合,具有高度异质性,容易被误诊为阿尔茨海默病(AD)、多发性硬化、额颞叶痴呆和其他脑白质病等。
CSF1R基因定位于染色体5q32上,大多数基因突变位于由外显子12-21编码的CSF1R酪氨酸激酶结构域,罕见内含子。截至2023年8月,全球共报告了125个突变位点,包括102个错义突变,4个无意义突变,5个插入或缺失,8个移码突变和16个剪接位点突变,并且新发位点仍在不断扩充中。
目前,无论是所有已知的CSF1R突变的功能性改变还是CSF1R小胶质细胞脑病的基因突变的完整遗传谱均未被完全阐明。本研究首次报道了CSF1R两个新的内含子剪切突变(c.2654+1G>A 和c.1858+5G>A)临床家系,进一步分析此疾病病理、遗传、临床和多模态影像学特征之间的潜在联系。
该研究首先描述了两个独立的CSF1R小胶质细胞脑病家系的临床特点、神经心理学评估和多模态神经影像学特点,采用Cereflow脑血流量CBF计算技术分析脑血流灌注改变,利用二代测序(NGS)技术进行全外显子测序或者全基因组测序进行检测,使用Sanger测序进行家系共分离分析和临床表型重新评估证实研究结果。
家系一:
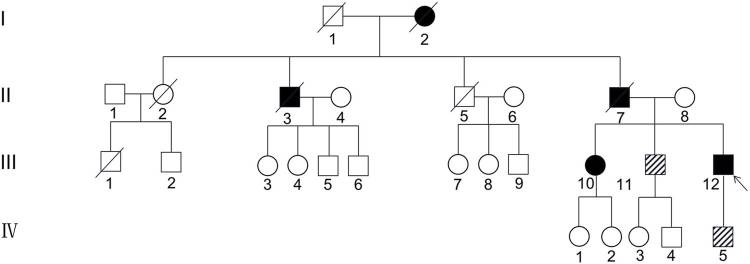
图1 CSF1R小胶质细胞脑病家系图(临床家系一)
左边罗马数字表示世代。箭头表示先证者(III-12)。黑色代表临床受累个体,白色代表未受影响的个体或未知表型的高危个体。斜线代表CSF1R突变患者无症状。
家系一先证者(III-12),男,43岁,高中学历,以“记忆力下降4年,加重伴步态异常、言语不清1年”为主诉入院。神经心理学测评显示:MMSE 15分,MoCA 6分;颅脑磁共振表现为双侧侧脑室旁、胼胝体、深部白质T2WI和FLAIR高信号,DWI高信号,增强扫描未见强化,胼胝体变薄,血管未见明显畸形和狭窄(图一)。基因检测及家系验证显示:5号染色体CSF1R的20号内含子剪切突变(c.2654+1G>A),该突变类型未在ExAC、Human Gene Mutation Database、1000 Genomes Project数据库检索到。dbscSNV软件定义c.2654+1G>A 剪切突变是致病性的(0.999/0.934),可能改变碱基位点,影响正常剪切。
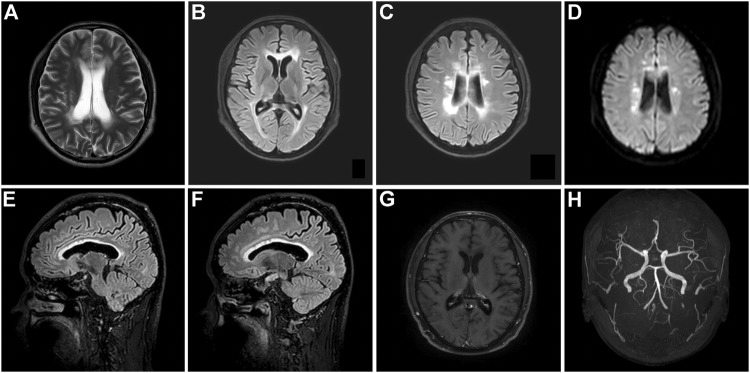
图2 家系一先证者(III-12)颅脑磁共振表现
有趣地是,家系一先证者的哥哥虽然有相同的基因突变,但无明显临床表现,MMSE29分,MoCA 29分,且结构性颅脑磁共振仍未见明显异常,但pCASL显示双侧额顶叶深部白质和侧脑室旁明显低灌注(图3)。

图3 家系一先证者哥哥(III-11)颅脑磁共振表现
结构性磁共振未见明显异常,pCASL提示双侧额顶叶深部白质和侧脑室旁明显低灌注:左侧侧脑室CBF为 15.3 ml/100 g/min(E),右侧侧脑室CBF为18.6 ml/100 g/min(F),顶叶深部白质CBF值为8.6ml/100g/min(G),胼胝体CBF值分别为16.8ml/100g/min和13.5ml/100g/min(H)。
家系二:
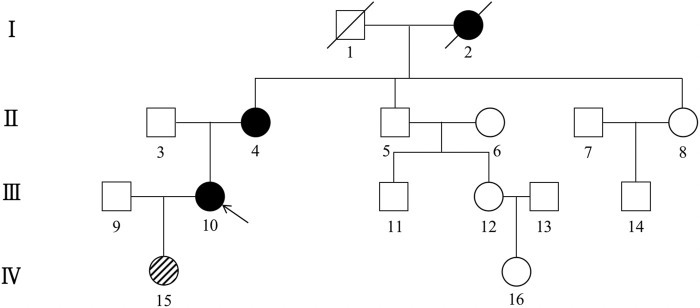
图4 CSF1R小胶质细胞脑病家系图(临床家系二)
左边罗马数字表示世代。箭头表示先证者(III-10)。黑色代表临床受累个体,白色代表未受影响个体或未知表型的高危个体。斜线代表CSF1R突变患者无症状。
家系二先证者(III-10),女,46岁,初中学历,以“记忆力下降和性格改变2年”为主诉入院。神经心理学测评显示:MMSE 26分,MoCA 20分;2年后进展为MMSE4分,MoCA1分。颅脑磁共振表现为双侧侧脑室旁、胼胝体、深部白质T2和FLAIR高信号,胼胝体变薄,DWI隐约可见高信号(图5A-D)。基因检测及家系验证显示:5号染色体上CSF1R的第13号内含子出现c.1858+5G>A剪切突变,该突变类型未在ESP6500、HGMD、dbSNP、1000 Genomes Project数据库检索到;Mutation Taster软件和PROVEAN软件均提示致病的(可能性为0.99),FATHMM-indel软件提示致病的(评分33)。
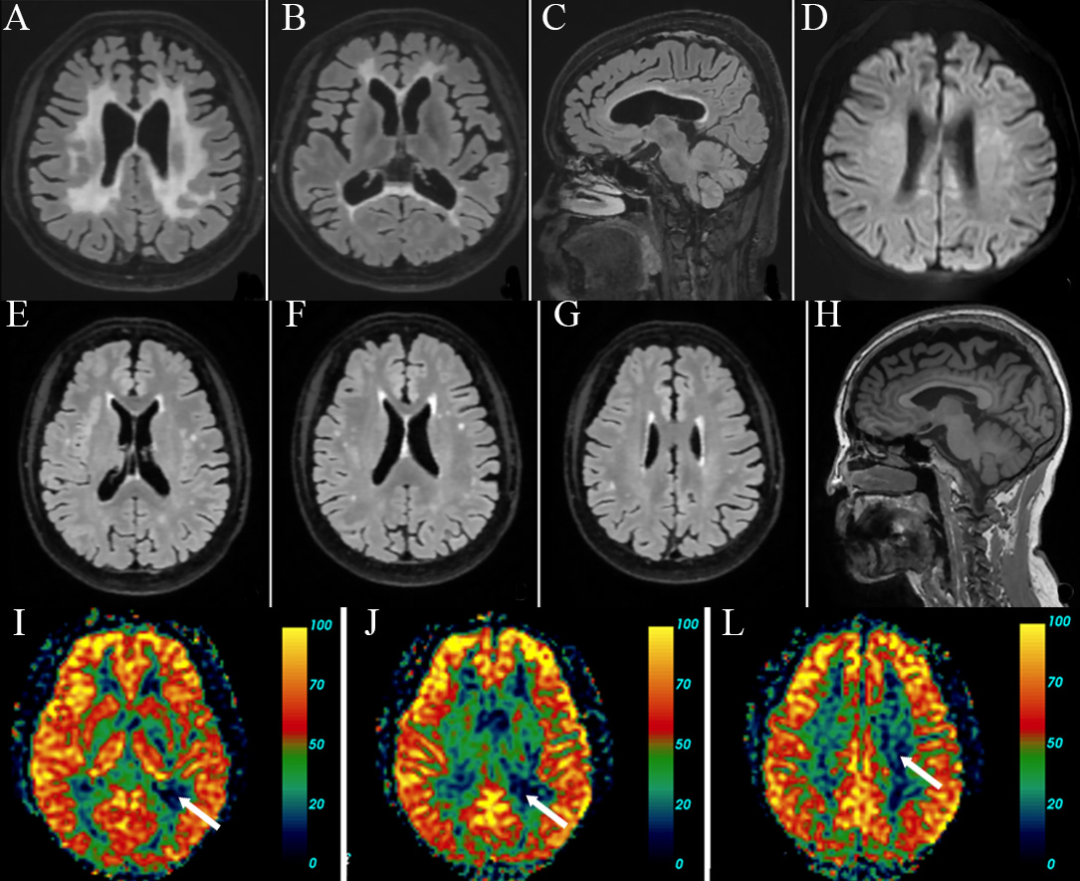
图5 家系二先证者(III-10)颅脑磁共振表现
A-D:双侧侧脑室旁、胼胝体、深部白质T2和FLAIR高信号,胼胝体变薄,DWI隐约可见高信号;E-H:双侧侧脑室旁、胼胝体、额顶叶深部白质散在FLAIR高信号;I-K:PCASL提示左侧为著的皮层下低灌注和皮层高灌注,CBF值分别为15.4 ml/100 g/min(I),17.7 ml/100 g/min(J),8.6 ml/100 g/min(K)。
综上,本研究首次报道了CSF1R内含子中的两个新剪切突变(c.2319+1C>A和c.1858+5G>A),补充了CSF1R小胶质细胞脑病的遗传谱系,也强调了内含子突变对表型的影响。
徐俊教授团队首次提出了“CSF1R小胶质细胞脑病”这一概念,涵盖了该疾病遗传、病理和临床的特点以及之间的密切联系,强调CSF1R突变所致各种表型谱可能为一类疾病。同时,首次强调了pCASL技术在检测早期无症状CSF1R小胶质脑病患者的潜在诊断价值,拓宽了CSF1R小胶质细胞脑病的影像学谱。未来需要进一步功能验证来阐明这两个新的CSF1R内含子突变的致病性。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








