Nature子刊:中南大学杨明华等团队合作发现铁死亡的调控新机制
2022-12-30 iNature iNature 发表于上海
研究表明,SLC47A1通过依赖于PUFA代谢重新布线的独特机制在确定铁死亡抵抗力方面起着重要作用。重要的是,SLC47A1构成了使胰腺癌细胞对铁死亡的药理学诱导敏感的可操作靶标。
铁死亡是一种由不受限制的脂质过氧化和随后的质膜破裂引起的调节性坏死。然而,决定铁死亡敏感性的脂质重塑机制仍然知之甚少。
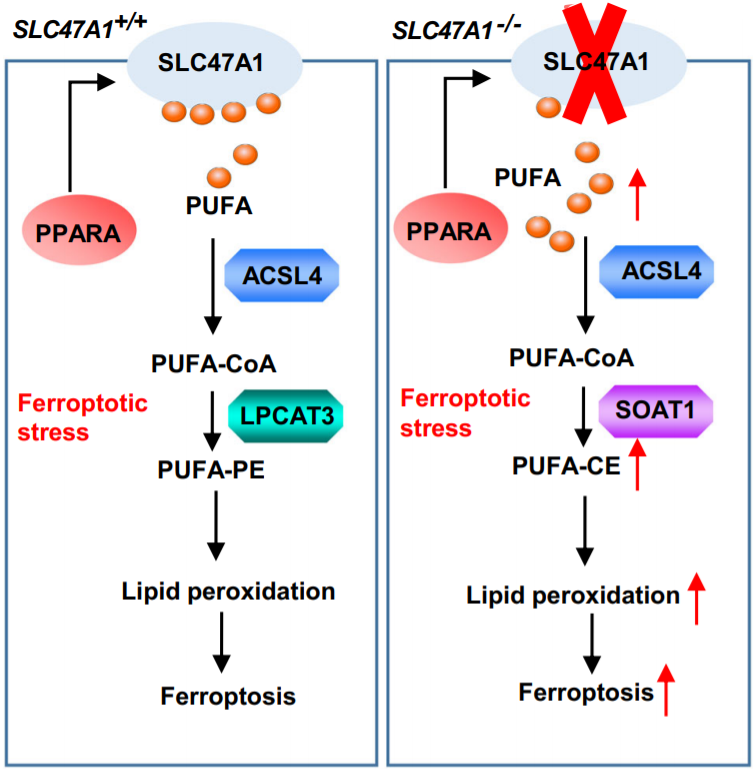
2022年12月27日,中南大学杨明华及德州西南医学中心唐道林共同通讯在Nature Communications发表题为“The lipid flippase SLC47A1 blocks metabolic vulnerability to ferroptosis”的研究论文,该研究报告了脂质翻转酶溶质载体家族47成员1(SLC47A1)作为铁死亡期间脂质重塑和存活的调节剂的先前未被认识到的作用。在分析的49种scramblases, flippases及 floppases中,只有SLC47A1具有mRNA,该mRNA在暴露于铁死亡诱导剂的多个癌细胞中选择性上调。
大规模脂质组学和功能分析表明,SLC47A1的沉默通过有利于ACSL4-SOAT1介导的多不饱和脂肪酸胆固醇酯的产生,增加了RSL3或erastin诱导的铁死亡。研究鉴定出过氧化物酶体增殖物激活受体α(PPARA)作为反式激活SLC47A1的转录因子。PPARA和SLC47A1的耗竭同样使细胞对铁死亡诱导敏感,而SLC47A1的转染增强重表达恢复了PPARA缺陷细胞对铁死亡的抵抗力。PPARA-SLC47A1通路的药理学或遗传阻断增加了小鼠铁死亡诱导剂的抗癌活性。这些发现建立了铁死亡和脂质转运蛋白之间的直接分子联系,这可能为克服耐药性提供代谢靶点。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言