Nucleic Acids Research:李磊团队构建单细胞遗传调控平台解析疾病位点的细胞特异性机制
2023-10-09 测序中国 测序中国 发表于上海
该研究整合了包括eQTLGen联盟,DICE项目和OneK1K在内的304个sc-eQTL数据集,涵盖了57种细胞类型和95种细胞状态,除了涉及外周血外,还囊括了脑和肺组织。
全基因组关联分析(Genome-Wide Association Studies,GWAS)已经确定了数千个与复杂性状和疾病相关的遗传位点,然而超过90%的GWAS风险位点位于非编码区域,这为确定疾病相关变异的分子机制带来了极大的挑战。研究表明,非编码区GWAS风险SNP(Single Nucleotide Polymorphisms)可以通过调控其上下游基因表达来影响疾病的进展[1]。因此,研究人员开发了SNP与基因表达变化关联的分析方法,即表达数量性状位点(expression Quantitative Trait Locus,eQTL)将疾病变异与靶基因联系起来。传统eQTL研究通常评估来自整个组织或样本的数百万个细胞的平均表达水平,掩盖了某些细胞类型或处于特定细胞状态的生物调节关系,只有20-50%的常见疾病关联基因被报道与eQTL共定位[2]。这意味着传统的eQTL在理解疾病相关变异方面有很大的局限性。近些年随着单细胞转录组测序技术的迅速发展,使得单细胞水平的eQTL(single-cell eQTL,sc-eQTL)分析成为可能,sc-eQTL可以在更高的分辨率下研究遗传变异对基因表达的调控关系[3,4]。整合大规模多来源的sc-eQTL数据集对于精细识别疾病因果变异和理解潜在的基因调控机制至关重要,然而,目前缺乏系统性研究多种复杂疾病在细胞水平的精细调控机制。
近日,深圳湾实验室李磊课题组在Nucleic Acids Research上发表文章“scQTLbase: an integrated human single-cell eQTL database”。该研究整合了包括eQTLGen联盟,DICE项目和OneK1K在内的304个sc-eQTL数据集,涵盖了57种细胞类型和95种细胞状态,除了涉及外周血外,还囊括了脑和肺组织。该研究建立了标准化的数据预处理和整合分析流程,将多个来源的sc-eQLT划分为三种类型:①与特定细胞类型表达相关的细胞类型特异性eQTL(Cell-type-specific eQTLs);②与时间或细胞轨迹相关的动态eQTL(Dynamic eQTL);③与外界刺激相关的响应eQTL(Response eQTL)(图1)。
研究团队通过系统地比较不同sc-eQTL在不同细胞类型及不同细胞状态下的差异,发现了易受遗传调控影响的细胞类型,如CD4+ Naive T,以及受遗传调控影响较少的细胞类型,如Plasma和mesothelial;也发现了只处于特定细胞状态下才发生调控作用的sc-eQTL,如TP53在NK细胞中只有在I型干扰素激活下才会受到遗传调控的影响。此外还将sc-eQTL结合GTEx eQTL进行比较分析,挖掘了在群体水平和单细胞水平共享和差异的调控关系,如BIN3在Naive Regulatory T细胞和外周血中都受到突变rs1545837的调控作用。这为疾病风险位点的精细定位提供了宝贵的资源,极大地促进理解遗传变异在细胞水平上的基因调控作用。
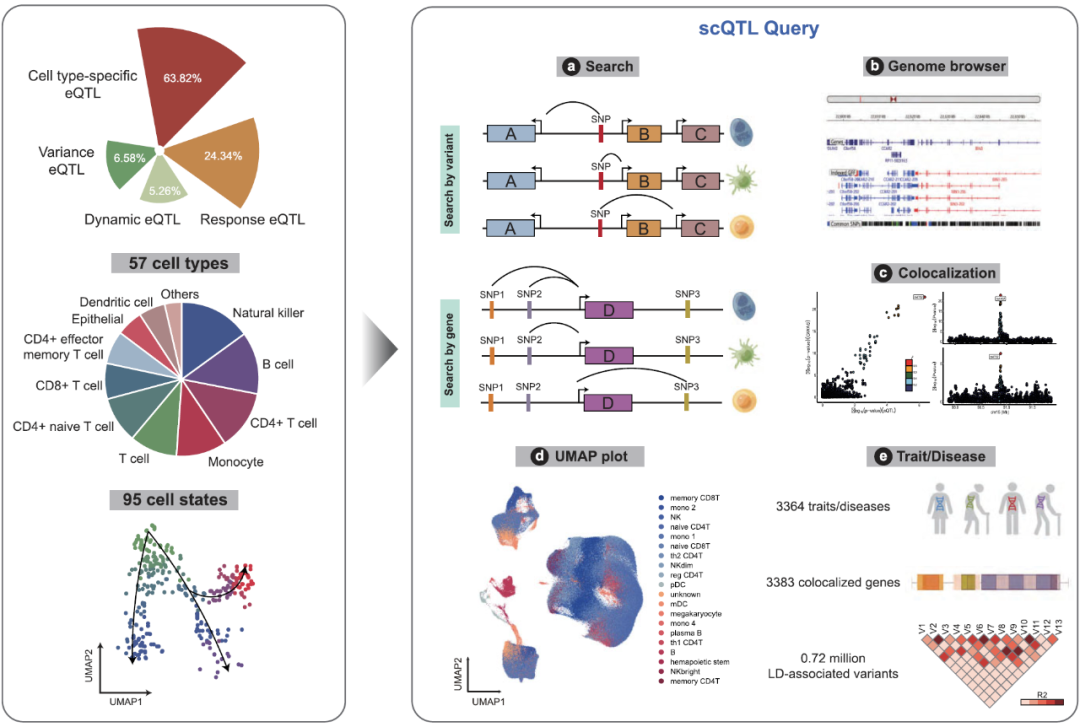
图1. sc-eQTL系统性整合分析
为了研究复杂疾病在多种细胞水平的调控机制,该研究根据GWAS catalog中3333个疾病/表型数据,使用共定位分析方法将sc-eQTL与人类遗传性状和疾病联系起来,并提供GWAS相关的3383个疾病/表型sc-eQTLs,便于进一步研究sc-eQTL在细胞水平的调控机制。如与精神分裂症和双向情感障碍相关的神经元细胞中的共定位基因FURIN、FES,以及内皮细胞中共定位基因HMGN4;与乳腺癌和基底细胞癌相关的上皮细胞中的共定位基因CLPTM1L。
该研究还提供了用户友好的scQTLbase在线交互式分析网站,scQTLbase可以探索多种细胞类型和特定细胞状态下的sc-eQTL,包括通过基因名或突变位点检索sc-eQTL,比较不同细胞类型和不同细胞状态下的调控差异;通过基因组浏览器查看sc-eQTL相关的基因或SNP。此外,该数据库中还提供了GWAS-sc-eQTL共定位事件在线分析服务(Colocalization),用户通过提供GWAS数据便于可视化这些GWAS与sc-eQTL共定位事件,进而深入理解潜在的细胞水平的调控机制。
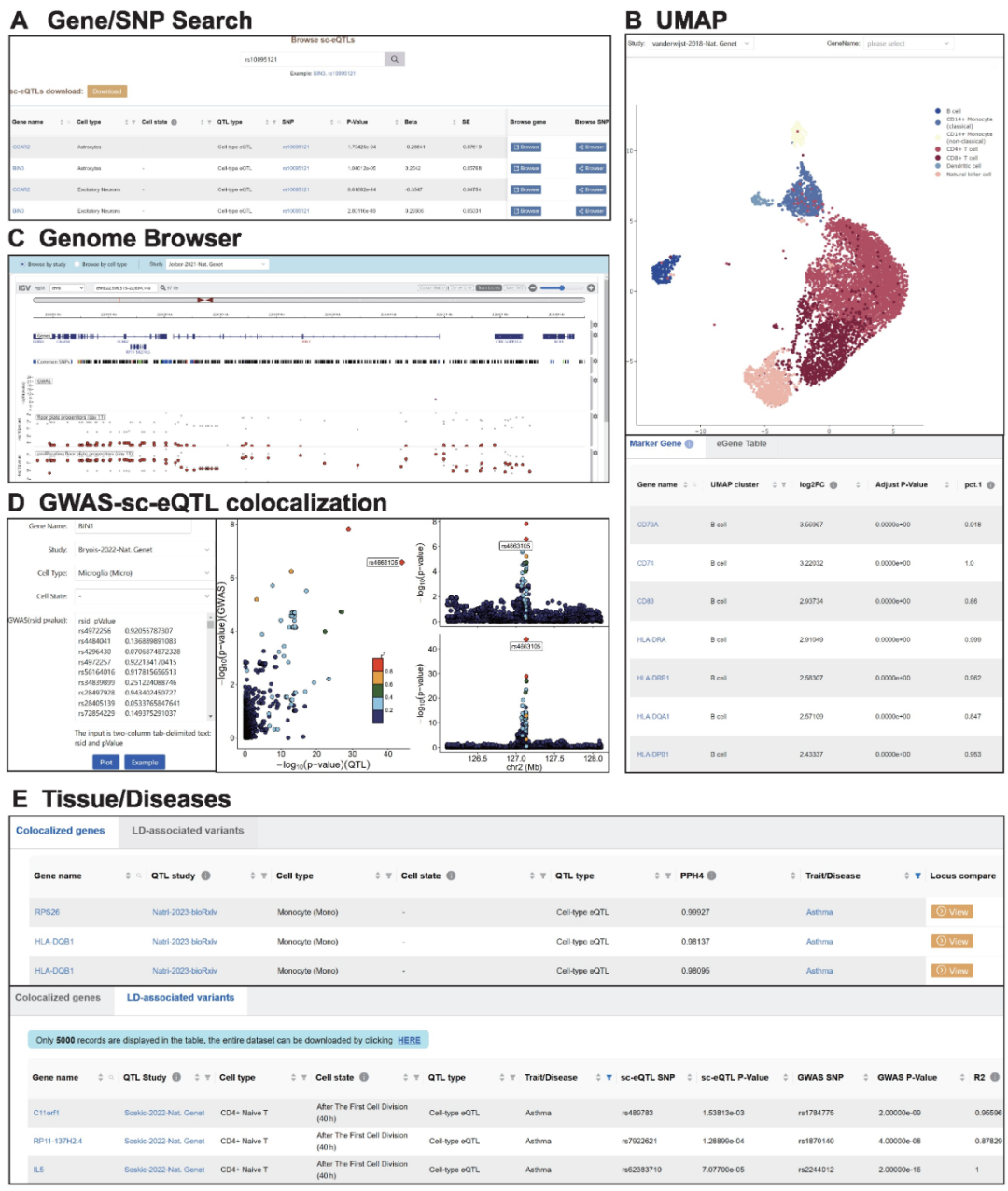
图2. scQTLbase的web界面
深圳湾实验室系统与物理生物学研究所李磊研究员为该论文通讯作者,课题组博士后丁若凡博士、硕士研究生王琪萱和研究助理龚力海为论文共同第一作者。数据库的构建得到了西班牙马德里生物工程、生物材料和纳米医学网络生物医学研究中心研究员Mireya Plass,宁波大学医学院廖奇教授的指导与帮助。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad781/7288825
参考文献:
1. Zhang, F. and Lupski, J.R. (2015) Non-coding genetic variants in human disease. Hum Mol Genet, 24, R102-110.
2. Cuomo, A.S.E., Nathan, A., Raychaudhuri, S., MacArthur, D.G. and Powell, J.E. (2023) Single-cell genomics meets human genetics. Nat Rev Genet, 24, 535-549.
3. Nathan, A., Asgari, S., Ishigaki, K., Valencia, C., Amariuta, T., Luo, Y., Beynor, J.I., Baglaenko, Y., Suliman, S., Price, A.L. et al. (2022) Single-cell eQTL models reveal dynamic T cell state dependence of disease loci. NATURE, 606, 120-128.
4. Yazar, S., Alquicira-Hernandez, J., Wing, K., Senabouth, A., Gordon, M.G., Andersen, S., Lu, Q., Rowson, A., Taylor, T.R.P., Clarke, L. et al. (2022) Single-cell eQTL mapping identifies cell type-specific genetic control of autoimmune disease. SCIENCE, 376, eabf3041.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#单细胞遗传#
86