早在2007年,曾上映过一部台湾喜剧电影《基因决定我爱你》。影片设定在不远的未来,生物科技的发展日新月异,人类DNA测序几乎已经完成,决定命运的基因被一个个解开。影片中,人可以藉由操控基因表型的药物,改变自己的个性和命运。该影片讲述了在基因药物已经被普遍运用的年代,两位主角分别因为洁癖和肥胖而影响到感情,最终通过借助基因药物,改变了自己的性格和命运。
而在现实生活中,基因疗法并不是什么新鲜的词。基因疗法的基本理念听起来非常简单:通过引入正确功能基因或阻断错误基因的表达来操控具有缺陷的DNA表达。事实上,基因疗法已不止一次地被称作“又一大热门”。20世纪90年代末,由于基因疗法在临床试验中被发现导致极高死亡率,自此顿然失宠。诸多报道称,该领域的投资日趋萎缩,但是,基因疗法的研究从未真正停止过。在沉寂了十多年后,基因疗法在去年迎来了诸多好消息。许多人相信,经过改良后的基因疗法,在今年将迎来新的突破。
1.从热门到冰点
1990年,美国国家食品药品监督管理局正式批准了第一个基因治疗临床试验,美国国立卫生研究院进行了世界上首次人体基因治疗的临床试验。一名年仅4岁患有先天性腺苷脱氨酶缺乏症的小女孩,经过基因治疗技术导入正常的腺苷脱氨酶基因,患儿的免疫能力得以提高,获得了明显的治疗效果。这项临床试验的成功是当今生物医学发展最重要的篇章。此后,世界各国都掀起了基因治疗的研究热潮。那段时间,许多人认为这预示着基因治疗时代的到来。
然而,在1999年,时任宾夕法尼亚大学人类基因疗法研究所负责人的吉姆·威尔森教授开启了一项基因疗法针对先天性鸟氨酸转甲酰酶缺陷症的临床试验。宾大的科学家们改造出了一种弱化的病毒,它们能将基因引入患者的肝脏,恢复肝脏代谢氨的能力。美国18岁少年Jesse Gelsinger,也是该项目的倒数第二名患者,在接受基因治疗后,体内产生了严重的免疫反应,并于4天后去世。这名18岁少年成为了首名死于基因疗法临床试验的患者。一场试验的失败,让科学家吉姆从明星科学家一夜沦为罪人。
吉姆·威尔森教授
FDA调查认为吉姆没能及时制止这场悲剧的发生,随之而来的,美国FDA终止了该大学的8项正在进行中的基因治疗临床试验。吉姆因此被研究所解职,五年内不得参与任何人体试验。吉姆的课题组人数锐减80%,而人类基因疗法研究所现在也早已关闭。
虽然后期的调查结论证明,问题其实并不在基因治疗本身。死者在治疗前正在发热,其用药量也明显超过FDA批准的标准且未上报。尸检和实验室检查结果表明,门静脉大剂量注射重组腺病毒激发了该例患者机体致命的免疫反应,导致多器官衰竭而死亡。这显然是主诊医师为了尽快将基因治疗推向临床而违规操作的结果,与进行的基因治疗制品本身无直接关系。但是,基因疗法依旧因此遭受重创,人们对基因治疗的热情骤然间降至冰点。
随后的2002年底到2003年,法国巴黎Necker儿童医院报道重症联合免疫缺陷综合征接受基因治疗的患者中,有2例出现了类白血病样症状。这2例患儿发生类白血病的原因可能与采用的鼠白血病病毒载体的整合位点有关,导致某些细胞的失控性生长。这次源于法国的事件经过媒体的广泛报道和渲染,又一次引发了公众对基因治疗安全性危机的大讨论。从此,人们对基因治疗的期望跌到了低谷,基因治疗临床试验受到了更严格的监管,安全示范标准比其他治疗方法设置的都要高出很多。
另一备受关注的失败案例是Mydicar,该基因治疗药物曾有望帮助心功能不全患者不必接受心脏移植,但其在II期临床试验阶段彻底失败,随后于2015年7月被终止开发。
2.沉寂多年后的自我救赎
客观审视早期基因疗法的发展,是不能否定基因疗法的有效性的。尤其是逆转录病毒载体已在临床试验中应用了3000多例患者,总体上是安全的。相对于数千例正在接受基因治疗的患者来说,发生不良反应的可能性是很低的,甚至低于许多目前正在进行临床试验的药物。
法国巴黎Necker儿童医院实践中,接受基因治疗后幸存下来的9例患儿,能够离开无菌病房回到家中,正常生活。如果没有做基因治疗, 很难想象他们会是什么结果。基因疗法主要针对无法治愈的疾病,新的医疗手段给患者带来的希望,利远远大于弊。如果人们期望一种新的治疗手段是绝对安全的,那么未来将没有任何新的医疗手段。
许多专家认为,基因疗法失败的原因部分是源于其递送机制以及脱靶效应,因此,找到更安全的载体,成为了基因疗法的关键,这也成了闭门思过的吉姆威尔森教授钻研的方向。幸运的是,他以猴子为模型,找到了一批安全高效的载体病毒。
时至2009年,基因疗法在经过多年沉寂之后,频频传来好消息。一系列基因疗法试验的成功表明,该领域已逐步摆脱过去失败的阴影,重新燃起新的希望。2009年岁末,《科学》杂志评出2009年十大科学突破,与生命科学有关的突破有4项,位列第7的就是“基因疗法卷土重来”。
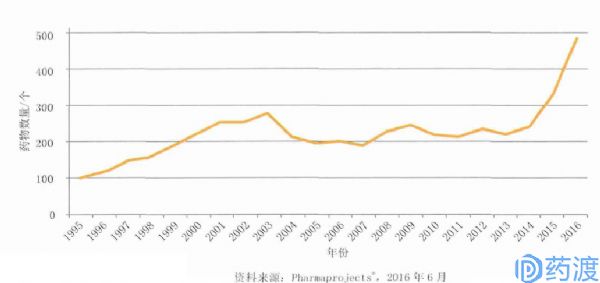
眼下,基因疗法项目确实正逐渐赢回产业界的信心,据统计,相关投资金额在2009-2011年间出现下滑以及2012-2013年间再现走低之后,近几年呈现最大增长,2014-2015年和2015-2016年间分别增长37%和47%。随着投资的增加,该领域研究进展的相关报道也在增多。
1995—2016年在研基因疗法药物数量增长趋势
2016年,业内听到了许多关于基因疗法的好消息。这也让很多人相信,基因疗法将在2017年大放异彩。果然,2017年,基因疗法的好消息不断。8月份,由诺华带来的突破性CAR-T疗法Kymriah获批,用于白血病的治疗。几周后,Kite Pharma的又一款CAR-T疗法Yescarta获批,治疗淋巴瘤。这不但是人类历史上前两款获批的CAR-T疗法,也是在美国境内获批的前两款基因疗法。这两款CAR-T疗法都遵循了FDA体细胞疗法和基因疗法指南,对活体细胞的遗传物质进行修改,并用于人类的治疗。不少行业资深人士也依旧在期盼着“体内给药式”基因疗法的到来。
两款CAR-T疗法
美国Sangamo Therapeutics公司利用锌指核酸酶(ZFN)技术实现人类历史上首次患者体内基因组的编辑。紧接着,12月,由Spark Therapeutics带来的基因疗法Luxturna获批上市,用于治疗患有特定遗传性眼疾的儿童和成人患者。它更符合人们对基因疗法的想象 - 通过注射腺相关病毒载体把健康的基因送入所需的人体细胞内,合成具有正常功能的蛋白。简单的生物学原理,为人生深陷黑暗的患者带来了光明。美国FDA局长Scott Gottlieb博士在Luxturna获批的官方通告中说道:“这个里程碑进一步强调了这一突破性方法有望治疗广泛疾病的潜力。几十年来的研究努力在今年为罹患严重和罕见疾病的患者带来了3款基因疗法。我相信基因疗法会成为治疗的主流,甚至有望治愈许多最为严重和棘手的疾病。”
临床阶段的好消息也是接连不断。Spark公司在Voretigene Neparvovec外,还开发了一款叫做SPK-9001的产品,它同样获得了美国FDA颁发的突破性疗法认定,用于治疗乙型血友病。美国科学院首度为生殖细胞的基因编辑松口。药明康德集团合作伙伴Sangamo Therapeutics宣布其在研疗法SB-913完成了首例患者给药。Bluebird Bio的基因疗法Lenti-D取得了令人鼓舞的临床结果。通过编辑干细胞,这款疗法可将含有正常功能的ABCD1基因引入到细胞内。据资料显示,目前美国注册的基因疗法临床试验约有3000项,日本与中国注册的基因疗法分别有将近1000项,其中进入Ⅱ/Ⅲ期的基因治疗临床试验方案近500项,共有7个基因治疗产品已经在美国、欧盟、中国等国家上市。苏州瑞博与美国Quark制药公司开发的小核酸药物QPI-1007于2015 年12月获得国家食品药品监督管理局批准,成为中国第一个获批临床试验的小核酸药物。苏州瑞博董事长预计今年将有3个小核酸药物进入临床申报,明年将有2个小核酸药物进入临床申报。准备申报的药物治疗领域涉及眼疾、糖尿病、前列腺癌、乙肝和脑梗等病症。
当然,虽然好消息不断。基因疗法仍是一个高风险研发领域,如Juno Therapeutics公司开发的CAR-T细胞基因疗法候选药物在II期临床试验中造成3例死亡;Adaptimmune公司开发的用于黏液样圆细胞型脂肪肉瘤的T细胞治疗产品包括其计划内的关键性临床研究被部分叫停,但据报道,不是由于安全性问题。同时,基因疗法一直以来面临的诸如导入基因的表达和调控问题,许多基因早期诊断困难,缺乏对靶细胞定向导入基因的技术,基因治疗载体的安全性和有效性问题,甚至是伦理道德问题一面没有很好地解决办法,面临重要挑战。
此外,也要关注基因药物的投资回报问题。高昂的治疗费用,让普通患者望而却步。格利贝拉是第一个在西方国家获准上市的基因药物,用于治疗罕见性遗传病—脂蛋白脂肪酶缺乏症。但这一历经25年研发才艰难问世的药物,因定价太高和需求不足而退出市场。
展望基因疗法,乐观地估计,随着新技术的发展,基因疗法会成为多种疑难杂症如免疫缺陷病、肿瘤等治疗的重要选择,并发挥积极作用。随着生物工程技术的完善和基因表达调控系统的突破,基因靶向药物将成为制药工业的一个重要类别。
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言