J Neurosci:抗癌药保护阿尔茨海默氏症神经损伤作用
2012-04-10 Beyond 生物谷
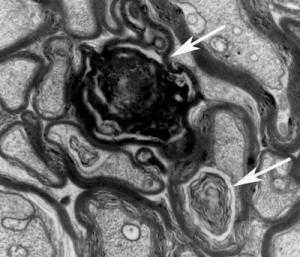
老年痴呆症小鼠模型的神经横截面的电子显微照片,箭头表示神经结构异常部位 根据一项新的研究证实,一种已经进步II期临床试验实验的、治疗癌症的化合物能在阿尔茨海默氏症的动物模型减慢神经损伤和改善大脑功能。3月13,Journal of Neuroscience杂志刊登的一则研究表明:埃博霉素D(EpoD)在阿尔茨海默氏病的小鼠模型(AD)中能有效地防止神经损伤、改善认知表现。这些结果接揭示将来或许该

老年痴呆症小鼠模型的神经横截面的电子显微照片,箭头表示神经结构异常部位
根据一项新的研究证实,一种已经进步II期临床试验实验的、治疗癌症的化合物能在阿尔茨海默氏症的动物模型减慢神经损伤和改善大脑功能。3月13,Journal of Neuroscience杂志刊登的一则研究表明:埃博霉素D(EpoD)在阿尔茨海默氏病的小鼠模型(AD)中能有效地防止神经损伤、改善认知表现。这些结果接揭示将来或许该药物能用于早期AD患者治疗。
研究者从宾夕法尼亚大学Perelman医学部医学博士、文章第一作者张斌博士、高级研究员和资深作家、神经退行性疾病研究中心药物发现部主任Kurt R. Brunden博士,将EpoD给予记忆障碍的大脑衰老小鼠,大脑衰老小鼠大脑有类似的tau蛋白折叠错误缠绕现象(AD的一个标志)。在神经细胞中,tau蛋白正常的稳定结构称为微管结构,蛋白折叠缠绕可能危及微管稳定,导致神经细胞受损。增加微管稳定性的药物可以提高AD等大脑中又蛋白缠绕形成的其他疾病中神经-细胞功能。
类似FDA批准的抗癌药物紫杉醇,EpoD也有相同的稳定微管作用机制。这些药物防止癌细胞增殖通过稳定在细胞分裂染色体分离过程中发挥作用的特定微管。然而,宾州大学的研究人员证实,EpoD不像紫杉醇,EpoD很容易进入大脑因此可能用于治疗AD和相关疾病。
相比于没有接受药物的AD小鼠,接收EpoD三个月后的老年AD小鼠的大脑中没有额外的tau clumps形成,神经-细胞功能也增加。更重要的是,EpoD处理的小鼠学习和记忆都得到改善。重要的是,产生这些功效的EpoD的剂量要比原先二期临床试验中在癌症病人上使用的剂量要低得多。研究者利用转基因小鼠,在小鼠给予EpoD后并没有观察到副作用包括抑制免疫系统和周围神经损伤。
这些结果表明低剂量的EpoD可能对AD和相关的神经退行性疾病如额颞叶变性或进行性核上性麻痹具有治疗效果。
文章合著者CNDR主任、Virginia M.-Y. Lee博士、宾夕法尼亚大学老龄研究所和CNDR的主任John Trojanowski博士介绍说利用微管稳定药物以抵消tau蛋白缠绕、弥补tau正常功能损失的概念15年前就出现了。
宾夕法尼亚CNDR的研究人员与文章其他作家Amos B. Smith III博士,罗德·汤普森化学系教授和宾夕法尼亚大学化学系Carlo Ballatore博士共同合作,早期在AD小鼠模型中研究评价了EpoD对微管稳定性的作用。EpoD不像其它许多稳定微管的化合物,EpoD很容易进入大脑,相比于存在血液中的时间,EpoD存在于大脑里有更长的时间。此功能特征可以解释为什么低剂量在AD小鼠模型中是同时有效、又是安全的。
这项新研究是对早先发表在2010年10月《神经科学杂志》上的研究的延伸拓展。
这项研究是由国家衰老研究所和Marian S. Ware阿尔茨海默计划资助。(生物谷:Bioon)

doi:10.1523/JNEUROSCI.3059-10.2010
PMC:
PMID:
Epothilone D Improves Microtubule Density, Axonal Integrity, and Cognition in a Transgenic Mouse Model of Tauopathy
Kurt R. Brunden1,*, Bin Zhang1,*, Jenna Carroll1, Yuemang Yao1, Justin S. Potuzak2, Anne-Marie L. Hogan2, Michiyo Iba1, Michael J. James1, et al.
Neurons in the brains of those with Alzheimer's disease (AD) and many frontotemporal dementias (FTDs) contain neurofibrillary tangles comprised of hyperphosphorylated tau protein. Tau normally stabilizes microtubules (MTs), and tau misfolding could lead to a loss of this function with consequent MT destabilization and neuronal dysfunction. Accordingly, a possible therapeutic strategy for AD and related “tauopathies” is treatment with a MT-stabilizing anti-cancer drug such as paclitaxel. However, paclitaxel and related taxanes have poor blood–brain barrier permeability and thus are unsuitable for diseases of the brain. We demonstrate here that the MT-stabilizing agent, epothilone D (EpoD), is brain-penetrant and we subsequently evaluated whether EpoD can compensate for tau loss-of-function in PS19 tau transgenic mice that develop forebrain tau inclusions, axonal degeneration and MT deficits. Treatment of 3-month-old male PS19 mice with low doses of EpoD once weekly for a 3 month period significantly improved CNS MT density and axonal integrity without inducing notable side-effects. Moreover, EpoD treatment reduced cognitive deficits that were observed in the PS19 mice. These results suggest that certain brain-penetrant MT-stabilizing agents might provide a viable therapeutic strategy for the treatment of AD and FTDs.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#阿尔茨海#
90
#阿尔茨海默氏#
91
#阿尔茨#
61
#抗癌药#
66
#ROS#
88
#损伤#
80
#阿尔茨海默#
81
#神经损伤#
102