论著|帕金森病心血管系统自主神经功能与排尿症状相关性研究
2024-12-05 中国神经精神疾病杂志 中国神经精神疾病杂志 发表于陕西省
本研究旨在探究PD患者自主神经功能改变中心血管系统与排尿症状之间的相关性,揭示可能的共同病理生理机制,进而为PD患者的全面评估和个体化治疗提供理论依据。
摘 要
目的 探讨帕金森病(Parkinson disease, PD)患者心血管系统自主神经功能与排尿症状之间的相关性。
方法 回顾性分析2020年11月至2023年7月就诊于广东省人民医院神经内科的PD患者临床资料。根据是否伴有夜间高血压(nocturnal hypertension, NH),将患者分为两组:有夜间高血压的PD患者(PD-NH组)和无夜间高血压的PD患者(PD-nNH组),对排尿指标进行组间比较。根据24 h动态血压监测(ambulatory blood pressure monitoring, ABPM)测量值计算血压平均真实变异性(average real variability, ARV),并使用广义线性模型分析其相关指标。
结果 87例PD患者中,46例(52.87%)存在NH。PD-NH组膀胱残余尿量(post void residual, PVR)[1.00(0.00, 21.25)mL]多于PD-nNH组[0.00(0.00,5.50)mL],差异有统计学意义(U=1147.000,P<0.05)。经广义线性模型分析,PD患者ARV主要受性别(OR=1.234,95% CI: 1.050~1.451)和PVR(OR=1.003,95% CI: 1.001~1.005)影响。
结论 在PD患者自主神经功能障碍中,心血管系统与泌尿系统之间存在相关性。
关键词 帕金森病;心血管系统自主神经功能障碍;下尿路症状;夜间高血压;血压变异性;膀胱残余尿量
帕金森病(Parkinson disease, PD)是一种常见的神经退行性疾病,以静止性震颤、运动迟缓、肌强直、姿势步态异常等运动症状为突出临床表现[1]。此外,还存在很多常见的非运动症状[2],包括自主神经功能障碍、认知障碍和睡眠障碍[3]等。PD患者自主神经功能障碍可累及泌尿系统、心血管系统和消化系统等多个系统,显著降低患者生活质量[4]。并且早期出现的自主神经功能障碍可能加速PD疾病进展[5-6]。PD患者出现夜间高血压(nocturnal hypertension, NH)、血压平均真实变异性(average real variability, ARV)增高都提示可能存在心血管自主神经功能的改变,并且对心脑血管事件的发生具有预测意义[7-8]。常见的PD患者下尿路症状包括储尿异常(尿频、夜尿增多等)和排尿异常(排尿无力、膀胱排空不完全等)[9]。目前尿动力学检测和残余尿量(post void residual, PVR)测定是有效评估下尿路症状的观测指标[10]。尽管心血管系统和泌尿系统的自主神经功能障碍在PD患者中均有较高的发生率,现有研究多集中于单一系统的自主神经障碍,而忽略了这些系统之间可能存在的关联。实际上,心血管和泌尿系统的自主神经功能可能存在共同的病理生理机制;心血管、泌尿系统与中枢神经系统之间复杂的交感神经通路也可能存在相互影响[11-12]。因此,本研究旨在探究PD患者自主神经功能改变中心血管系统与排尿症状之间的相关性,揭示可能的共同病理生理机制,进而为PD患者的全面评估和个体化治疗提供理论依据。
1 对象与方法
1.1 研究对象 收集2020年11月至2023年7月就诊于广东省人民医院神经内科的PD患者。纳入标准:①由经验丰富的神经内科主任医师确认符合国际运动障碍协会(Movement Disorders Society, MDS)2015年帕金森病诊断标准[13]的原发性PD患者;②年龄40~80岁;③已完成相关检查,包括神经功能评估、尿流率检查、超声下PVR测定和24 h动态血压监测(ambulatory blood pressure monitoring, ABPM)。排除标准:①合并有脑出血、脑梗死、颅脑肿瘤等其他神经系统疾病者;②合并有糖尿病、甲状腺功能异常、自身免疫性疾病、恶性肿瘤等可能影响自主神经功能者;③正在服用影响自主神经功能药物者;④高血压超过3级、高血压病程超过10年,或长期规律服用β受体阻滞剂类降压药者;⑤合并心力衰竭、严重心律失常等器质性心脏病者;⑥合并慢性肾脏病、肾功能衰竭、急性泌尿道感染,或因前列腺增生而服用药物或接受手术者。
本研究为回顾性研究,经广东省人民医院伦理委员会审核批准(伦理号:KY-Q-2022-327-01)。
1.2 临床评估 收集PD患者一般资料,包括年龄、性别、既往史、病程等。研究纳入的所有PD患者接受过详细的结构化问卷评估,并保证评估时间与相关检查完成时间间隔不超过1周。评价运动症状采用改良Hoehn-Yahr分级(H-Y分级)和国际运动障碍协会统一的帕金森病量表第Ⅲ部分(Movement Disorders Society‐unified Parkinson’s disease rating scale part Ⅲ, MDS-UPDRS Ⅲ)(对于初诊患者在未服药状态进行评估,对于已用药患者在药物“关期”进行评估);评价自主神经功能采用中文版复合自主神经症状量表(composite autonomic symptom score,COMPASS-31量表)[14],包括体位性头晕(orthostatic intolerance,满分10分)、皮肤血管收缩性(vasomotor,满分6分)、分泌活动(secretomotor,满分7分)、胃肠道功能(gastrointestinal,满分28分)、膀胱功能(bladder,满分9分)和瞳孔活动(pupillomotor,满分15分)六部分,记录各部分得分并计算加权后的总分。以上量表评分越高,表示相关临床症状越严重。
1.3 24 h 动态血压监测(24 h ABPM) 采用北京迪姆有限公司生产的DMS⁃ABP2动态血压监测仪自动化监测24 h血压。检测仪袖带固定于非优势侧上臂,袖带下缘在肘窝上2~3 cm,感知探头固定于肱动脉搏动明显处,嘱患者保持日常工作状态,注意避免过度激动或劳累。日间(8: 00至22: 00)每30 min测量1次血压,夜间(22: 00至次日8: 00)每60 min测量1次血压。要求有效读数占总测量次数的70%以上,白天至少有20个有效读数,夜间至少有7个有效读数[15]。
依据是否存在NH进行分组,将纳入的PD患者分为两组:有夜间高血压的PD患者(PD-NH)和无夜间高血压的PD患者(PD-nNH)。根据24 h ABPM结果,夜间平均收缩压≥120 mmHg(1 mmHg ≈ 0.133 kPa)和(或)夜间平均舒张压≥80 mmHg,定义为存在夜间高血压[16]。本研究中一致将22: 00至次日8: 00之间的测量值视为夜间测量值。
ARV的计算:根据24 h ABPM结果,每连续两次有效测量值之间血压差值绝对值的平均数定义为血压平均真实变异性[17]。分别计算收缩压、舒张压的ARV值。
1.4 排尿检测 采用智能尿流动力学检测仪(德国安多美达公司)进行尿流率检查。检查时禁用镇静类药物,检查前嘱患者饮水500~1000 mL。在尿意明显时进行检测,采用日常排尿体位进行排尿,以尿线冲击尿流计。参照国际尿控协会提出的标准[18],记录指标包括:最大尿流率、平均尿流率、排尿量、实际排尿时间、总排尿时间、达到最大尿流率的时间、尿流加速度和排尿延迟时间。并在患者自述排空膀胱后通过超声探测排尿后残余尿量(post void residual, PVR)。
1.5 统计学方法 采用SPSS 20.0进行统计分析。计数资料用例数(百分比)表示,组间比较使用χ2检验。计量资料参照Shapiro-Wilk正态性检验,符合正态分布的计量资料用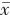 ±s描述,组间比较使用独立样本t检验;不符合正态分布的计量资料用M(QL,QU)表示,组间比较使用Mann-Whitney U检验。用Spearman相关性检验分析非正态分布的连续变量之间的相关性。多因素分析采用广义线性模型中具有对数链接的Gamma模型。采用双侧检验,检验水准α=0.05。
±s描述,组间比较使用独立样本t检验;不符合正态分布的计量资料用M(QL,QU)表示,组间比较使用Mann-Whitney U检验。用Spearman相关性检验分析非正态分布的连续变量之间的相关性。多因素分析采用广义线性模型中具有对数链接的Gamma模型。采用双侧检验,检验水准α=0.05。
2 结果
2.1 一般资料 最终纳入87例,男46例,女41例,年龄(59.54±8.18)岁,伴有前列腺增生10例(仅为超声下提示,未经诊治;占男性患者21.74%,占总数11.49%),伴有高血压共16例(18.39%,6例为高血压1级,10例为高血压2级)。
PD-NH组46例(52.87%),PD-nNH组41例(47.13%)。组间比较发现,相较于PD-nNH患者,PD-NH组患者H-Y分级较高(U=1191.000,P=0.027)、合并有高血压的比例更高(χ2=6.336,P=0.012)。两组间在性别、年龄、复合自主神经症状评分等其余指标的差异均无统计学意义(表1)。
表1 PD患者的一般资料分析Tab.1 Analysis of general information of PD patients
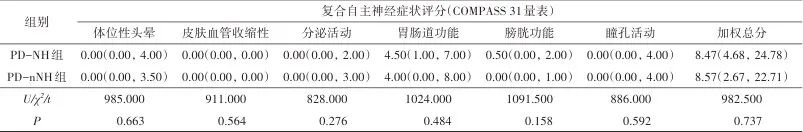
注:H-Y, Hoehn Yahr stage, Hoehn-Yahr分级;MDS-UPDRS III, Movement Disorders Society-Unified Parkinson’s Disease Rating Scale part Ⅲ, 运动障碍协会统一帕金森病评价量表第三部分;BMI, 体质指数;PD-nNH, PD patients without nocturnal hypertension, 无夜间高血压的帕金森病患者;PD-NH, PD patients with nocturnal hypertension, 有夜间高血压的帕金森病患者。
排尿指标明显受性别因素影响,女性的最大尿流率[12.80(8.75, 18.80)mL/s vs.7.20(4.68, 10.93)mL/s,U=1468.500,P<0.001]、排尿量[179.00(91.50, 248.50)mL vs. 88.00(52.25, 135.75)mL,U=1341.500,P=0.001]、加速度[1.90(1.15, 2.45)mL/s2 vs. 0.95(0.40, 1.40)mL/s2,U=1472.000,P<0.001]、PVR[5.00(0.00, 24.00)mL vs. 0.00(0.00, 6.88)mL,U=1165.500,P=0.032]常大于男性。女性患者PVR与MDS-UPDRS Ⅲ得分之间呈正相关(r=0.311,P=0.048);男性患者最大尿流率(r=-0.399,P=0.006)、平均尿流率(r=-0.420,P=0.004)与MDS-UPDRS Ⅲ得分之间呈负相关,延迟时间(r=0.334,P=0.023)与MDS-UPDRS Ⅲ得分之间呈正相关。
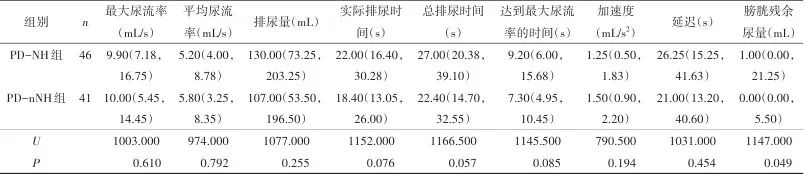
2.2 有无NH的PD患者排尿指标的比较 两组间排尿指标的比较只有PVR的组间差异有统计学意义(表2)。相较于PD-nNH组,PD-NH组患者PVR更多[1.00(0.00, 21.25)mL vs.0.00(0.00, 5.50)mL,U=1147.000,P=0.049],而其余排尿指标组间差异没有统计学意义(P>0.05)。
表2 PD-nNH和PD-NH两组间排尿指标的比较Tab.2 Comparison of urinary evaluations between PD-nNH and PD-NH
2.3 关于ARV的相关因素分析 使用广义线性模型中具有对数链接的Gamma模型进行分析,因变量为24 h舒张压ARV,模型纳入的自变量包括:性别、年龄、病程、有无高血压、MDS-UPDRS Ⅲ得分、最大尿流率和PVR。模型的拟合优度较好,AIC为415.604,BIC为437.797,参数估计和假设检验结果见表3。性别和PVR在模型中对因变量的影响有统计学意义,其余变量对因变量的影响无统计学意义(P>0.05)。男性患者的ARV是女性的1.234倍(P=0.011,OR=1.234,95% CI: 1.050~1.451)。PVR与ARV呈正相关(P=0.008,OR=1.003,95% CI: 1.001~1.005),表明PVR每增加一个单位,ARV增加0.3%。
表3 对于ARV的具有对数链接的Gamma模型分析Tab.3 Log-Gamma regression analysis of ARV
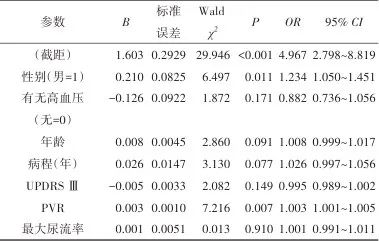
注:具有对数链接的Gamma模型,因变量为24 h舒张压ARV。
3 讨论
本研究通过分析NH和ARV与尿流率、PVR之间的关系探究PD患者心血管系统自主神经功能与排尿症状之间的相关性。研究结果显示,相较于PD-nNH组,PD-NH组患者PVR更多;PD患者24 h舒张压ARV受性别和PVR影响。提示PD自主神经功能障碍可能在多个系统中存在相关性,表明心血管和泌尿系统自主神经功能障碍可能存在相似的病理生理机制或者共同的神经通路。
本研究中,46例(52.87%)PD患者存在NH,与既往研究基本一致[19]。PD患者出现NH,主要是由于自主神经功能障碍,与交感神经在夜间异常的过度激活密切相关,继而影响血压昼夜节律[20]。同时,由于交感神经与副交感神经的相互调节功能出现异常,PD患者会表现出血压变异性升高[21],并且有研究认为较高的ARV对心脑血管事件的发生具有一定的预测价值[22]。一般来说,在46~65岁正常人群中,当排尿量不少于150 mL时,男性最大尿流率应超过12 mL/s,女性应超过15 mL/s[23]。本研究结果显示PD患者存在一定程度的排尿量减少、尿流率下降和PVR增多,同时发现多个排尿指标受到性别因素影响,与既往研究结论一致。
值得注意的是,既往研究常使用量表评估PD患者自主神经功能,然而本研究根据COMPASS量表评分进行分析时发现,PD-nNH组与PD-NH组在COMPASS量表各系统子分数及总分上的差异均无统计学意义。此外,所有的排尿指标与COMPASS量表膀胱部分得分之间相关性均无统计学意义,提示量表评分可能受到主观因素影响。不同于既往研究多使用量表评价自主神经功能,本研究采用了ARV和尿流率等客观检查指标,也体现了本研究的创新性。提示通过对血压心率或尿动力情况进行客观数据监测,有可能会在PD患者出现明显的症状之前,更早地发现PD患者的自主神经功能改变。
既往研究认为,PD患者下尿路症状主要与黑质纹状体多巴胺能系统的神经退行性改变有关[24]。然而近年来,越来越多的研究关注到多巴胺能以外的神经递质在PD发生发展中发挥的作用[25-26],并认为PD患者自主神经症状中心血管系统与泌尿系统可能借助交感神经而存在联系。在泌尿、心血管系统和中枢神经系统之间存在着复杂的交感神经通路,并通过一些共同的核团相互影响 [14,27]。本研究结果显示,PD-NH组PVR更多;24 h舒张压ARV受到PVR的影响。提示在PD患者自主神经症状中,心血管系统与泌尿系统之间存在相关性。因此,临床医生在管理存在自主神经功能障碍的PD患者时,应考虑到不同系统间的相互影响,进行更加全面的评估和干预。
PD的自主神经症状常被认为是伴发症状而受到忽视,然而外周自主神经系统可能是α-突触核蛋白病理从外周向中枢神经系统传播的关键途径,这也符合PD病理进展上的Braak分期[28]和Body-first亚型的假说[29],关注自主神经症状可能有助于疾病的早期诊断和病理进展的评估[30-31]。本研究发现,PD患者的一些排尿指标与MDS-UPDRS Ⅲ评分之间存在相关性,提示泌尿系统症状严重的PD患者,运动症状也更严重。下一步也可对其进行更深入的研究。
本研究存在一定局限性。首先,样本量相对较小,为了避免出现更多的混杂因素,本研究制定了较为严格的排除标准,但也由此降低了研究结果的普遍性。未来可以采用多中心研究或适当放宽纳排标准来扩充样本量,以增强研究结果的外部效度以及在更广泛的PD群体中的适用性。其次,本研究并未对于膀胱内压、逼尿肌过度活跃等储尿指标进行分析,然而,这类指标需要依靠进一步有创的尿动力学检查才能实现,故本研究只使用了无创的自由尿流率检查指标仅对排尿症状进行分析。最后,本研究仅使用NH和ARV作为衡量PD患者心血管自主神经功能的指标,未来可以结合其他指标如心率变异性或心肌代谢显像来提高评价的准确性。
参考文献:
1. HOMAYOUN H. Parkinson Disease[J]. Ann Intern Med, 2018, 169(5): ITC33-ITC48.
2. JANZ C, TIMPKA J, ROSQVIST K, et al. Non-Motor Symptom Management: Insights into Adherence to Treatment Guidelines in Parkinson's Disease Patients[J]. J Parkinsons Dis, 2024, 14(2): 297-312.
3. 胡运新, 孙永奇, 李璇, 等. 帕金森病睡眠障碍与认知障碍关联性研究[J]. 中国神经精神疾病杂志, 2022, 48(1): 14-20.
4. SHARABI Y, VATINE G D, ASHKENAZI A. Parkinson’s disease outside the brain: targeting the autonomic nervous system[J]. Lancet Neurol, 2021, 20(10): 868-876.
5. OU R, HOU Y, WEI Q, et al. Longitudinal evolution of non-motor symptoms in early Parkinson’s disease: a 3-year prospective cohort study[J]. NPJ Parkinsons Dis, 2021, 7(1): 58.
6. CHEN Z, LI G, LIU J. Autonomic dysfunction in Parkinson’s disease: Implications for pathophysiology, diagnosis, and treatment[J]. Neurobiol Dis, 2020, 134: 104700.
7. CUENCA-BERMEJO L, ALMELA P, NAVARRO-ZARAGOZA J, et al. Cardiac Changes in Parkinson’s Disease: Lessons from Clinical and Experimental Evidence[J]. Int J Mol Sci, 2021, 22(24): 13488.
8. 龙晓月, 毛文静, 米唤金, 等. 血压变异性与脑小血管病总负荷评分研究进展[J]. 中国神经精神疾病杂志, 2023, 49(1): 50-54.
9. SARTORI A M, KESSLER T M, CASTRO-DÍAZ D M, et al. Summary of the 2024 Update of the European Association of Urology Guidelines on Neurourology[J]. Eur Urol, 2024, 85(6):543-555.
10. JIA C, CUI X, YOSHIMURA N, et al. Assessment and Management of Urinary Dysfunction in 187 Patients with Parkinson’s Disease[J]. J Parkinsons Dis, 2020, 10(3): 993-1001.
11. CAO W, YANG Z, LIU X, et al. A kidney-brain neural circuit drives progressive kidney damage and heart failure[J]. Signal Transduct Target Ther, 2023, 8(1): 184.
12. INIGUEZ M, JIMENEZ-MARIN A, ERRAMUZPE A, et al. Heart-brain synchronization breakdown in Parkinson’s disease[J]. NPJ Parkinsons Dis, 2022, 8(1): 64.
13. POSTUMA R B, BERG D, STERN M, et al. MDS clinical diagnostic criteria for Parkinson’s disease[J]. Mov Disord, 2015, 30(12): 1591-1601.
14. SLETTEN D M, SUAREZ G A, LOW P A, et al. COMPASS 31: a refined and abbreviated Composite Autonomic Symptom Score[J]. Mayo Clin Proc, 2012, 87(12): 1196-1201.
15. 中国高血压联盟《动态血压监测指南》委员会.2020中国动态血压监测指南[J]. 中国循环杂志, 2021, 36(4): 313-328.
16. 刘靖, 李燕, 张新军. 夜间高血压管理中国专家共识[J]. 中华高血压杂志, 2023, 31(7): 610-618.
17. MENA L, PINTOS S, QUEIPO N V, et al. A reliable index for the prognostic significance of blood pressure variability[J]. J Hypertens, 2005, 23(3): 505-511.
18. ABRAMS P, CARDOZO L, FALL M, et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society[J]. Am J Obstet Gynecol, 2002, 187(1): 116-126.
19. 肖仁清, 宋璐, 赵嘉豪, 等. 帕金森病患者血压昼夜节律紊乱临床特点及对直立性低血压影响的初步分析[J]. 中华神经科杂志, 2023, 56(5): 494-503.
20. HUART J, PERSU A, LENGELÉ J P, et al. Pathophysiology of the Nondipping Blood Pressure Pattern[J]. Hypertension, 2023, 80(4): 719-729.
21. VALLELONGA F, SOBRERO G, MEROLA A, et al. Machine learning applied to ambulatory blood pressure monitoring: a new tool to diagnose autonomic failure?[J]. J Neurol, 2022, 269(7):3833-3840.
22. YU J, SONG Q, BAI J, et al. Visit-to-Visit Blood Pressure Variability and Cardiovascular Outcomes in Patients Receiving Intensive Versus Standard Blood Pressure Control: Insights From the STEP Trial[J]. Hypertension, 2023, 80(7): 1507-1516.
23. LIU X, MENG L, WANG J, et al. A multicenter uroflowmetry study of healthy women in China[J]. Chin Med J (Engl), 2024, 137(10): 1225-1227.
24. OGAWA T, SAKAKIBARA R, KUNO S, et al. Prevalence and treatment of LUTS in patients with Parkinson disease or multiple system atrophy[J]. Nat Rev Urol, 2017, 14(2): 79-89.
25. WIESMAN A I, DA SILVA CASTANHEIRA J, FON E A, et al. Alterations of Cortical Structure and Neurophysiology in Parkinson's Disease Are Aligned with Neurochemical Systems[J]. Ann Neurol, 2024, 95(4): 802-816.
26. LABANDEIRA-GARCIA J L, LABANDEIRA C M, GUERRA M J, et al. The role of the brain renin-angiotensin system in Parkinson´s disease[J]. Transl Neurodegener, 2024, 13(1): 22.
27. PATEL K P, KATSURADA K, ZHENG H. Cardiorenal Syndrome: The Role of Neural Connections Between the Heart and the Kidneys[J]. Circ Res, 2022, 130(10): 1601-1617.
28. BRAAK H, DEL TREDICI K, RÜB U, et al. Staging of brain pathology related to sporadic Parkinson’s disease[J]. Neurobiol Aging, 2003, 24(2): 197-211.
29. BORGHAMMER P, HORSAGER J, ANDERSEN K, et al. Neuropathological evidence of body-first vs. brain-first Lewy body disease[J]. Neurobiol Dis, 2021, 161: 105557.
30. 谢剑玮, 张飘, 李彦, 等. 帕金森病、多系统萎缩和进行性核上性麻痹患者尿流率与运动、认知功能的关联研究[J]. 神经疾病与精神卫生, 2022, 22(9): 647-652.
31. JANSSEN DAALEN J M, VAN DEN BERGH R, PRINS E M, et al. Digital biomarkers for non-motor symptoms in Parkinson’s disease: the state of the art[J]. NPJ Digit Med, 2024, 7(1): 186.
【引用格式】高子淇,杨瑞,黄文琳,等. 帕金森病心血管系统自主神经功能与排尿症状相关性研究[J]. 中国神经精神疾病杂志,2024,50(8):463-469.
【Cite this article】GAO Z Q, YANG R, HUANG W L,et al.Association between cardiovascular autonomic function and voiding symptoms in Parkinson disease[J]. Chin J Nervous Mental Dis,2024,50(8):463-469.
DOI:10.3969/j.issn.1002-0152.2024.08.002
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#帕金森病# #心血管系统自主神经功能#
0