战疫中 - 单抗药和 Remdesivir 组合是救星吗?
2020-02-17 MedSci MedSci原创
截止至2020年2月10日17时,2019-nCoV所致的肺炎死亡率为2.3%左右。可以预见,进一步研究2019-nCoV病毒感染致病机制,进而针对性开发有效药物,最终降低新型冠状病毒肺炎的死亡率,将是今后新冠肺炎防治工作和相关科学研究的重要组成部分。
但问题是:
● 治疗新型冠状病毒肺炎未来药物可能会有哪些?
● 可以直接用恢复期病人体内的抗体开发单抗药吗?
● 哪些靶点可能会成为未来抗2019-nCoV病毒特异性药物靶点?
● 靶向炎症因子(或受体)的单抗药/拮抗剂的免疫调节疗法会有效吗?
本文结合多篇文献及最新研究进展对上述问题进行阐述,阅读时间约5-10分钟,欢迎回复讨论。
——————
导 读
Remdesivir和单抗药组合被认为可能是理想的2019-nCoV肺炎治疗方法,未来研发抗2019-nCoV病毒的特异性治疗药物(如单抗药)和有效减轻肺部病变症状的药物是治疗新冠肺炎一个重要方向。
基于2019-nCoV病毒的基因组与SARS-CoV相似度较高,进入细胞模式可能都利用Spike蛋白和宿主受体ACE2结合,由相同的宿主蛋白酶TMPRSS2、Cathepsin B/L来切割Spike蛋白介导进入宿主细胞,ACE2、TMPRSS2和Cathepsin B/L显示出作为抗2019-nCoV病毒药物靶点的潜在价值。另外,科学家发现新冠肺炎患者血浆Th1细胞反应激活(IL1B、IFNγ、IP10和MCP1上调),Th2炎症因子IL4和IL10也上调,明确新冠肺炎肺病变的病理生理机制对研发/应用减轻肺部病变症状药物非常关键。
——————
治疗新型冠状病毒肺炎未来药物可能会有哪些?
针对2019-nCoV的药物开发,Hongzhou Lu总结出方法主要有三类:1.测试现有的广谱抗病毒药物,如I型、II型干扰素;2. 筛选小分子化学药库;3. 基于基因组和生物物理学信息重新开发特异针对新型冠状病毒的药物,包括siRNA和特异性病毒抑制剂等。潜在的有效药物包括 1 :Lopinavir/Litonavir(抑制和2019-nCoV同样属于RNA病毒的HIV-1,2的蛋白酶),核苷类似物(如Fabiravir和Ribavirin,抑制病毒核苷酸生物合成),神经氨酸酶抑制剂(如Oseltamivir、Zanamivir和peramivir),融合肽(如EK1),Abidol,RNA合成抑制剂(如TDF、3TC),抗炎药(如激素和其他化合物),部分中药制剂以及最近备受关注的Remdesivir(瑞德西韦,在研的广谱抗病毒药,核苷酸类似物,抑制RNA合成酶)。
——————
备受关注和期待的瑞德西韦
瑞德西韦(Remdesivir)是吉利德(Gilead)科学公司开发的一种广谱的抗病毒核苷类似物,在体外实验已显示出抗RNA病毒活性,如Ebola(埃博拉病毒)、Marburg(马尔堡病毒)、RSV(呼吸道合胞体病毒)、NiV(尼帕病毒)、Hendra(亨德拉病毒) 2-4 。
Remdesivir 在稍早2020年1月10日被报道在细胞和小鼠模型中具有抗MERS-CoV(中东呼吸综合症冠状病毒)、改善肺功能、减少病毒载量以及减少肺部病变的功能 5。Manli Wang等报道在Vero E6细胞模型中,Remdesivir显示出了抑制2019-nCoV病毒感染的效果,半数有效浓度EC50为0.77μM,选择指数SI大于129.87 6,然而其安全性和有效性还未被证实,且尚未在任何国家获批上市。鉴于2019-nCoV和MERS-CoV同属冠状病毒 7,8,且结构类似,其抗2019-nCoV潜力巨大。Michelle L. Holshue等报道在对新冠肺炎发病第7天的1例患者同情性地给予在研药Remdesivir 治疗1天后,患者症状明显改善,并最终痊愈 9。2020年2月3日,Remdesivir治疗2019-nCoV的临床试验在北京中日友好医院启动,其临床实验结果预计在几个星期内对外公布。
结合近期Regeneron公司开发抗MERS病毒单克隆抗体的进展,Vanderbilt大学医学中心Mark Denison认为理想的2019-nCoV肺炎治疗方法可能是Remdesivir和抗病毒特异性单抗药物的组合给药。抗病毒特异性单抗药可以设计为阻断病毒特异性感染细胞过程中关键的宿主/病毒蛋白,阻止病毒感染宿主细胞,或是靶向病毒的关键蛋白而使其失活,故可选择开发靶向性更好的单抗药治疗2019-nCoV肺炎。
——————
可以直接用恢复期病人体内的抗体开发单抗药吗?
的确,利用恢复期病人的抗体来开发抗病毒单抗药是一个很有吸引力的设想。人们陆续发现在临床上,用恢复期病人的血浆去治疗SARS-CoV 10、1918和2009 H1N1、H5N1流感病毒 11-13感染的患者产生了良好的效果,尤其在疾病症状初起时应用效果更好 14,目前还没有报道用2019-nCoV所致肺炎患者的血浆去测试抗2019-nCoV病毒效果,值得注意的是,马来源的抗SARS-CoV血清在体外1:80稀释显示出较强的中和2019-nCoV病毒效果 8。
但是恢复期病人血浆较难获得,且中和抗体的滴度较低,会阻碍该方法在临床上的应用 15 。因此,分离病毒感染的病人或接种疫苗的个体浆细胞或记忆B细胞筛选重组生产中和抗体即是一个可替代的方案 15。
那么利用恢复期病人的抗体来开发抗病毒单抗药设想的实现流程可以是:
1. 分离恢复期病人的外周血单个核细胞;
2. 流式分选可以与抗原结合的阳性B细胞,并以一孔一个细胞的密度把B细胞种在微孔板内;
3. 反转录B细胞的RNA为cDNA后,设计针对人源IgG的引物,对其轻重链的高变区进行PCR和测序,构建在抗体表达载体上;
4. 在细胞模型中进行单克隆抗体轻重链配对,筛选配对成功的单克隆抗体;
5. 进一步用单克隆抗体进行病毒中和检测,筛选最佳克隆作为单抗药候选。
此外,利用实验动物,如小鼠、兔子和豚鼠等的抗体做嵌合化的人源抗体技术已日趋成熟,即将抗原免疫动物后分离筛选单克隆B细胞,扩增其表达抗体的CDR序列构建至人源化抗体表达载体上,筛选鉴定后,生产人源化单抗。当然,生产出的候选单克隆抗体药还必须进一步通过大量临床前实验和临床实验的严格验证。
关于生产中和抗体的抗原的选择(或病毒特异性药物靶点),可以是病毒复制所用酶、宿主受体/蛋白酶、介导宿主内吞蛋白、病毒S1 RBD、S2结构域等 1。
——————
哪些靶点可能会成为未来抗2019-nCoV病毒特异性药物靶点?
在考虑选择抗2019-nCoV病毒特异性药物靶点之前,需要我们对2019-nCoV病毒感染宿主的分子机制有充分的认识。
冠状病毒进入细胞的分子机制是一个多步骤的过程:Spike蛋白介导了与宿主细胞表面受体结合,随后宿主蛋白酶切割Spike蛋白,最后膜融合病毒进入宿主细胞 16-18。SARS-CoV病毒经Spike蛋白的RBD结构域和宿主细胞受体ACE2结合而进入宿主细胞,而不是通过宿主细胞受体DPP4和APN来介导(图1)18,19。MERS-CoV病毒通过DPP4受体 17,HCoV-229E病毒通过APN受体 20,HKU5和PDF-2180病毒通过未知的受体进入人体细胞 21。
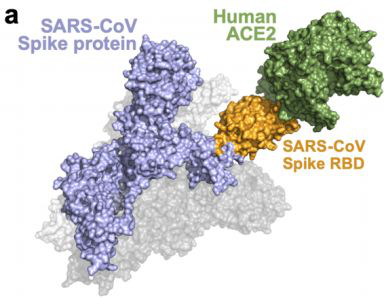
目前已有三项研究(Peng Zhou等、Michael等、Markus Hoffmann等)在细胞水平上证明了2019-nCoV病毒与SARS-CoV病毒一样,通过宿主细胞受体ACE2(血管紧张素转化酶2),而非DPP4或APN受体来进入宿主细胞 8,18,19。而在蛋白酶切割Spike蛋白阶段,对于TMPRSS2- 细胞系(如293T细胞),2019-nCoV-Spike和SARS-CoV-Spike均由Cathepsin B/L来切割Spike蛋白来介导病毒进入宿主细胞。而对于TMPRSS2+ 细胞系(如Caco-2细胞),2019-nCoV-Spike和SARS-CoV-Spike均由TMPRSS2来切割Spike蛋白来介导病毒进入宿主细胞 18,因此,可能与SARS-CoV一致,2019-nCoV病毒利用了宿主蛋白酶Cathepsin B/L或TMPRSS2来切割Spike蛋白介导进入宿主细胞的过程。
前述的研究表明,在体内2019-nCoV病毒和SARS-CoV病毒可能都利用了相同的宿主细胞表面受体和蛋白酶来介导进入宿主细胞的过程,提示着ACE2和TMPRSS2作为抗2019-nCoV病毒药物靶点的潜在价值。
——————
靶向炎症因子(或受体)的单抗药/拮抗剂的免疫调节疗法会有效吗?
2019-nCoV病毒所致肺炎以单/双侧肺斑片状或节段性磨玻璃密度影的CT表现为显著特征之一,说明患者肺部产生病变 22。研究2019-nCoV病毒所致肺炎病理生理机制,并据此开发药物减轻患者肺部病变症状和阻断病变进展也是治疗新冠肺炎重要的一部分。
人们发现SARS患者血清中上调的炎症因子(IL1B、IL6、IL12、IFNγ、IP10和MCP1)与肺部炎症和损伤存在密切的关联 23。而MERS患者表现出了Th1和Th17反应,即IFNγ、TNFα、IL15和IL17的上调 24。上述发现不难让人想到炎症因子的上调也和2019-nCoV所致肺炎严重程度相关 22。Chaolin Huang等率先报道了2019-nCoV所致肺炎患者的血浆中的炎症因子表达情况,作者发现不仅Th1细胞反应激活(IL1B、IFNγ、IP10和MCP1上调),Th2炎症因子IL4和IL10也上调,除此以外,ICU患者血浆中的IL2、IL7、IL10、GCSF、IP10、MCP1、MIP1A和TNFα要比非ICU患者的要高,暗示这些炎症因子的表达水平和疾病严重程度可能相关 22。
下表中的炎症、趋化因子和生长因子在2019-nCoV病毒感染后上调。

如需求购,请扫描以下二维码

糖皮质激素通过和细胞的皮质激素受体结合调控抗炎基因转录起到抑炎的效果 34,其在治疗SARS和MERS广泛使用,以及正在用于治疗新冠肺炎 35。但是WHO专家Clark D Russell等基于皮质激素在抑制免疫反应的同时会延长SARS-CoV和MERS-CoV病毒RNA清除时间以及引发继发损害和并发症等事实,认为应该避免使用皮质激素作为治疗2019-nCoV引起的肺损伤或休克的治疗方法 35。
因此,利用单抗药或拮抗剂进行抗炎症因子(或受体)的疗法可能是减轻细胞因子风暴引起的肺损伤、多器官失能和ARDS的可考虑的另一种思路:即随着未来人们对新冠肺炎细胞因子风暴的产生机制了解更为清晰,针对关键的炎症因子(或受体)应用单抗/拮抗剂阻断炎症信号。 但在治疗新冠肺炎中抑制细胞因子风暴的产生能否降低致死率,提高疾病预后,还需要更多研究工作去阐明。
——————
新型冠状病毒肺炎研究工具
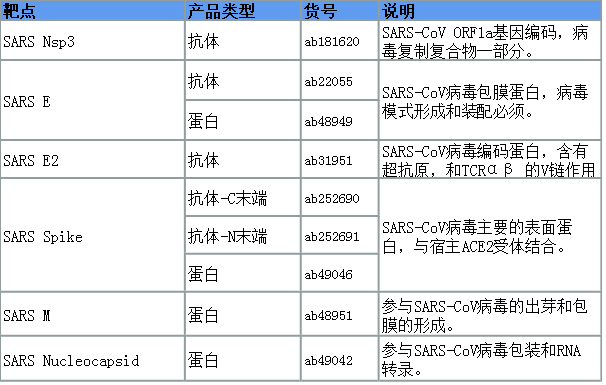
为了加快新型冠状病毒相关研究和药物研发,Abcam提供2019-nCoV病毒识别的宿主受体和蛋白酶的抗体,炎症因子/趋化因子的ELISA试剂盒,IgG/IgM二抗等产品。2019-nCoV 和SARS-CoV病毒基因序列存在约79%的同源性,因而SARS-CoV的重组蛋白、抗体仍然值得尝试。以下是精选产品:

冠状病毒蛋白
抗人源IgG、IgM二抗和偶联试剂盒(可用于抗原特异性B细胞流式分选)

Texas Red® is registered trademarks of Life Technologies. DyLight® is a trademark of Thermo Fisher Scientific Inc. and its subsidiaries. Cy®and CyDye® are trademarks of GE Healthcare Limited.
如需求购,请扫描以下二维码

——————
参考文献:
1 Lu, H. Drug treatment options for the 2019-new coronavirus (2019-nCoV). Bioscience trends, doi:10.5582/bst.2020.01020 (2020).
2 Lo, M. K. et al. GS-5734 and its parent nucleoside analog inhibit Filo-, Pneumo-, and Paramyxoviruses. Scientific reports 7, 43395, doi:10.1038/srep43395 (2017).
3 Sheahan, T. P. et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Science translational medicine 9, doi:10.1126/scitranslmed.aal3653 (2017).
4 Warren, T. K. et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature 531, 381-385, doi:10.1038/nature17180 (2016).
5 Sheahan, T. P. et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nature communications 11, 222, doi:10.1038/s41467-019-13940-6 (2020).
6 Wang, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Research, doi:10.1038/s41422-020-0282-0 (2020).
7 Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. The New England journal of medicine, doi:10.1056/NEJMoa2001017 (2020).
8 Zhou, P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, doi:10.1038/s41586-020-2012-7 (2020).
9 Holshue, M. L. et al. First Case of 2019 Novel Coronavirus in the United States. The New England journal of medicine, doi:10.1056/NEJMoa2001191 (2020).
10 Cheng, Y. et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology 24, 44-46, doi:10.1007/s10096-004-1271-9 (2005).
11 Luke, T. C., Kilbane, E. M., Jackson, J. L. & Hoffman, S. L. Meta-analysis: convalescent blood products for Spanish influenza pneumonia: a future H5N1 treatment? Annals of internal medicine 145, 599-609, doi:10.7326/0003-4819-145-8-200610170-00139 (2006).
12 Hung, I. F. et al. Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 52, 447-456, doi:10.1093/cid/ciq106 (2011).
13 Zhou, B., Zhong, N. & Guan, Y. Treatment with convalescent plasma for influenza A (H5N1) infection. The New England journal of medicine 357, 1450-1451, doi:10.1056/NEJMc070359 (2007).
14 Mair-Jenkins, J. et al. The effectiveness of convalescent plasma and hyperimmune immunoglobulin for the treatment of severe acute respiratory infections of viral etiology: a systematic review and exploratory meta-analysis. The Journal of infectious diseases 211, 80-90, doi:10.1093/infdis/jiu396 (2015).
15 Corti, D. et al. Tackling influenza with broadly neutralizing antibodies. Current opinion in virology 24, 60-69, doi:10.1016/j.coviro.2017.03.002 (2017).
16 Li, W. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 426, 450-454, doi:10.1038/nature02145 (2003).
17 Raj, V. S. et al. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC. Nature 495, 251-254, doi:10.1038/nature12005 (2013).
18 Hoffmann, M. et al. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells. bioRxiv, 2020.2001.2031.929042, doi:10.1101/2020.01.31.929042 (2020).
19 Letko, M. & Munster, V. Functional assessment of cell entry and receptor usage for lineage B β-coronaviruses, including 2019-nCoV. bioRxiv, 2020.2001.2022.915660, doi:10.1101/2020.01.22.915660 (2020).
20 Yeager, C. L. et al. Human aminopeptidase N is a receptor for human coronavirus 229E. Nature 357, 420-422, doi:10.1038/357420a0 (1992).
21 Menachery, V. D. et al. Trypsin treatment unlocks barrier for zoonotic bat coronaviruses infection. Journal of virology, doi:10.1128/JVI.01774-19 (2019).
22 Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, doi:10.1016/S0140-6736(20)30183-5 (2020).
23 Wong, C. K. et al. Plasma inflammatory cytokines and chemokines in severe acute respiratory syndrome. Clinical and experimental immunology 136, 95-103, doi:10.1111/j.1365-2249.2004.02415.x (2004).
24 Mahallawi, W. H., Khabour, O. F., Zhang, Q., Makhdoum, H. M. & Suliman, B. A. MERS-CoV infection in humans is associated with a pro-inflammatory Th1 and Th17 cytokine profile. Cytokine 104, 8-13, doi:10.1016/j.cyto.2018.01.025 (2018).
25 Li, Y. et al. Coronavirus Infections in the Central Nervous System and Respiratory Tract Show Distinct Features in Hospitalized Children. Intervirology 59, 163-169, doi:10.1159/000453066 (2016).
26 Yu, S.-Y. et al. Gene expression profiles in peripheral blood mononuclear cells of SARS patients. World J Gastroenterol 11, 5037-5043, doi:10.3748/wjg.v11.i32.5037 (2005).
27 Zuo, J., Stohlman, S. A., Parra, G. I. & Bergmann, C. C. IL-15 independent maintenance of virus-specific CD8(+) T cells in the CNS during chronic infection. Journal of neuroimmunology 207, 32-38, doi:10.1016/j.jneuroim.2008.11.005 (2009).
28 Ding, L. et al. CD69+NK cells contribute to the murine hepatitis virus strain 3-induced murine hepatitis. Journal of Huazhong University of Science and Technology. Medical sciences = Hua zhong ke ji da xue xue bao. Yi xue Ying De wen ban = Huazhong keji daxue xuebao. Yixue Yingdewen ban 33, 505-510, doi:10.1007/s11596-013-1150-7 (2013).
29 Yeung, M. L. et al. MERS coronavirus induces apoptosis in kidney and lung by upregulating Smad7 and FGF2. 1, 16004, doi:10.1038/nmicrobiol.2016.4 (2016).
30 Barnard, D. L. et al. Enhancement of the infectivity of SARS-CoV in BALB/c mice by IMP dehydrogenase inhibitors, including ribavirin. Antiviral Res 71, 53-63, doi:10.1016/j.antiviral.2006.03.001 (2006).
31 Funk, C. J. et al. Infection of human alveolar macrophages by human coronavirus strain 229E. The Journal of general virology 93, 494-503, doi:10.1099/vir.0.038414-0 (2012).
32 Liu, M. et al. Differences in inflammatory marker patterns for adult community-acquired pneumonia patients induced by different pathogens. The clinical respiratory journal 12, 974-985, doi:10.1111/crj.12614 (2018).
33 Vinores, S. A. et al. Blood-retinal barrier breakdown in experimental coronavirus retinopathy: association with viral antigen, inflammation, and VEGF in sensitive and resistant strains. Journal of neuroimmunology 119, 175-182, doi:10.1016/s0165-5728(01)00374-5 (2001).
34 Darwish, I., Mubareka, S. & Liles, W. C. Immunomodulatory therapy for severe influenza. Expert review of anti-infective therapy 9, 807-822, doi:10.1586/eri.11.56 (2011).
35 Russell, C. D., Millar, J. E. & Baillie, J. K. Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury. The Lancet, doi:https://doi.org/10.1016/S0140-6736(20)30317-2 (2020).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












已阅,受益匪浅。
54
#单抗药#
51
#REM#
33
不是组合,而是分为不同阶段的使用。
95
#DES#
33
#DES#
42
#ESI#
27
IL-10是抑制因子,减少细胞因子风暴产生的可能性
105