Mol Ther:重编程胰腺导管细胞,成功治疗糖尿病小鼠
2018-05-04 M记 生物探索
在糖尿病的发生发展中,胰岛β细胞功能的进行性丧失最终会导致高血糖的恶化和各种并发症的发生。现在,科学家们找到一种治疗1型糖尿病的策略——通过重编程小鼠体内的胰腺导管细胞,成功治疗遗传和化学诱发的糖尿病。
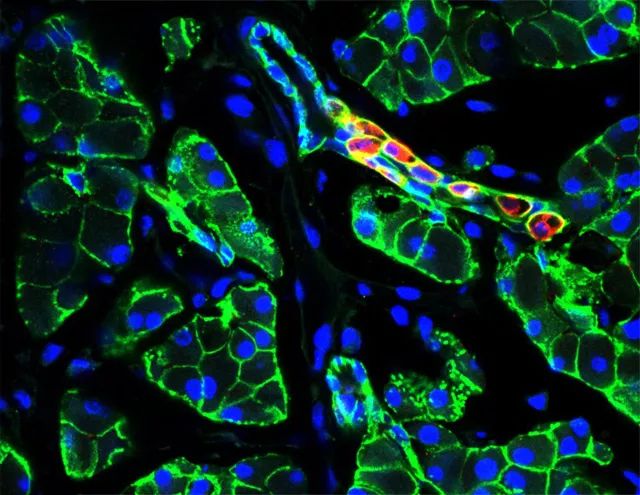
Injection of an adenoviral vector encoding pancreatic transcription factors induced insulin expression (red) in mouse pancreatic ducts. Ductal tissue is shown in green and nuclei in blue.YUHAN WANG
这项研究以 “Long-Term Correction of Diabetes in Mice by In Vivo Reprogramming of Pancreatic Ducts”为题发表在5月2日的《Molecular Therapy》杂志上。DOI: https://doi.org/10.1016/j.ymthe.2018.02.014
休斯顿贝勒医学院的儿科内分泌学家Jake Kushner说,“这是一个令人兴奋的进步,因为它加深了我们对胰脏或肝脏各种不同组分是否能转导和制造产生胰岛素的理解。”Jake Kushner没有参与这项研究。
此前研究表明,肝脏和胰腺细胞都可以转化为产生胰岛素的细胞。因此,当时在俄勒冈健康与科学大学Markus Grompe实验室的研究生Yuhan Wang及其同事开始着手研究哪些细胞类型能够制造出最好的β样细胞。

Injection of an adenoviral vector encoding pancreatic transcription factors induced insulin expression (red) in mouse pancreatic ducts. Lineage traced pancreatic ducts were identified by GFP (green). Insulin-positive pancreatic ducts were characterized by their loss of pancreatic ductal transcription factor expression, Sox9 (magenta).YUHAN WANG
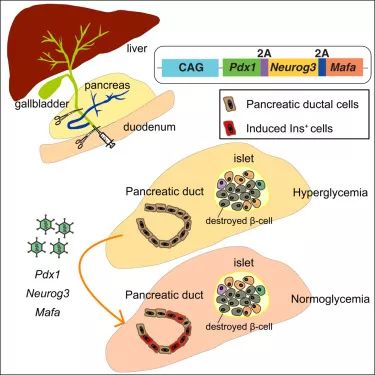
在最新的研究中,研究人员给糖尿病小鼠注射了一种携带有Pdx1、Neurog3基因和和Mafa转录因子基因(这些基因已被证明可以将细胞重编程为β样状态)的病毒。结果发现,注射病毒之后的肝细胞(hepatocytes)开始产生胰岛素,并能降低小鼠的高血糖水平。但是,这些细胞并不能及时关闭胰岛素的产生,从而对低血糖做出适当的响应。而且,肝细胞也不表达特征性β样基因,这表明它们没有真正地被重编程。
峰回路转的是,除了肝脏,胰腺导管系统同样也可以被诱导产生胰岛素。更关键的是,与胰岛素阳性的肝管细胞(liver duct cells)相比,胰脏内胰岛素阳性的胰管细胞(duct cells)更容易产生特征性β样基因。
转化前胰腺的胰岛素阳性导管细胞也关闭了与细胞特性相关的基因,而胰岛素阳性的肝管细胞则没有。
随后,在为期8周的实验中, 30%到40%的糖尿病小鼠通过病毒注射消除了糖尿病症状(即高血糖)。其余的实验小鼠仅表现出短暂的改善,或者根本不响应注射。
“现在越来越多的证据表明,胰腺导管内至少有一些特定的细胞亚群可以被诱导再生出β细胞,这可能具有重要的治疗意义,”在迈阿密大学米勒医学院(University of Miami Miller School of Medicine)研究胰腺发育的Juan Dominguez-Bendala说道,“然而,使用病毒来诱导这种转化是一种基因疗法,其临床审批路径非常困难。” Juan Dominguez-Bendala本人并没有参与这项研究。
同样没有参与这项研究的哈佛大学糖尿病研究员Susan Bonner-Weir也指出,这种类型的人体注射可能会导致胰腺发炎,即便制造出新的β样细胞,它们也可能将会被1型糖尿病患者的免疫系统所破坏。
“我们担心的是,如果能找到源源不断的β样细胞,却找不到一种永久安全地重新培养免疫系统的方法,这将为自身免疫带来灾难,” Kushner说道。
现在是HHMI Janelia Research Campus博士后的Wang承认了这些担忧,并表示研究小组计划探索替换的转录因子,并评估其安全性以及研究自身免疫在该方法中发挥的作用。
“我们有一些可靠的数据表明,这些细胞可以在体内重新编程,并可以在这些动物模型中逆转糖尿病,”Wang说,“我们希望,未来的工作能为我们提供更多的信息来确定这是否能成为临床治疗的有效途径。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#胰腺导管细胞#
63