Nature Genetics:迄今全面乳腺癌单细胞空间图谱
2021-09-22 “E药世界”公众号 “E药世界”公众号
2021年9月6日,澳大利亚Garvan医学研究所的研究团队在 Nature 子刊 Nature Genetics 上发表了题为:A single-cell and spatially resolve
乳腺癌的肿瘤异质性极大,这些功能不同的细胞在确定病因和治疗方案方面非常重要。有研究发现肿瘤浸润淋巴细胞(TIL)是对新辅助化疗反应良好的生物标志物,而肿瘤相关巨噬细胞(TAM)则与不良预后相关,是癌症免疫治疗的新靶点。另外,间充质细胞也已成为耐药性、驱动转移和抗肿瘤免疫的重要调节因子。然而,目前尚不清楚这些细胞的明确亚类。
单细胞RNA测序(scRNA-seq)全面系统地描绘肿瘤的细胞图谱,揭示细胞生物学、疾病病原学和药物反应。已有研究将scRNA-seq应用于人类乳腺癌,以揭示TILs内的连续分化状态、三阴性乳腺癌(TNBC)中组织驻留淋巴细胞的作用以及TNBC中肿瘤细胞的化疗耐药性。现在亟需更详细的高分辨率乳腺癌细胞图谱来进一步确定乳腺癌的分类、识别细胞异质性及其互作,以及确定细胞分化事件。
2021年9月6日,澳大利亚Garvan医学研究所的研究团队在 Nature 子刊 Nature Genetics 上发表了题为:A single-cell and spatially resolved atlas of human breast cancers 的研究论文。
该研究开发了一种固有亚型分类(SCSubtype)的单细胞方法用来揭示复发性肿瘤细胞异质性,提供了迄今为止最全面的乳腺癌细胞图谱。
该研究发现了新的与临床结果相关的PD-L1/PD-L2+巨噬细胞群,间充质细胞分为明显不同的三个亚群。空间转录组揭示了基质细胞与免疫细胞的互作,提供了对抗肿瘤免疫调节的独特见解。利用单细胞特征对大型乳腺癌队列进行的反卷积将期分为九种“生态型”,这些“生态型”具有独特的细胞组成和临床结果。
首先,为了阐明乳腺癌的细胞结构,研究团队通过scRNA-seq分析了包含3种常见临床亚型(雌激素受体阳性,ER+;人表皮生长因子受体2阳性,HER2+;三阴性乳腺癌,TNBC)的26例原发肿瘤,并从中鉴定出了一类恶性上皮细胞。
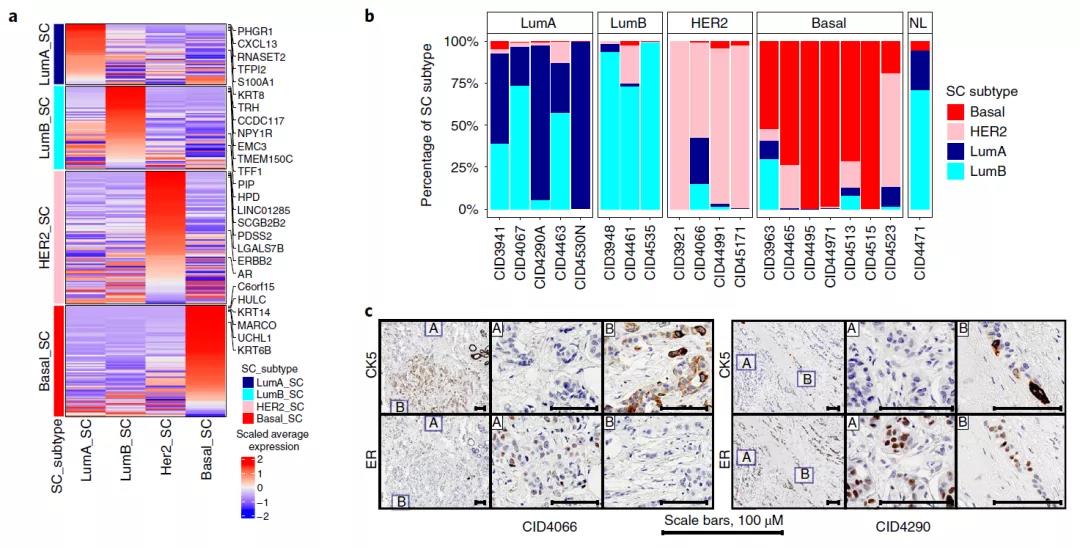
根据使用 PAM50 基因特征的大量转录组分析,乳腺癌分为五种内在分子亚型。然而,乳腺癌分子亚型在单个细胞水平上的功能仍不清楚。于是研究团队开发了一种与 scRNA-seq 兼容的方法进行内在分子亚型分型—SCSubtype。
结果显示,SCSubtype能够揭示细胞异质性,正确识别恶性细胞,特异性比批量和scRNA-seq更高。接下来,研究团队研究了驱动肿瘤内转录异质性(ITTH)的生物学途径,生成了 574 个 ITTH 基因特征。这些基因特征确定了具有不同的功能特征的七个基因模块(GMs)。GMs也揭示出了肿瘤细胞异质性。总的来说,SCSubtype 和 GMs 分析为 ITTH 分类提供了互补的新方法,并进一步证明了肿瘤细胞的极大异质性。

为了能高分辨率检查乳腺肿瘤的微环境,研究团队对免疫细胞和基质细胞进行了重新分类,在患者中鉴定了18个T细胞、先天性淋巴细胞簇和13个髓样细胞簇,以及5种癌症成纤维细胞簇,3种内皮细胞簇和3种壁细胞簇。免疫细胞簇在不同的临床亚型之间存在质的不同,表明需要根据不同的临床亚型制定最适合的靶向策略。他们还在不同的乳腺癌亚型和正常乳腺组织样本中发现了类似的基质细胞簇,表明基质细胞簇可能是肿瘤内环境中经历重塑的常驻细胞类型。
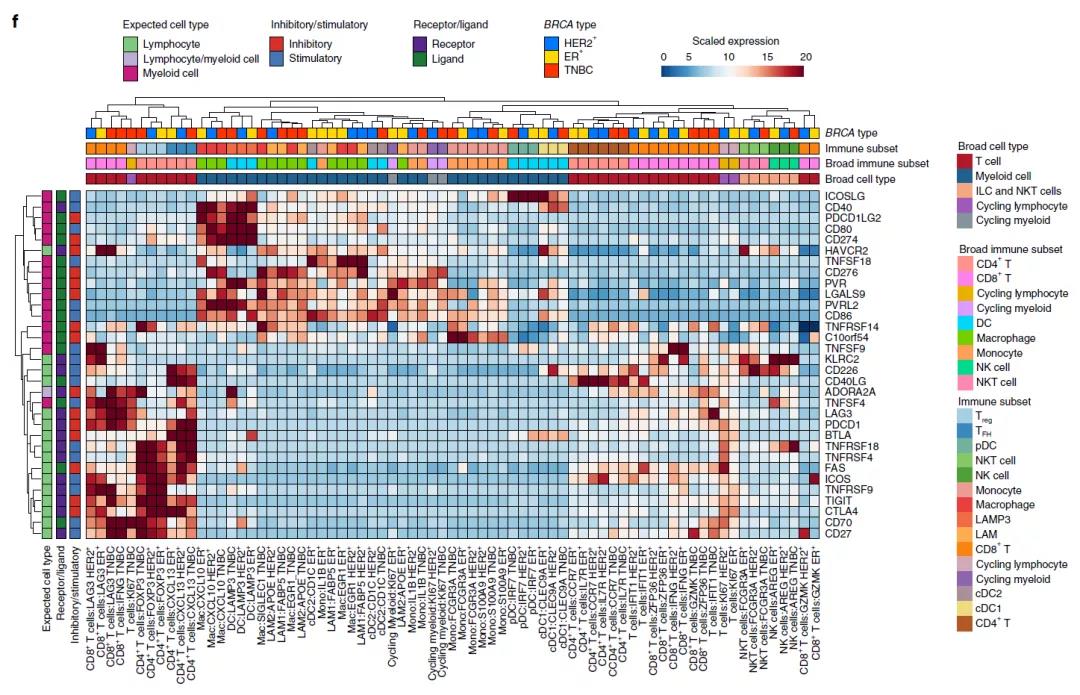
空间转录组分析表明:不同临床亚型的相关细胞簇在空间排列上是互斥的。最后,基于单细胞结果和大型乳腺癌队列,研究团队进行了聚类分析。结果显示,九种肿瘤簇具有相似的细胞组成,也就是“生态型”。这些生态型显示与肿瘤亚型、SCSubtype细胞分布和主要细胞类型多样性相关,生态型之间的预后也存在明显差异。
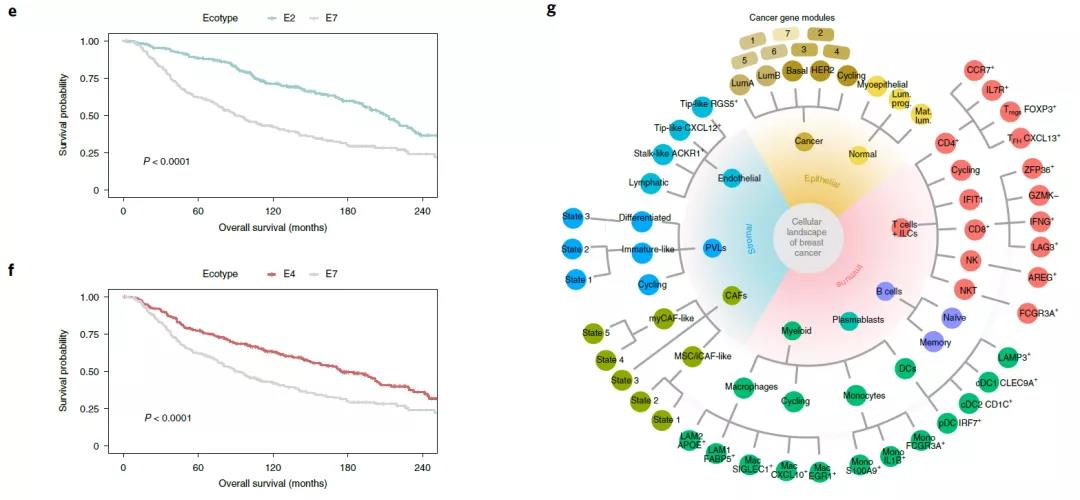
总的来说,这项工作在三个层面定义了乳腺癌的细胞图谱——单细胞RNA测序、空间转录组和免疫表型,揭示了乳腺癌全新的免疫表型,为乳腺癌分类的综合细胞模型提供了重要基础。
原始出处:
Wu, S.Z., Al-Eryani, G., Roden, D.L. et al. A single-cell and spatially resolved atlas of human breast cancers. Nat Genet 53, 1334–1347 (2021). https://doi.org/10.1038/s41588-021-00911-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#Gene#
103
#Genetics#
109
#Nat#
79
#Genet#
79
#NET#
77