【综述】可操纵导管在神经介入治疗中的研究进展
2024-08-11 中国脑血管病杂志 中国脑血管病杂志 发表于上海
本文对可操纵导管的分类及其在神经介入领域应用进行综述,以期增加神经介入医师对可操纵导管的认识。
摘要:近年来,血管内介入治疗因其创伤小、恢复快的优势,已经成为治疗脑血管疾病的一种重要手段。导管作为介入治疗重要的手术器械,常常需要通过精确控制头端,以通过血管迂曲的位置。传统导管存在着头端形状固定、近端力矩传导受限、操控困难等缺点,这增加了患者介入手术的并发症发生风险,且延长了手术暴露时间。随着材料学和工程学的飞速发展,可操纵导管开始应用于临床介入治疗,使精准“控弯”成为可能。该文系统性阐述了可操纵导管的分类,着重介绍其在神经介入治疗领域的运用,并对可操纵导管的未来发展进行展望。
随着影像学技术和医疗器械的快速发展,“微创”的理念逐渐兴起,介入治疗为在影像引导下通过自然孔道或皮肤小切口进行病变诊疗。导管是介入手术的必备器械,其柔软且具有弹性,能够通过导管注射对比剂实现对动脉瘤、血管狭窄等疾病的诊断,并通过输送球囊、支架等材料进行治疗。神经介入治疗作为神经科学和介入医学的交叉领域,在治疗脑血管疾病如动脉瘤、脑血栓等方面具有创伤小、恢复快等优点,其复杂性要求导管具备高灵活性和稳定性,以便在狭窄和复杂的血管中操作,减少对血管壁的损伤,提高手术成功率和安全性。可操纵导管具有较高的灵活性和精确性,有助于提高介入治疗的成功率和安全性,通过精确定位和操控,可有效到达目标部位,减少对周围组织的损伤。本文对可操纵导管的分类及其在神经介入领域应用进行综述,以期增加神经介入医师对可操纵导管的认识。
1 可操纵导管的分类
最早应用于神经介入临床领域的可操纵导管是美国Cordis公司推出的可操纵血管造影导管,这种导管在20世纪60年代首次问世,是可操纵导管在神经介入领域应用的开端。在过去的10年里,可操纵导管技术取得了巨大进步。目前已上市的可操纵导管产品中,无源产品(依靠外部能量源而工作的器械)包括美国Edwads公司的可调弯瓣膜输送系统、雅培公司的MitraClip二尖瓣夹合器输送系统、麦瑞通公司的Swift NINJA可调控微导管、Bendit公司的Bendit可调弯微导管、Agile Devices公司的Angler可调弯微导管及日本泰尔茂公司的Nagare可调弯导管鞘等;有源产品(具备内部能量源的器械)或者结合机器人的产品包括美国强生公司的NUVISION NAV超声导管、波士顿科学公司的Polaris X诊断导管、Stereotaxis公司的Niobe磁导航系统及英国汉森医疗公司的Artisan Extend控制导管等。
可操纵导管有多种分类方式。根据驱动原理进行分类,可分为拉线驱动可操纵导管、磁导航可操纵导管、软材料驱动可操纵导管;根据驱动的维度,可分为单节可操纵导管和多节可操纵导管;此外,还可根据应用场景分为血管介入导管和自然腔道介入导管;根据使用功能分为造影导管、通路导管、输液导管、输送导管、抽吸导管、引流导管等。本文根据驱动原理对可操纵导管进行分类介绍。
1.1 拉线驱动可操纵导管
拉线驱动可操纵导管的驱动原理为在导管中内置类似于拉线的驱动线,通过调节驱动线的张力控制导管头端的运动和形状;拉线驱动可操纵导管通常由1个柔性骨干来支撑驱动线;骨干可由各种材料如弹簧、弹性管和编织聚合物等组成,驱动线通常由耐用且柔韧的材料(如高分子聚合物或金属合金)制成。术者通过控制手柄或远程控制系统调节驱动线的张力,增加某根驱动线的张力会使导管头端向该驱动线方向弯曲。多根驱动线的协同工作可以实现导管头端的多角度运动,包括上下、左右、旋转等复杂的空间动作。部分有源的拉线驱动导管内置了传感器系统,可以实时监测导管的形状和位置,提供反馈信息给操作者,确保操作的精确性和安全性,如美国波士顿科学公司的Polaris XTM导管和Steero Cath DxTM导管均属于拉线驱动可操纵导管。
拉线驱动的导管结构简单,易于远程操作,但由于其内部包含腱线及驱动机制的复杂结构与多功能设计所需的额外空间,这类导管的尺寸较其他导管稍大,工艺上难以做到很小尺寸(4~6F);此外,拉线与引导通道之间的摩擦可能会使导管精确定位难度增加的同时操控灵敏度降低,这些问题均会使导管在精细操作中难以达到预期效果,增加手术或操作的复杂性和风险,升级迭代腱线材料和优化导管结构有助于拉线驱动可操纵导管的逐步改进。
1.2 磁导航可操纵导管系统
磁导航系统由2部分系统构成:(1)外部磁场:由1个或多个电磁线圈产生,术者通过精准操纵电磁线圈中的电流强度可以在三维空间内调整磁场的方向和强度;(2)磁性头端:导管头端有一磁性元器件,通过改变外部磁场的方向和强度,可以实现对磁性头端的精确控制,从而改变导管的形状并引导导管沿特定路径运动。美国食品和药品监督管理局分别于2003年和2009年批准了2种远程磁导航可操纵导管系统:Senseis X(Hansen Medical Inc.,Mountain View,CA,美国)和Niobes(Stereotaxis,St-Louis,MO,美国)磁导航系统。
除了通过永磁体产生磁场外,电磁铁也可以产生磁场,Nguyen等设计了一个与Niobes磁导航系统类似的Telstar系统,其磁场由3个正交的电磁铁产生。磁导航的另一种方法是引入MR系统,借助MR系统控制磁场,Gosselin等设计了一种带有磁性头端的导管系统,此导管系统将MR设备的电流源系统与计算机连接,通过编写控制软件控制MR线圈的电流来改变磁场强度和梯度,实现对导管头端的远程控制以及可视化。
磁导航可操纵导管系统可利用外部磁场来驱动和控制导管的运动以完成介入手术,我们认为其优势如下:(1)磁导航可操纵导管系统可以实现对导管的高精度控制,适用于需要精细操作的复杂介入手术;(2)磁导航可操纵导管系统采用非接触控制,可减少导管与血管的摩擦和磨损,有助于降低术中感染的风险;(3)磁导航可操纵导管系统可精确控制导管的运动路径,减少误操作的风险,降低对患者组织的伤害。基于上述优势,磁导航可操纵导管系统在提高手术质量、减少手术风险和提升治疗效果方面展现出较大的潜力。同时我们认为磁导航可操纵导管系统存在一些弊端,首先,磁导航可操纵导管系统设备占地面积较大、结构较为复杂且通常需要高额的安装与维护成本,以上问题限制了其在医疗机构中的普及;其次,由于磁场信号干扰传感器信号传输,手术过程中导管阻力无法实时反馈,同时磁场控制仍存在分布不均匀、易受干扰的弊端,可能会增加血管损伤的发生。
1.3 软材料驱动可操纵导管
软材料驱动可操纵导管由智能柔性材料制成,包括形状记忆合金(shape memory alloy,SMA)、液压波纹管和导电聚合物,该类导管可以通过自身结构而非通过其他外部作用(即拉线和磁场)实现“可调弯”的目的,智能柔性材料对于软材料驱动可操纵导管的性能和应用效果至关重要。以下重点介绍SMA的特性。
SMA是一种在特定温度范围内柔性态和弹性态能够相互转化的材料。SMA在加热或冷却时可形变产生力,导致导管弯曲和收缩,实现调弯功能。SMA的关键特性在于其相变温度,即马氏体相变温度和奥氏体相变温度,其相变温度范围取决于合金的具体成分和加工工艺。以常见的镍钛合金为例,其马氏体相变温度和奥氏体相变温度通常在室温至100摄氏度之间。镍钛SMA因其良好的生物相容性和优异的形状记忆效应,在医疗领域中广泛应用,其低毒性、优异的耐腐蚀性及表面涂层使其在体内安全稳定,而形状记忆效应和超弹性则可确保其在复杂手术中能自动恢复预设形状并适应体内温度变化,如在颈动脉支架领域,美国Cordis公司的Prescise颈动脉支架、Abbott公司的Acculink支架和Xact支架;在颅内支架领域,美国波士顿科学公司的Wingspan支架等。SMA具有良好的超塑性、生物相容性、抗扭结性、扭控性,并且由于SMA可以被做成直径非常小的导管(可小于1mm),因此SMA成为目前制造导丝或导管的理想材料。SMA有以下缺点:(1)可加工性较低,其独特的材料特性和相变行为使得传统的加工方法难以应用;其在加工过程中需要精确控制温度和应力,以确保材料的形状记忆效应和超弹性特性不受损,因此其制造难度和成本较高;(2)导管通常需要若干个连接的SMA部件,需要多根引线来控制,使得系统更加复杂;(3)与拉线驱动导管和磁导航驱动导管相比,SMA导管产生的头端力相对较低;(4)由于SMA导管为借助材料自身的温度变化完成导管形态的变换,因此进行腔内操作时,若温度超过42摄氏度可能发生高温造成细胞或组织损伤的情况;(5)SMA具有高迟滞特性,高迟滞特性是指在SMA材料的加载和卸载过程中,应力和应变之间存在显著的滞后效应,导致其与传统导管相比难以进行实时控制。
目前,传统导管的主要缺点如下:(1)操控性不足:导管与血管之间的接触摩擦会阻碍近端力矩的传导,进而可能出现远端导管头端的失控和偏离;(2)通用性差:传统导管头端形状固定,而且在一些介入手术中,操作者需多次从患者体内拔出或插入导管,并选取不同头端形状的导管到达不同的位置,这种反复的交换操作使得血管损伤和术后感染的风险增加;(3)学习曲线高:传统导管进入血管分叉或迂曲处需要术者拥有较为丰富的经验,学习曲线及手术时间更长。
可操纵导管应尽量满足以下要求:(1)导管的直径应与导管的工作环境匹配,如各部位血管、胃肠道、气道或人工通路(如内镜通路)等;(2)导管应具有良好的操控性和柔韧性,以便到达复杂的目标部位;(3)导管应具有适当的刚度以抵抗来自通道管壁的阻力(高刚度可能引起组织损伤,而低刚度可能因导管头端稳定性不足而导致操作失败);(4)导管材料应具有生物相容性和可灭菌性以预防术后感染与术后再狭窄;(5)导管应便于使用与操作。
可操纵导管相较传统导管有诸多优势,但任何手术器械均需要关注其安全性问题。拉线驱动导管和SMA导管相对较硬,因此有发生血管穿孔的潜在风险。磁导航可操纵导管和导电聚合物微导管尺寸较小并且较为柔顺,穿孔危险性较小。SMA导管由于采用电力驱动,可能会出现过热现象,导致医源性血管热损伤。另外应用磁导航可操纵导管系统需要严格遵守操作规程,避免发生因永磁体运动误伤患者或医师的突发事件。
2 可操纵导管在神经介入领域的应用
在神经介入领域,可操纵导管可用于动脉瘤、动静脉瘘、动静脉畸形、颅内外血管狭窄和急性缺血性卒中取栓等疾病的诊断与治疗。
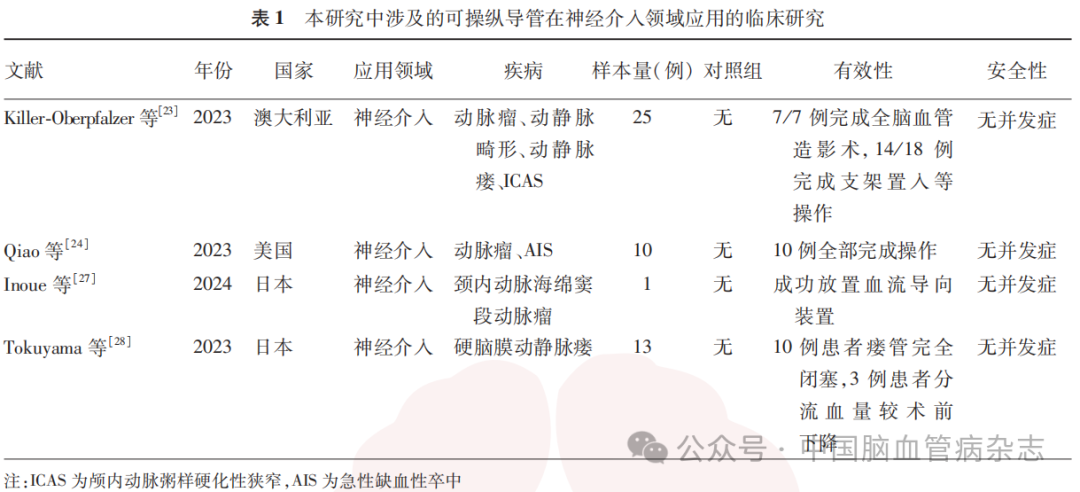
2023年Killer - Oberpfalzer等报道了一项研究,评估了Bendit21(Bendit技术公司,以色列)磁导航可操纵导管在神经介入治疗中的临床应用效果,该研究纳入了25例患者,包括颅内动脉瘤(15例,60%)、动静脉瘘(2例,8%)、颅内血管狭窄(4例,16%)和其他(4例,16%),研究结果表明,25例患者均未发生与Bendit21相关的安全事件(指手术过程中出现与设备相关的血管穿孔、血管痉挛、血栓形成和神经损伤等)或死亡,并且大多数患者成功完成了诊疗操作(7/7例完成全脑血管造影术,14/18例完成支架置入等操作)。这初步表明,在处理不同颅内血管病变时,Bendit21具有一定的有效性和安全性。Qiao等于2023年对单中心神经介入数据库进行了回顾性分析,纳入了10例使用Bendit21导管行神经介入操作的患者,包括动脉瘤栓塞术(3例)、脑膜中动脉栓塞术(1例)、急性大血管闭塞机械取栓术(4例)、血管成形术和支架置入术(1例)和其他手术(1例),结果显示,10例患者均完成治疗操作,且无操作相关并发症(指手术过程中出现与设备相关的血管穿孔、血管痉挛、血栓形成和神经损伤等)出现,证实了该可操作导管在神经介入操作的安全性及有效性。但上述临床研究纳入的患者例数均较少,该可操纵导管在神经介入操作中的安全性和有效性仍需在更大样本量的研究中进一步验证。可操纵导管具有较好的近端力矩传递性能和术中可实时调弯的特点,使其在分叉或迂曲血管的介入操作过程中更容易通过,如迂曲的椎动脉起始部、颈内动脉床突段远端和眼动脉段。尤其是在急性缺血性卒中取栓时,面对困难的血管条件,利用可操纵导管的优势能使抽吸导管和取栓支架快速到位,缩短脑组织缺血时间,有利于患者获得更好的预后。
2024年Inoue等报道了1例使用新型可操纵导管治疗右侧颈内动脉海绵窦段巨大动脉瘤(27mm×26mm)的患者,该例患者为73岁女性,载瘤动脉近端与远端和瘤体紧紧贴在一起,使用传统的0017英寸(1英寸=2.54cm)微导管和0.014英寸导引导丝虽然能超选至载瘤动脉远端出口,但始终无法走远,遂更换可操纵导管(Leonis Mova Selective,Asahi Intecc公司,日本),将导管头端调向载瘤动脉出口,导引导丝顺利超选至大脑中动脉,并完成2个Pipeline血流导向装置(4.5mm × 25.0mm, 2.5mm × 25.0 mm)置入。与通常用于输送弹簧圈或支架的微导管相比,输送血流导向装置的微导管需要更大的内径(0.021~0.027英寸),尽管近端导引导管有足够的支撑力,但在迂曲的血管中,较大尺寸的微导管到位仍具有一定的难度,甚至是不可能的。可操纵导管的精准控弯特性,能准确定位载瘤动脉远端出口,降低微导丝超选的难度。由此可见,在颅内巨大动脉瘤的治疗中,可操纵导管可能具有较好的应用前景。
2023年Tokuyama等报道了采用可操纵导管进行选择性经静脉栓塞治疗硬脑膜动静脉瘘(dural arteriovenous fistulas, DAVFs)的经验,该研究回顾性纳入了13例DAVFs患者的27个DAVFs病变,结果显示,可操纵导管完成了26个病变部位血管的超选(26/27,96.3%),术后即刻造影提示,10例患者的瘘管完全闭塞(血管造影或MR血管成像提示完全闭塞),3例患者的分流血量较术前显著下降,有1例患者出现了术后静脉窦血栓形成;中位随访40.9个月,12例患者瘘管完全闭塞,1例患者有少许分流血量残留。DAVFs通常存在多瘘口,供血动脉繁多、纤细,同时颈内外动脉常存在“危险吻合”,单纯行动脉入路栓塞难以应对。而随着导管技术和栓塞材料的发展,静脉入路治疗DAVFs成为新的选择,但静脉入路同样面临着入路迂曲,微导管难以到位的难题,且静脉壁菲薄,微导管过度弯折产生的弹力更容易导致静脉损伤,其中以岩下窦损伤最为常见。因此,面对复杂的DAVFs,需要充分地塑形微导管进行栓塞,但对每一个瘘管都采取体外塑形的方式,不仅耗时长,超选到位成功率也不高,栓塞的成功率和效率也随之下降。Tokuyama等利用可操纵导管(Swift NINJA)在血管腔内可实时调弯的特性,进行DAVFs供血小动脉超选栓塞,达到了96.3%(26/27例)的成功(完成超选栓塞)率,并且2.9F高流量型号的Swift NINJA能够兼容1.6F或1.9F的微导管,使得在血管纤细、迂曲的情况下,可将微导管走得尽可能远,以到达更细的分支靶血管,这对于DAVFs的有效栓塞及减少并发症至关重要。本文涉及的可操纵导管在神经介入领域应用的临床研究见表1。
综上所述,可操纵导管在多种脑血管疾病的介入治疗中均展现出优势,可归因于以下几个方面:一是其可以借助导管头端可实时调弯特点,通过较复杂的靶血管并完成血管内治疗;二是其近端力矩传递性能好,配合可实时调弯特点,进一步加强了其通过性;三是应用可操纵导管减少了手术过程中的导管交换操作,有利于缩短手术时间,提升手术成功率,减少围手术期并发症的发生。
3 总结与展望
近年来可操纵导管应用研究数量不断增加,推动了可操纵导管技术的发展,也为其在临床中的广泛应用提供了理论基础。本文回顾了可操纵导管的研究进展。可操纵导管相较于传统微导管具有以下优点:一是可操纵导管可借助多种原理实现非手动的导管操控,拓展了导管的可操作性与进入特殊血管部位的能力,延伸了介入手术的覆盖范围;二是借助辅助操作系统,可操纵导管可进行精准的导航和定位,有助于减少手术时间,提高手术成功率及减少术后并发症的发生风险,进而改善患者预后;三是可减少医生的操作培训时间和学习曲线,亦减少了医师的辐射暴露量。但可操纵导管仍然面临多种挑战。首先,虽然已经开发出了多种可操纵导管,但目前仍未检索到对可操纵导管进行全面系统评价的文献,可能原因为现阶段对可操纵导管的评价标准不统一且维度单一,对可操纵导管临床应用效果的评价数据缺乏。现有研究偏重于评价可操纵导管的操作灵活性和材料性能,但对其临床应用效果的评价较少。第二,目前研究多认为可操纵导管为一个完全自动化的系统,但临床医师在引导导管方面起着不可替代的作用,整个系统应被视为一个人机结合系统,未来在可操纵导管的技术发展中应时刻关注临床医师操作技能与导管操控性的结合。第三,目前对于可操纵导管的控制,尤其是对其头端的控制研究较少,今后的研究工作可集中在对导管头端的控制上。第四,尚缺乏一种有效的模拟分析系统来模拟可操纵导管的动态行为。建立可操纵导管的模拟系统有助于优化导管设计及建立可操纵导管动态行为的分析模型,以真正实现导管的实时反馈控制。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#神经介入# #可操纵导管#
59