我们不一样 ——原研VS 仿制 “一致“是否等于”一样“?
2023-02-03 网络 网络 发表于上海
在临床上,遇到因为疗效与不良反应的问题更换处方药的问题时候,你是否对于患者服用的仿制药有过疑虑?“一致性”是否等同于“一样”?
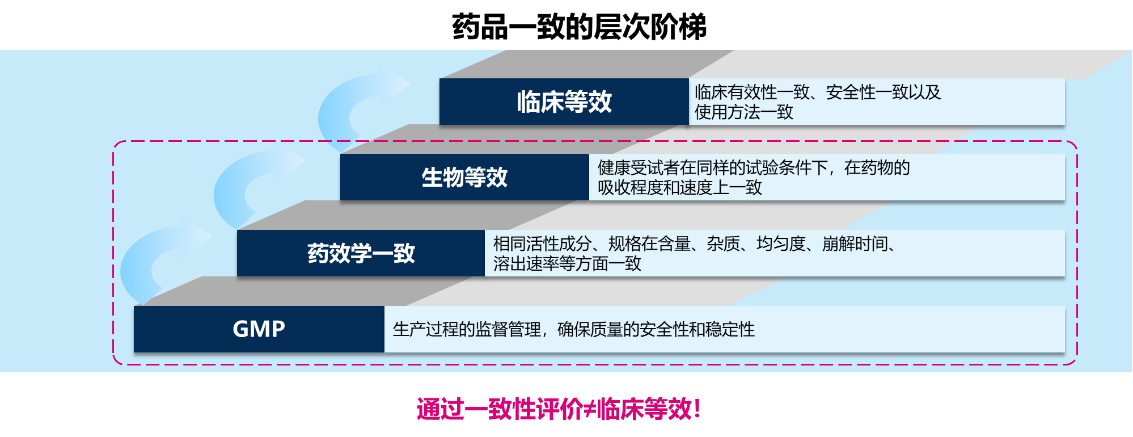
在临床上,遇到因为疗效与不良反应的问题更换处方药的问题时候,你是否对于患者服用的仿制药有过疑虑?“一致性”是否等同于“一样”?药品的安全性和用药的安全性一直以来都是医药工作者时刻关注的话题,因此,要搞清楚这个问题,需要明确一致性评价的流程是怎么样的?药学等效、生物等效两个指标。
仿制药一致性评价流程图1

从一致性评价的流程图中不难看出,药学等效、生物等效(BE)两个指标是判定仿制药一致性评价的关键性指标。
1、 药学等效(pharmaceutical 9] equivalence,PE) 主要由仿制药与原研药体外溶出曲线的一致性来衡量,两者含有相同的活性成分,其规格、剂型、给药途径等关键性药学指标要一致。通过药学等效性确定制剂的生产工艺及处方是否需要变更,从而初步确认制剂与原研药的一致性,还可通过有效的质量控制措施保证两者具有相同的品质。在一致性评价中,溶出曲线的研究是一项重要的体外药学研究,它是制剂成品的质控方法和是否可以豁免 BE研 究的评价工具,也是生物等效评价时的重要支持性证。
2、 生物等效(bioe quivalence,BE))在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。1生物等效用统计学方法分析两者在人体内的差异,但其也不能反映临床等效性。
目前,国内仿制药一致性评价仅要求评估药学等效和生物等效,因此,仅是通过一致性评价,并不能完全代表临床等效。
深究原因,主要由于一致性评价的局限性导致的。具体体现在两个维度上:评价指标与评价方法的局限性。
1、 评价指标的局限性:决定仿制药与原研药质量差异的因素有药品的药学特性、辅料、生产工艺、杂 质、稳定性和溶出度等。药学等效性研究中未涵盖质量标准、药物活性成分的晶型和粒度、杂质等主要药学指标的一致性比较。即使是同一药物,如果粒度或晶型不同,不仅物理性质会有所不同,其生物活性也有明显差异,临床应用受到干扰。相似的,即使辅料的品种和型号相同,加入的量和顺序上的差异最最终影响药品的临床疗效。而辅料的控制、工艺、生产是我国制药业的薄弱环节3。
2、 生物等效性研究局限性:因时间、样本量以及健康受试者和患者生理状况的差异,单剂量研究难以反映长期用药的实际情况2。比如出于伦理和研宄考虑,BE试验大多是在18-24例健康受试者身上所进行的,而药品上市后使用中对象多为老人及疾病患者,药物在两种不同人群体内的代谢情况将有较大差别。另外用于生物等效判定的重要参数值仅为区间要求,存在非完全等效的可能性,导致疗效或不良反应上的差异1。
一致性评价缺乏长期稳定性和批间质量差异的验证,随时间变化和不同批次引起的质量稳定性差异最终体现在药品的疗效和安全性上。21项RCT研究的Meta分析结果显示,在有效性方面,原研药与仿制药在降低患者LDL-C 和升高 HDL-C 的程度方面差异无统计学意义,而在降低患者TC、TG的程度方面,仿制药小于原研药,并且差异有统计学意义4。
张亮等人通过对比原研与仿制莫西沙星注射液在治疗社区获得性肺炎中的成本-效果分析,发现仿制和原研的7d有效率接近,原研药虽略高但无统计学差异。然而在不良反应发生率方面,仿制组显著高于原研组5。
岳小林等人结合北京市集采中选的25个药品采购、临床诊疗及不良反应数据,对集采中选药品使用情况及效果予以分析,药品不良反应观察时间为:2017年3月23日至2021年3月22日。研究结果显示,有一半以上的药品在带量采购后ADR上报率有所增加,厄贝沙坦与厄贝沙坦氢氯噻嗪片均名列在其中6。
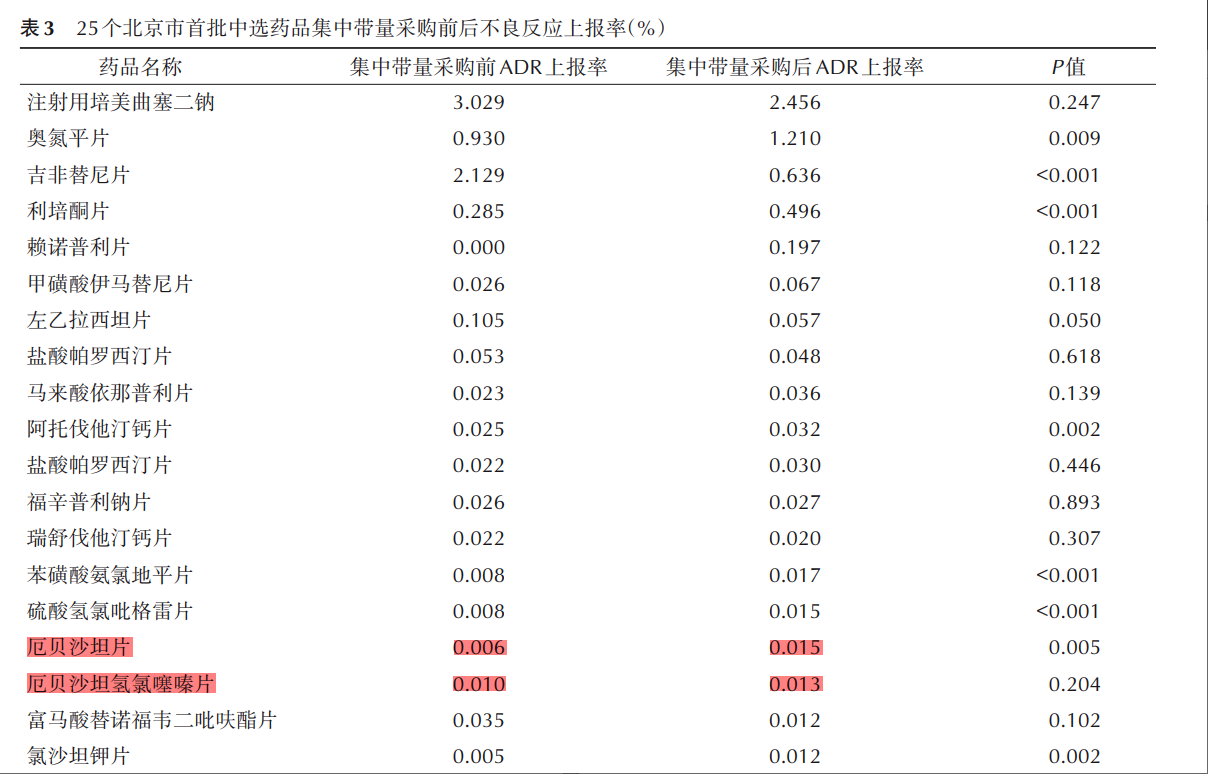
从数据可以看出,带量采购前后厄贝沙坦、厄贝沙坦氢氯噻嗪片ADR上报率均有所增加,厄贝沙坦的不良反应上报率已经达到了带量前的2.5倍。
小结
生物利用度偏差,临床数据不足,原料药、辅料&杂质、生产工艺差异等多种因素可能导致仿制药不能达到临床等效,以上“过评仿制药”的问题反映了评价方法、内容的局限以及一致性评价的不足之处,因此,一致性评价不等于临床等效。仿制药在临床疗效上的一致性还需要有更多的患者人群及其长期观察的数据来证明,“过评仿制药”需要在真实世界中检验其疗效以及安全性。原研厄贝沙坦(安博维)、厄贝沙坦氢氯噻嗪片(安博诺)有着更严格的质控标准,药品质量更有保障,临床证据充足,更符合临床医生选择药物的需求。
引用文献
[1]王青宇.(2018).仿制药一致性评价政策研究(博士学位论文,沈阳药科大学).
[2]刘裕. (2022). 仿制药一致性评价的现状分析. 中国社区医师, 38(22), 3.
[3]周娜, 赵鸿剑, & 梁毅. (2018). 从制药企业角度谈完善我国仿制药一致性评价体系. 机电信息(32), 5.
[4]吕淑贤,梁笑笑,杨蕊,李晓,李妍,韩毅 & 黄欣.(2022).阿托伐他汀仿制药与原研药的有效性和安全性系统评价. 中国药房(03),358-365.
[5]张亮, 侯文洁, 周秋云, 张宇, 方中坚, & 邵蓉. (2021). 原研与仿制莫西沙星注射液在治疗社区获得性肺炎中的成本-效果分析. 中国医院药学杂志, 41(3), 5.
[6]岳小林, 付娜, 赵艳玲, 封宇飞, 果伟, & 林阳等. (2022). 国家集中带量采购中选药品疗效与安全性的真实世界研究. 临床药物治疗杂志, 20(6), 6.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














既然这样是不是可以把一致性评价标准提高
81