Cell:重磅!一些细胞在有丝分裂前需要发生纤毛断头
2017-01-15 佚名 生物谷
我们的很多细胞具有将关于外部环境的信息传递到它们内部的毛状“天线”,而且科学家们已发现这些所谓的初级纤毛(primary cilia)在被称作有丝分裂的细胞复制过程中保持同步。如今,在一项新的研究中,来自美国约翰霍普金斯大学的研究人员报道了关于这种“纤毛丢失”和细胞复制如何通过纤毛末端的动态剪断----他们称之为断头(decapitation)---相关联在一起的新发现。相
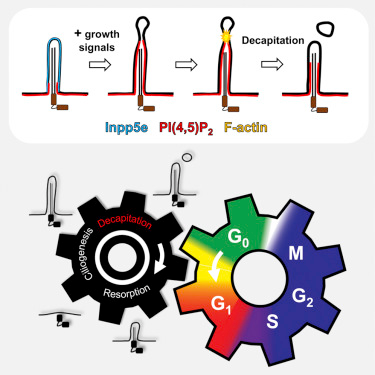
研究人员说,这些新的发现是更好地理解细胞如何决定经历有丝分裂的关键。有丝分裂在有机体发育、组织修复和癌症形成中发挥着不可或缺的作用。他们也希望他们的研究将有助认识纤毛相关疾病,如多囊性肾病和某些智力障碍。
论文共同通信作者、约翰霍普金斯大学医学院细胞生物学副教授Takanari Inoue博士说,“纤毛断头在之前已观察到,但从未被研究过。我们如今知道这是一个正常的过程,而不是在某些环境条件下才会发生的现象。我们鉴定出促使它发生的重要分子。”
就好比小型货车上的天线,初级纤毛是出现在肾脏、大脑、视网膜和内耳等器官中的细胞表面上的微型结构,给细胞提供关于外面流体的流动和化学性质的信息。
当细胞未发生分裂时,即处于一种被称作静止的状态,大多数细胞结构仍然持续地发生改变,但是初级纤毛相对而言保持稳定。Inoue和他的团队试图理解当细胞退出静止状态开始有丝分裂时,是什么导致纤毛断头。在有丝分裂期间,复制后的染色体分开,有两个新的子细胞产生。
鉴于之前的研究已指出酶Inpp5e参与纤毛的稳定性,研究人员首先比较了细胞在不同状态下所含有的Inpp5e水平。在给处于静止状态下的小鼠胚胎细胞的纤毛膜添加一个荧光标记后,他们视频录制了纤毛的末端。这些末端似乎每几个小时一次地被剪断,并漂走。
在缺失Inpp5e基因的细胞中,当给细胞提供促进有丝分裂的信号时,这种断头速度更高。但是,当研究人员导入Inpp5e基因时,该基因产生的Inpp5e蛋白在纤毛中聚集,结果纤毛断头速度显著下降。Inoue说,这提示着纤毛中Inpp5e的存在阻止这种断头过程,而且有丝分裂信号将Inpp5e从纤毛中驱逐出去,从而促进纤毛断头。
Inoue说,“鉴于Inpp5e基因突变与Jourbert综合症相关联,我们如今猜测Inpp5e影响大脑发育。Jourbert综合症的特征是异常的大脑发育和智力障碍。”
Inpp5e的功能是让纤毛膜中的类脂肪分子PIP2耗竭。研究人员利用结合到PIP2上的一种荧光标记证实PIP2在纤毛(特别是纤毛末端附近)中的浓度也保持同步:在细胞接受到有丝分裂信号后,PIP2聚集在纤毛的末端,而且纤毛在PIP2的聚集位点发生断裂。
鉴于PIP2在由肌动蛋白组成的线状结构形成中发挥着关键性作用,研究人员利用一种荧光生物传感器对纤毛中这些结构的形成进行测量和观察。在因缺乏Inpp5e而含有过量PIP2的纤毛中,他们发现这些线状结构的形成数量增加了10倍。此外,他们观察到这些线状结构正好在断头位点上形成,而且形成时间仅仅是比断头发生时间提前几分钟而已。
Inoue说,“我们认为这些线状结构的形成确实提供让纤毛断头的力量。”为了观察这种断头如何影响纤毛剩余部分的解体,论文共同通信作者、Inoue实验室研究生Siew Cheng Phua设计出阻止这些线状结构在纤毛内形成的方法。她发现这些线状结构在纤毛断头中起着至关重要的作用,而且这种断头是纤毛完全解体所必需的。
接下来,研究人员分析了纤毛断头的时间安排。利用多种荧光标记,他们追踪细胞从静止状态过渡到有丝分裂的过程。利用蓝色荧光标记纤毛。随着实验的进行,细胞核由黄色荧光变化为红色荧光,再变化为黑色。在正常的细胞中,尽管它们仍然处于静止状态(黄色的细胞核),而且在转换到有丝分裂(黑色的细胞核)之前,纤毛断头通常就已发生。但是在阻止纤毛产生线状结构的细胞中,纤毛不能够断头与这种细胞由静止状态更加缓慢地转换到有丝分裂相关联。
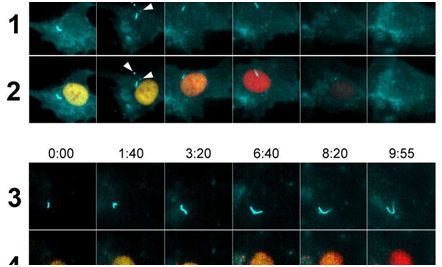
当研究人员分析了发生断头的纤毛末端的内含物时,他们主要发现了在细胞信号转导和纤毛生长中起着重要作用的分子,这提示着纤毛断头对纤毛的组成和功能进行调节。
根据Phua的说法,这些切断的纤毛末端可能也具有临床意义。最近的研究已表明来自多囊性肾病患者的尿液含有包裹在膜中的微小囊状结构。Inoue说,它们很可能是纤毛末端,在疾病产生中发挥着作用,但是还需开展更多的研究来证实这一点。
Phua补充道,“纤毛的异常感知功能与皮肤癌和脑癌等癌症相关联。纤毛断头与有丝分裂之间的这种新的关联可能有助我们理解初级纤毛缺陷如何影响异常的细胞分裂。异常的细胞分裂是癌症形成的基础。”
Siew Cheng Phua, Shuhei Chiba, Masako Suzuki, Emily Su, Elle C. Roberson, Ganesh V. Pusapati, Mitsutoshi Setou, Rajat Rohatgi, Jeremy F. Reiter, Koji Ikegami, Takanari Inoue.Dynamic Remodeling of Membrane Composition Drives Cell Cycle through Primary Cilia Excision.Cell.2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Cell#
65
#CEL#
57
#有丝分裂#
94
#重磅#
0