Adv Mater:陈学思/李明强/陶玉设计新型的脂质体,增强肿瘤免疫治疗效果
2023-01-01 iNature iNature 发表于上海
自然杀伤(NK)细胞疗法显示出肿瘤治疗的潜力,但过度表达的肿瘤细胞表面免疫抑制聚糖对其免疫治疗效果产生较大的负面影响。
自然杀伤(NK)细胞疗法显示出肿瘤治疗的潜力,但过度表达的肿瘤细胞表面免疫抑制聚糖对其免疫治疗效果产生较大的负面影响。为逆转这种糖介导的免疫抑制,需要下调表面NK抑制性聚糖的表达,同时将NK激活性聚糖同步提高到最佳水平。
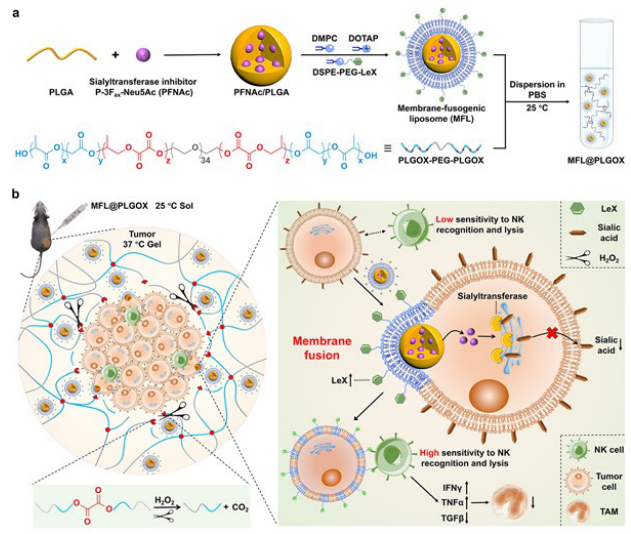
2022年12月24日,中国科学院长春应用化学研究所陈学思、中山大学李明强和陶玉共同通讯在Advanced Materials 在线发表题为“Membrane-fusion-mediated multiplex engineering of tumor cell surface glycans for enhanced NK cell therapy”的研究论文,该研究设计了一种核-壳膜融合脂质体(MFL),通过膜融合的方式,同时实现肿瘤细胞表面NK活化多糖的物理修饰和免疫抑制多糖的生物抑制。将其负载到肿瘤微环境触发的可降解温敏水凝胶中,MFLs可便捷注射并可控地释放到肿瘤局部。
通过与肿瘤细胞膜融合,释放的MFLs可同时将载有唾液酸转移酶抑制剂的核心递送到细胞质中,并将NK激活聚糖修饰的外壳锚定在肿瘤表面。细胞中核、壳的空间差异分布确保了细胞内唾液酸转移酶的有效抑制,从而下调免疫抑制性唾液酸,同时在肿瘤表面直接呈递激活NK的Lewis X三糖(LeX)。因此,唾液酸引起的肿瘤表面免疫抑制被重新编程为LeX诱导的NK激活导致对NK细胞介导的识别和裂解的敏感性,从而提高肿瘤治疗效果。该MFL的构建为多重细胞工程和细胞间相互作用的个性化调节提供了一个崭新平台,可用于癌症免疫治疗的增强。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言